制备过程对Cu-Fe复合载氧体特性的影响
蒋守席, 沈来宏, 闫景春
(1.徐州工程学院 物理与新能源学院,江苏 徐州 221018;2.东南大学 能源与环境学院 能源热转换及其过程测控教育部重点实验室,江苏 南京 210096)
中国能源以化石燃料为主,而且这种情况在短时间内难以改变。随着化石燃料的开发利用,中国碳排放压力在不断增加。化学链燃烧是一种可以实现CO2内分离的新型燃烧技术,从而缓解化石燃料利用和CO2排放之间的巨大矛盾[1]。化学链燃烧系统通常是由2个反应器所组成:空气反应器和燃料反应器。载氧体在这2个反应器之间循环反应,进行氧与热的传输和交换,实现化学链系统的运转[2]。在燃料反应器中,燃料完成转化,只生成CO2和H2O,而后在燃料反应器出口,将H2O冷凝后得到纯CO2,实现CO2的分离;同时,载氧体被燃料还原。还原后的载氧体循环进入空气反应器中,与空气反应器中的氧气反应,实现载氧体的氧化和再生。
载氧体是化学链系统运行的关键因素,需具有高还原氧化活性、抗烧结、价格低廉和环境友好等特性。目前,载氧体通常为金属氧化物,如NiO、CuO、Fe2O3等。但研究表明这些单组分载氧体存在一定的缺陷[3-5],如:镍基载氧体价格昂贵且有一定的毒性,会造成二次污染;铜基载氧体的熔点较低,易烧结团聚,从而影响载氧体的活性和流化特性;铁基载氧体的活性相对较低,尤其是Fe3O4/FeO和FeO/Fe还原阶段,因而燃料的转化率低。复合载氧体能够弥补单组分载氧体的不足,且存在一定的协同作用,因而受到广泛关注[6-8]。由于铁基载氧体具有低成本和环境友好等特性,因此采用铁基载氧体和其他活性较高的载氧体制备复合载氧体,例如Fe-Ni载氧体、Fe-Mn载氧体和Cu-Fe载氧体[9-12]。但Ni和Mn都有一定的毒性,因此Cu-Fe复合载氧体受到更广泛的关注。此外,Cu-Fe 复合载氧体中的Fe2O3和CuO在高温条件下会发生固-固反应,生成CuFe2O4,并产生协同作用,从而表现出较高的活性;且Cu-Fe载氧体依然具有氧解耦的特性,使得Cu-Fe复合载氧体具有较好的发展前景[13-14]。因此,探究Cu-Fe复合载氧体对于化学链技术的发展具有一定的意义。笔者主要考察了燃烧合成法制备Cu-Fe复合载氧体过程中煅烧时间和温度对于其化学链燃烧特性的影响。
1 实验部分
1.1 Cu-Fe复合载氧体的制备
为降低载氧体的制备成本,Cu-Fe复合载氧体利用燃烧合成法制备:首先将质量比为1∶1的Fe2O3(成都市科龙化工试剂厂产品,AR)和CuO(上海华精生物高科技有限公司产品,AR)粉末均匀混合,然后加水至糊状,静置24 h,再放进设定好温度(800、900、1000 ℃)的马弗炉中进行高温煅烧,最后破碎得到实验所需的Cu-Fe复合载氧体样品(<0.1 mm),实验样品量为0.1 g。
1.2 固定床反应器
基于Cu-Fe复合载氧体的化学链燃烧特性实验在固定床反应器中进行。固定床反应器由气体控制装置、固定床反应装置和气体分析装置所组成,示意图如图1所示。固定床反应装置是一根内径为32 mm,高为800 mm的石英管,其中间布置陶瓷纤维以放置载氧体,通过外部电加热进行升温,并通过反应区的热电偶控制反应温度。采用氮气(2 L/min)作为平衡气和载气,CO(10 mL/min)作为还原性气体。
1.3 数据处理
失氧量n(mmol)是还原过程中载氧体被还原时所减少的晶格氧物质的量,通过反应过程生成CO2的体积分数进行计算,如式(1)所示:
(1)
其中:qn(N2)为反应过程中N2的摩尔流量,mmol/s;t为还原反应的时间,s;φ(CO)和φ(CO2)分别为反应时间t时反应器尾气中CO和CO2的体积分数,%。
相对失氧率η(%)是衡量载氧体循环反应稳定性的指标,是第i个循环还原过程中的失氧量ni(mmol)与第1个循环还原过程中的失氧量n1(mmol)的摩尔比值,如式(2)所示。
(2)
CO2产率x(%)是气体燃料CO转化为CO2的体积分数,用于表征Cu-Fe复合载氧体化学链燃烧特性,如式(3)所示。
(3)
式中,φ(CO2)和φ(CO)分别为反应器出口尾气中CO2和CO体积分数,%。
失氧率ηO(%)用来衡量载氧体在还原过程中被CO还原的程度,通过实际还原过程中载氧体丢失的晶格氧量nr(mmol)与载氧体中的氧量nt(mmol)的摩尔比值计算得到的,如公式(4)所示:
(4)
其中,载氧体氧量nt是载氧体理论含有氧原子的物质的量,如公式(5)所示:
(5)
其中:m是载氧体样品的质量,g;M(Cu)和M(Fe)分别是CuO和Fe2O3的相对分子质量。
2 结果与讨论
Cu-Fe复合载氧体制备过程中,当煅烧温度超过488 ℃时,Cu-Fe复合载氧体中的Fe2O3和CuO发生固-固反应生成CuFe2O4,改变了Cu-Fe复合载氧体的物相和物理结构,从而影响载氧体的氧化还原性能[12-13]。因此,考察Cu-Fe复合载氧体制备过程参数对Cu-Fe载氧体物相和其循环反应特性的影响。
2.1 煅烧时间对载氧体物相和循环反应特性的影响
在900 ℃的煅烧温度下,不同煅烧时间下的Cu-Fe复合载氧体的X射线衍射(XRD)分析结果见图2所示。由图2可知,不同煅烧时间制备的 Cu-Fe 复合载氧体主要由CuFe2O4和CuO组成。当煅烧时间小于8 h时,Cu-Fe复合载氧体中仍存在少量的Fe2O3,表明有少量Fe2O3未与CuO反应生成CuFe2O4。另外,Fe2O3对应的峰值随煅烧时间的增加而减小,表明未反应Fe2O3的含量随煅烧时间的增加逐渐减少。煅烧8 h后,Fe2O3对应的峰消失,表明Cu-Fe复合载氧体中的铁元素完全以CuFe2O4的形式存在,即在煅烧8 h后,Cu-Fe复合载氧体中的物相趋于稳定。

图2 不同煅烧时间制备的Cu-Fe复合载氧体的XRD图谱Fig.2 XRD patterns of Cu-Fe composite oxygen carriers prepared by different calcination time
当煅烧温度为900 ℃时,不同煅烧时间制备的Cu-Fe复合载氧体,在还原过程中其相对失氧率和失氧量随循环反应次数变化的关系见图3和图4。由图3知,煅烧时间小于6 h的Cu-Fe复合载氧体,在前8次循环反应期间,其相对失氧率随着循环反应次数的增加而逐渐增高,而在第8个循环反应后,其相对失氧率开始降低。相对失氧率降低的原因,可能是循环反应过程中因复合载氧体烧结导致了其活性降低。当煅烧时间大于等于8 h时,Cu-Fe复合载氧体的相对失氧率随着循环反应次数的增加一直增加,没有出现相对失氧率下降的现象。表明在煅烧时间大于等于8 h时,所制备的Cu-Fe复合载氧体的氧化还原特性更加相对稳定。但从图4中可知,煅烧时间为10 h时所制备的Cu-Fe复合载氧体,在还原过程中的失氧量明显低于煅烧时间为 8 h 时所制备的Cu-Fe复合载氧体。因此,Cu-Fe复合载氧体制备过程中较为适宜的煅烧时间是8 h。

图3 循环还原反应过程中不同煅烧时间制备的Cu-Fe复合载氧体的相对失氧率Fig.3 Relative ratio of lost oxygen for Cu-Fe compound oxygen carrier with different calcination time during reduction cycleCalcination temperature: 900 ℃
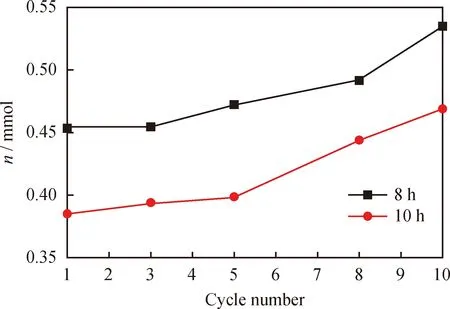
图4 循环还原反应过程中不同煅烧时间制备的Cu-Fe复合载氧体的失氧量Fig.4 Amount of lost oxygen for Cu-Fe compound oxygen carrier with different calcination time during reduction cycleCalcination temperature: 900 ℃
2.2 煅烧温度对载氧体循环反应特性的影响
煅烧时间为8 h时,不同煅烧温度下制备的 Cu-Fe 复合载氧体在还原反应过程中的失氧量随循环反应次数的变化关系见图5。由图5看到,在第1次反应时,Cu-Fe复合载氧体失氧量随煅烧温度的升高而降低,主要是因为煅烧温度越高,Cu-Fe 复合载氧体在煅烧过程中的烧结越严重,导致其活性越低。当煅烧温度为1000 ℃时,Cu-Fe复合载氧体出现明显的烧结成块的现象,如图6所示。因此,在10次循环反应过程中,1000 ℃煅烧制备的载氧体在还原过程中的失氧量,远小于800 ℃和900 ℃煅烧制备的载氧体的失氧量。为保证载氧体的氧化还原性能,在Cu-Fe复合载氧体的制备过程中,煅烧温度应小于1000 ℃。当煅烧温度为800 ℃时,Cu-Fe复合载氧体失氧量随循环反应次数的增加而逐渐减小,表明随着循环反应次数的增加,800 ℃ 制备的Cu-Fe复合载氧体的反应活性逐渐降低。而当煅烧温度为900 ℃时,Cu-Fe复合载氧体的失氧量随循环反应次数的增加逐渐升高,在第5次循环反应后,900 ℃ 制备的Cu-Fe复合载氧体失氧量开始高于800 ℃制备的Cu-Fe复合载氧体。因此,制备 Cu-Fe 复合载氧体的较为合适的煅烧温度为900 ℃。

图5 循环还原反应过程中不同煅烧温度制备的Cu-Fe复合载氧体的失氧量Fig.5 Amount of lost oxygen for Cu-Fe composite oxygen carrier with different calcination temperatures during reduction cycleCalcination time: 8 h

图6 1000 ℃煅烧温度时制备的Cu-Fe复合载氧体块状照片Fig.6 Pictures of massive Cu-Fe compound oxygen carrierwith calcination temperature of 1000 ℃(a) Oxygen carrier surface; (b) Oxygen carrier cross sectionCalcination time: 8 h
2.3 Cu-Fe复合载氧体的循环反应特性
由2.1、2.2节可知,当煅烧温度为900 ℃、煅烧时间为8 h时,所制备的Cu-Fe复合载氧体具有更好的反应活性和循环反应稳定性。该条件下所制备的Cu-Fe复合载氧体在循环反应过程中的失氧量随反应时间的变化关系见图7。从图7可知,Cu-Fe复合载氧体在还原过程中的失氧量,随反应时间和循环反应次数增加而增加,表明Cu-Fe复合载氧体在循环过程中,没有产生烧结等情况所导致的载氧体活性降低的现象。

图7 循环还原反应过程中Cu-Fe载氧体的失氧量Fig.7 Amount of lost oxygen for Cu-Fe oxygen carrier during reduction cycleCalcination temperature: 900 ℃;Calcination time: 8 h
CO2产率随Cu-Fe复合载氧体失氧率的变化关系见图8所示。由图8可知,在不同循环反应次数的过程中,CO2产率曲线随Cu-Fe复合载氧体失氧率变化趋势相似:CO2产率随载氧体失氧率的升高先迅速增加达到峰值,然后快速降低。这是由于随着Cu-Fe复合载氧体失氧率的增加,载氧体被还原的程度加深,其氧化还原性能降低,从而Cu-Fe复合载氧体对应的CO2产率随之降低[5]。随循环反应次数增加,CO2产率的峰值增高,主要原因可能为,随着气-固反应的进行,载氧体内部产生了气体通道,改善了载氧体与CO气体之间的气-固接触,从而提高了CO2产率。

图8 循环还原反应过程中CO2产率随Cu-Fe载氧体失氧率的变化Fig.8 Variation of CO2 yield with the ratio of lost oxygen for manufactured Cu-Fe oxygen carrier during reduction cycleCalcination temperature: 900 ℃; Calcination time: 8 h
3 结 论
基于燃烧合成法制备的Cu-Fe复合载氧体,在小型固定床反应器上以CO作为燃料,分别考察了制备过程中,煅烧温度和煅烧时间对Cu-Fe复合载氧体化学链燃烧特性和循环反应特性的影响。X射线衍射分析表明,在900 ℃煅烧温度下,煅烧时间超过8 h,CuO和Fe2O3能完全反应生成CuFe2O4,物相开始稳定。8 h的煅烧时间和900 ℃的煅烧温度下制备的Cu-Fe复合载氧体具有较好的循环稳定特性和较高的反应活性。因此,适于制备Cu-Fe复合载氧体的煅烧时间和煅烧温度分别是8 h和900 ℃。

