灵杆菌核酸酶重组表达工艺研究
韩烁 陶晓莎 黄鹏 刘庆伟 姜亮
【摘要】目的:优化灵杆菌核酸酶(NU)工程菌pET3c-NU/BL21STAR(DE3)pLysS 30L发酵罐培养及表达条件。方法:上罐发酵采用M9-YT-Glu发酵培养基,IPTG诱导;通过还原SDS-PAGE法测定目标蛋白表达量,RP-HPLC法测定乙酸残留量,以确定表达温度、时间等参数。结果:与讨论]NU重组菌诱导温度为30℃、加入终浓度0.2M IPTG诱导,维持诱导时间4hr,目的蛋白表达量占菌体蛋白总量的30%左右,为后续rNU融合蛋白纯化奠定了基础。
【关键词】灵杆菌核酸酶;重組表达;发酵条件优化
【中图分类号】R543
【文献标识码】B
【文章编号】2095-6851(2020)02-045-01
中国分类号 Q786 文献标识码 A
在人用预防及治疗类生物制品的质量标准中,核酸残留量是重要指标,直接关系到产品的安全性。在疫苗工业及蛋白质和多糖类工业中,应用灵杆菌核酸酶可将产品中的核酸污染降低至皮克级,目前,该方法已成为通用做法。我国是疫苗使用和生产大国,故灵杆菌核酸酶在生物医药产业特别是疫苗生产中具有非常广阔的应用市场[1]。
灵杆菌核酸酶是来源于粘质沙雷氏菌(Serratia marcescens,又称灵杆菌)的非限制性广谱核酸酶,可在核酸链内的任意核苷酸间进行切割,并可切割任意形式的核酸。其酶切效率远高于其它核酸酶,活性是牛胰DNase I的34倍,是金黄葡萄球菌核酸酶的6倍[2]。
然而,灵杆菌是一种致病菌,对其大规模培养存在较大风险。目前市场上的主导产品为Merk公司生产的商品名为Benzonase的灵杆菌核酸酶,该产品已通过美国FDA的使用许可,广泛用于除去生物制品中的核酸,但产量低价格昂贵。国内生产厂家较少,探索灵杆菌核酸酶的规模化生产工艺以满足医药工业的生产要求[3]。
1 材料与方法
1.1 材料
1.1.1 菌株 pET3c-NU/BL21STAR(DE3)pLysS工程菌由临沂大学药学院构建。
1.1.2 培养基 (1)LB液体培养基:1.0%胰蛋白胨,0.5%酵母提取物,1.0% NaCl,pH 7.0;(2)LB固体培养基:在LB液体培养基中补加1.0%琼脂;(3)含氨苄青霉素的LB(LA)液体(或固体)培养基:在LB培养基加入氨苄青霉素(100 μg/mL);(4) M9-YT-Glu发酵培养基:0.5%胰蛋白胨,0.3%酵母提取物,0.06%NaCl, 0.5%KH2PO4,3%Na2HPO412H2O,1%葡萄糖,0.1%MgSO4,0.1%NH4Cl;(5)补料培养基:30%葡萄糖,5%胰蛋白胨,3%酵母提取物。
1.1.3 主要试剂 胰蛋白胨、酵母提取物购自英国Oxoid公司,中分子量蛋白质Marker购自天根生化科技有限公司,IPTG购自索莱宝,无机盐、葡萄糖等购自上海生工。
1.1.4 主要仪器设备 HSX-150恒温恒湿箱,上海申贤恒温设备厂; HNY恒温培养振荡器,天津市欧诺仪器仪表有限公司;ChampGel 5000数码凝胶成像分析系统,北京赛智创业科技有限公司;TU-1810紫外可见分光光度仪,北京普析通用仪器有限责任公司;LC-10AT高效液相色谱仪,日本岛津仪器有限公司。
1.2 方法
1.2.1 菌密度测定 用紫外可见光光度法测定发酵液600nm波长时光吸收值,以未接种培养基作参比。
1.2.2 目标蛋白表达水平的测定 采用还原SDS-PAGE电泳考马斯亮兰染色法,电泳凝胶经扫描后分析重组蛋白占菌体总蛋白的百分含量。
1.2.3 质粒丢失率的检测方法 将待测发酵液测OD600值,以无菌水稀释,使培养液均达到OD600为0.2。然后取200μl涂LB平板,37℃培养48hr。从培养好的LB平板上挑一单菌落同时转接到LB和LA(含100μg/ml氨苄青霉素)平板上,37℃培养48hr。计算菌落数,LB平板上的菌落数为M,LA平板上的菌落数为N,则丢失率计算方法为(M-N)/M×100%。
1.2.4 乙酸含量测定 (1)乙酸含量测定方法:将待测发酵液离心,收集上清,取500μl上清溶液加入200μl 50%的硫酸溶液,混匀后再加入500μl乙醚溶液,摇匀,离心。取上层溶液10μl通过C18(4.6×250mm)柱,用高效液相色谱法测定其含量,流动相为98% 50mM KH2PO4,2%甲醇,pH2.5;检测波长210nm;流速1ml/min;时间15min。通过计算乙酸特异吸收峰的峰面积计算待测样品的乙酸含量。(2)标准曲线的绘制:以冰醋酸溶液为标准,配制0.1mg/ml,0.5mg/ml,1.0mg/ml,1.5mg/ml,2.0mg/ml,2.5mg/ml六个浓度。分别取500μl上述溶液加入200μl 50%的硫酸溶液,混匀后再加入500μl乙醚溶液,摇匀,离心。取上层溶液10μl 进行含量测定,并制作标准曲线。
1.2.5 工程菌的培养方法(30升发酵罐规格)
(1)种子菌的活化:取-80℃,12.5%甘油保存的生产种子库菌种,划线接种于含氨苄(100μg/ml)的LB斜面,37℃培养过夜,挑菌苔于含氨苄(100μg/ml)LB培养基中,37℃,200rpm振摇培养至OD600 为0.4-0.5时,作为活化种子4℃保存。(2)种子液培养:取活化种子,以1:100接种于400ml LB培养基中,30℃,150rpm ,培养15hr,作为一级种子液。再以1:10接种于2L LB培养基的三角瓶中,37℃,250rpm ,培养2hr,作为上罐种子液。(3)发酵工艺:发酵上罐培养基18L,培养基配方为 M9-YT-Glu。取种子液2000ml,加入发酵罐中,使终体积为20L。调整工艺参数:设定温度37℃,转速300rpm,pH用50%氨水自动调至7.0。当发酵至3-4hr,开始流加营养液。待菌体OD600达到8-12,溶氧值开始上升时,降温至30℃,以不同IPTG终浓度(0.1M、0.2M、0.3M )进行诱导,诱导时间2-6小时,每1小时取1次样品。样品离心、作SDS-PAGE电泳,观察蛋白表达情况。
2 结果与分析
2.1 诱导温度对蛋白表达的影响
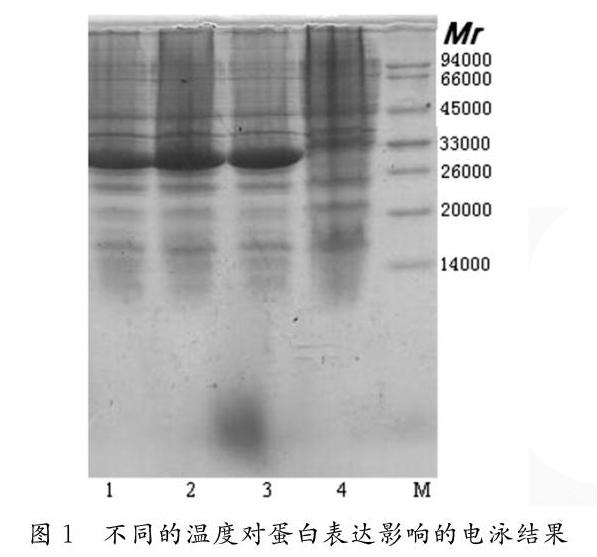
温度在发酵过程中的影响一方面表现在工程菌产物合成的数量,另一方面表现在工程菌自身数量的增长。大肠杆菌的最适生长温度为37℃,是使比生长率达到最大值的温度。将种子液以1:10接入发酵罐中,37℃培養至菌体OD600达到10-12,加入终浓度为0.2M IPTG诱导,同时控制温度至25℃、30℃、37℃,诱导时间4hr,收集菌体进行SDS-PAGE分析。
如图1所示,三个温度均可见明显目标蛋白表达条带,其中30℃和25℃对菌体数量增值及表达量明显优于37℃时表达量;30℃时菌体生长迅速,培养周期短,效率高,综上,选择诱导温度为30℃。
2.2 不同诱导时间对蛋白表达的影响
按上述筛选的发酵工艺进行发酵一次,在不同发酵时间分别取样测定乙酸含量变化、质粒丢失率以及目的蛋白表达量的关系。
2.2.1 乙酸含量测定方法学研究
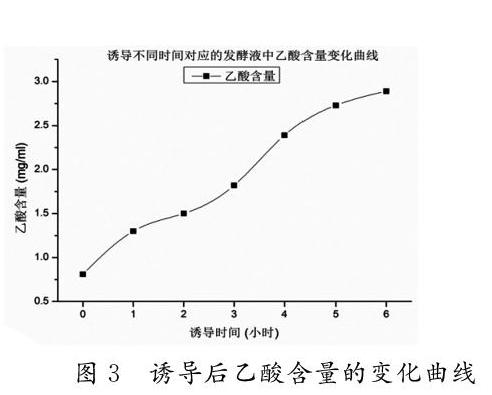
如下图2所示:乙酸还原到发酵液上清后,其保留时间(5.090)与标准品溶液(5.090)完全一致,主峰前后未有明显杂质峰出现,峰面积回收率98.2%,该方法可用于发酵液上清乙酸残留量测定
如表1所示,乙酸含量在0.1-2.5mg/ml之间时,含量值与210nm响应值之间线性范围良好(R2=0.9996),在此范围可准确测定发酵液上清乙酸残留量。
2.2.2 不同诱导时间乙酸残留量及质粒丢失率测定
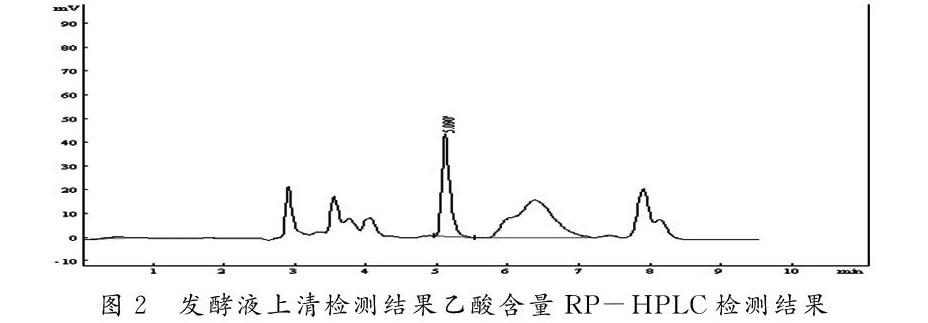
分别在诱导前和诱导后1hr-6hr取发酵液测定发酵液上清中乙酸的含量,并通过平板培养法计算不同诱导时间的质粒的丢失率。结果如下图3所示,随诱导时间的延长,发酵液中乙酸含量呈增加趋势。在加入诱导剂诱导2小时后,开始渐有质粒丢失,当诱导时间维持至5小时后,质粒丢失率显著增加。乙酸含量增加严重影响质粒稳定性。
3 结论与讨论
rNU工程菌的发酵,选择M9-YT-Glu盐培养基作为生产发酵培养基,降低温度为30℃并加入终浓度0.2M IPTG诱导,维持诱导时间4hr,目的蛋白表达量占菌体蛋白总量的30%左右,为后续rNU融合蛋白纯化奠定了基础。
参考文献:
[1] Yang Zhu,et al.The Smart Solution for DNA Removal in Biopharmaceutical Production by Benzonase Endonuclease[J].Applied Virology, 2013, 2(1):25-33.
[2] Andrea Balan, et al. A conditional suicide system for Saccharomyces cerevisiae relying on the intracellular production of the Serratia marcescens nuclease [J]. Yeast,2005,22:203-212.
[3] Shuli Liang, et al. Endogenous signal peptides efficiently mediate the secretion of recombinant proteins in Pichia pastoris [J]. Biotechnol Lett, 2013, 35:97–105.

