胶质瘤组织和胶质瘤干细胞miR-520f-3p表达及临床意义
李霞,任玉嫄,姜忠彩,周新刚
1航空总医院,北京 100012;2首都医科大学附属北京地坛医院
胶质瘤是中枢神经系统中最常见的原发性恶性脑肿瘤,根据统计数据显示,胶质瘤约占所有中枢神经系统肿瘤的28%,约占所有恶性颅内肿瘤的80%[1]。尽管目前对胶质瘤的治疗采用多模式治疗手段,包括手术、放疗和化疗,但胶质瘤的预后仍不容乐观[2],尤其是胶质母细胞瘤,患者的平均存活时间仅12~15个月[3]。目前胶质瘤的发病机制尚不清楚,但越来越多的证据表明,胶质瘤的发生发展与微小RNA(miRNAs)的调控密切相关[4],miRNAs是一类广泛存在的小分子非编码RNA,在多种疾病中均存在表达异常,包括人类恶性肿瘤[5,6]。此外,肿瘤组织中存在一小部分肿瘤细胞具有干细胞特性,被称为肿瘤干细胞,是肿瘤发生发展及复发的根源[7]。相关研究已经证实,miRNAs可调控多种肿瘤干细胞的恶性行为[8]。miR-520f-3p是新近发现的miRNA,目前对其研究较少。研究发现,miR-520f-3p在胶质瘤患者血清细胞分泌的外囊泡中高表达[9],同时雄激素受体(AR)/ miR-520f-3p / SOX9信号通路可增加肝癌干细胞的表型[10]。2014年6月~2017年6月,我们检测了miR-520f-3p在胶质瘤组织和胶质瘤干细胞(CSCs)中的表达,并探讨其意义。
1 材料与方法
1.1 材料 组织样本:收集2014年6月~2017年6月入住我院行手术切除的胶质瘤患者,患者未曾行放化疗、靶向治疗等影响肿瘤的治疗,且未合并其他肿瘤或影响生命的全身性疾病,具有完整的病例资料,共收集40例经病理证实为胶质瘤的标本。其中男25例、女15例, 年龄16~75岁, 中位年龄50岁;按2007年WHO中枢神经系统胶质瘤分类标准进行分级,Ⅰ~Ⅱ级为低级别组,共22例,Ⅲ~Ⅳ级为高级别组,共18例;星型细胞胶质瘤34例,间变型星形细胞胶质瘤6例。另选取因脑外伤行内减压术取得的正常脑组织20例份作为对照。男14例、女6例,中位年龄48岁。本研究由我院伦理委员会审核通过。
试剂与仪器:TRIzol、反转录和qRT-PCR试剂盒等均购自北京天根生化科技有限公司;胶质瘤细胞系U87和星形细胞瘤细胞系H4均购自美国ATCC细胞库;DMEM高糖、胎牛血清FBS表皮生长因子(EGF)、碱性成纤维细胞生长因子(bFGF)和B-27均购自美国Gibco公司;miR-520f-3p inhibitor和miR-520f-3p mimics均由上海捷瑞生物有限公司设计合成;RIPA裂解液、BCA检测蛋白浓度试剂盒均购自美国Solarbio公司;MTS购自美国Biovision公司;Transwell小室购自美国Corning公司;兔抗人OCT4多克隆抗体、鼠抗人Nanog多克隆抗体、兔抗人SOX2多克隆抗体、鼠抗人GAPDH多克隆抗体均购自美国Proteintech公司。
1.2 胶质瘤组织、正常脑组织和胶质瘤CSCs中miR-520f-3p的表达检测 采用qRT-PCR 法。采用TRIzol裂解研磨破碎的组织及细胞,氯仿试剂提取的方法获得总RNA,并将其逆转录为cDNA,以cDNA为模板按照SYBR Premix ExTaq试剂盒说明书进行qRT-PCR。 引物序列:miR-520f-3p正向引物:5′-ACACTCCAGCTGGGCCTCTAAAGGGAAGCG-3′,反向引物:5′-CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGAGAAAGCG-3′。LDOC1正向引物:5′-GCTCCCCGAGTTTATCGTGC-3′,反向引物:5′-TTCATGGCGTCGTTGCAGAA-3′。内参GAPDH正向引物:5′-ACAACTTTGGTATCGTGGAAGG-3′,反向引物:5′-GCCATCACGCCACAGTTTC-3′,采用2-ΔΔCt(循环阈值,Ct)法分析计算胶质瘤组织、正常脑组织和胶质瘤 CSCs中miR-520f-3p的表达。
1.3 细胞培养及转染 胶质瘤细胞系U87培养基为DMEM高糖+10%FBS,培养条件为37 ℃、5%CO2。将U87细胞肿瘤球制成单个细胞后与小鼠抗人CD133抗体包被的磁珠孵育,分选出CD133+的CSCs和CD133-的细胞,在含20 ng/mL EGF和bFGF、20 μL/mL 的B-27无血清培养基中继续培养。流式细胞仪检测CD133阳性细胞率。CSCs细胞对数生长期时胰酶消化后铺至6孔板中,分为NC组和miR-520f-3p inhibitor组,按说明书将脂质体2000与NC和miR-520f-3p inhibitor转染试剂转染至CSCs中,放至培养箱中培养。
1.4 细胞中OCT4、Nanog和SOX2蛋白表达检测 采用Western blotting法。收集细胞,加入含有蛋白酶和磷酸酶抑制剂的RIPA裂解液,冰上充分裂解10 min,13 000 r/min、4 ℃离心30 min,上清液为蛋白液,BCA检测蛋白浓度,加入Loading buffer变性后,SDS-PAGE电泳分离蛋白,湿转方法将蛋白转至PVDF膜上,5% 脱脂牛奶室温封闭3 h,TBST洗5 min后加入一抗孵育4 ℃过夜,TBST洗3次5 min后,二抗室温孵育2 h,ELC化学发光法曝光条带。
1.5 细胞增殖能力检测 采用MTS增殖实验。胰酶消化转染24 h后的CSCs细胞计数,以每组(NC组和miR-520f-3p inhibitor组)每孔2 000个细胞接种于96孔板中,每组含6个复孔,轻放至细胞培养箱中培养,细胞完全贴壁后第、1、2、3和4天时每孔向150 μL培养基中加入30 μL MTS工作液,培养箱中孵育2 h,酶标仪于波长490 nm处测取光密度(OD)值。
1.6 细胞转移能力检测 采用Transwell小室实验。胰酶消化转染48 h后的CSCs细胞计数,无血清培养基洗3次,以每组每孔1×106个/mL细胞、0.1 mL无血清培养基接种于Transwell小室微孔膜上室面, 下室加入0.5 mL完全培养基作为趋化因子,置于培养箱中培养,下室穿过10个细胞时,将聚碳酸酯微孔膜上室面细胞PBS洗掉,微孔膜在甲醇中固定15 min,苏木素染色。随机计数显微镜下5个视野聚碳酸酯微孔膜下室面的细胞数,取其均值。
1.7 miR-520f-3p靶基因的验证 采用TargetScan7.1软件(http://www.targetscan.org/)预测miR-520f-3p的靶基因。CSCs细胞对数生长期时胰酶消化后铺至96孔板中,分为LDOC1-wt(野生型)与miR-520f-3p mimics共转染组(LDOC1-wt+miR-520f-3p);LDOC1-wt与NC共转染组(LDOC1-wt+NC);LDOC1-mut(突变型)与miR-520f-3p mimics共转染组(LDOC1-mut+miR-520f-3p);LDOC1-mut与NC共转染组(LDOC1-mut+NC),采用脂质体2000进行各组细胞的转染,收集转染48 h的细胞,根据双荧光素酶报告基因检测试剂盒说明书检测各组荧光素酶活性。
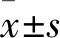
2 结果
2.1 胶质瘤和脑组织中miR-520f-3p表达比较 miR-520f-3p在胶质瘤和正常脑组织中的相对表达量分别为1.23±0.44、0.88±0.30,二者比较,P=0.002。
2.2 胶质瘤组织中miR-520f-3p表达与患者临床病理特征间的关系 miR-520f-3p在胶质瘤组织中的表达与肿瘤直径和WHO分级有关(P均<0.05),而与患者性别、年龄、肿瘤完整切除、组织学类型无关(P均>0.05),见表1。

表1 miR-520f-3p在胶质瘤组织中的表达与患者临床病理特征间的关系
2.3 胶质瘤CSCs的分选与鉴定 利用抗体包被的磁珠从U87细胞培养的肿瘤球分选出CD133+的细胞,无血清培养基中扩大培养后流式细胞仪检测CD133+率为93.08%,Western blotting检测OCT4、Nanog和SOX2干性标志蛋白在CD133+细胞中的相对表达量分别为0.36±0.07、0.82±0.09、0.80±0.07,在CD133-细胞中的相对表达量分别为0.18±0.03、0.26±0.05、0.25±0.06,二者比较,P均<0.05。
2.4 miR-520f-3p在胶质瘤CSCs中的表达 qRT-PCR结果显示,miR-520f-3p在CSCs(CD133+)中的表达(6.15±0.69)高于在U87(CD133-)中的表达(1.00±0.05)(P<0.05);miR-520f-3p inhibitor转染CSCs,qRT-PCR检测显示miR-520f-3p inhibitor组、NC组中miR-520f-3p的相对表达量分别为0.27±0.07、 1.00±0.10,两组比较,P<0.05。
2.5 干扰miR-520f-3p表达对CSCs细胞增殖的影响 与NC组相比,miR-520f-3p inhibitor组细胞增殖能力减慢(P<0.05),见表2。
2.6 干扰miR-520f-3p表达对CSCs细胞转移能力的影响 miR-520f-3p inhibitor组和NC组细胞穿膜数分别为(32.58±8.36)、(80.67±10.90)个,两组比较,P<0.05。
2.7 miR-520f-3p对癌症亮氨酸拉链下调因子1(LDOC1)的靶向调控作用 TargetScan7.1软件在线预测显示LDOC1启动子区有miR-520f-3p的结合位点。进一步双荧光素酶报告基因试验结果显示,与LDOC1-wt+NC共转染组(1±0.05)相比,LDOC1-wt+miR-520f-3p共转染组的荧光素酶活性(0.31±0.05)降低(P<0.05);而LDOC1-mut+NC(1.00±0.04)和LDOC1-mut+miR-520f-3p(0.92±0.06)组间的荧光素酶活性无统计学差异(P>0.05)。qRT-PCR结果显示,与NC转染组(1.00±0.10)比较,miR-520f-3p inhibitor组CSCs中LDOC1 mRNA表达(5.79±0.73)增加(P<0.05)。

表2 两组不同时点细胞的OD值比较
3 讨论
胶质瘤是成人常见的中枢神经系统肿瘤,恶性程度较高[1]。胶质瘤具有快速生长、浸润性增长、高复发及抗辐射和化疗耐药等恶性特征,使得胶质瘤患者的预后较差[2],同时有研究发现,胶质瘤对常规化学疗法的耐药可激活致癌信号传导通路,使其恶性程度更高[11]。近年来,有证据表明胶质瘤在功能上是异质的,即胶质瘤中存在一部分具有一系列干细胞特征的肿瘤细胞,包括干细胞标志物优先表达、自我更新能力增强和多谱系分化潜能,并且其在胶质瘤治疗后能够快速启动肿瘤生长或重新填充肿瘤组织,这些肿瘤细胞为胶质瘤CSCs,且越来越多的研究表明,胶质瘤的恶性特征与胶质瘤CSCs密切相关[7]。同时,随着CSCs的培养和分离方法的成熟,使得CSCs成为广大学者的研究热点。在白血病、结肠癌等其他肿瘤中已经报道CSCs可以作为化学药物的靶点抑制肿瘤的生长[12,13]。
研究表明,miRNAs通过表观遗传调控机制在胶质瘤的发生发展中发挥关键作用[4]。miRNAs是一类小分子非编码单链RNA,长度为19~25个核苷酸,为高度保守的内源性RNA,广泛表达于各类组织中,miRNAs的异常表达可致多种人类疾病的发生,包括恶性肿瘤[5,6],miRNAs可作为促癌因子和抑癌因子,在肿瘤中表达异常后均可促进肿瘤的恶性生物学行为。同时研究表明,表观遗传修饰调节为CSCs重要的调控机制,而miRNAs调控CSCs的报道逐渐增多,miRNAs在调控CSCs的增殖、侵袭和转移中发挥重要作用[8],miRNAs在胶质瘤CSCs的恶性生物学功能中有重要调控作用。miR-520f-3p是新近发现和鉴定的miRNAs,目前对其研究报道较少,其异常表达会引起疾病的发生。Reed等[14]报道,miR-520f-3p在前驱亨廷顿病患者中表达升高,可作为诊断亨廷顿病的miRNAs生物标志物。Meshkat等[15]在乳腺癌中发现,miR-520f-3p的单核苷酸多态性 rs75598818 GA可降低乳腺癌发病和晚期乳腺癌的风险,rs75598818多态性影响mir-520f茎环的稳定性,miR-520f-3p可能是潜在的肿瘤抑制因子。而miR-520f-3p在胶质瘤组织中的表达及发挥的生物学功能尚不清楚。
本研究结果显示,miR-520f-3p在胶质瘤组织中的表达高于正常脑组织中,且胶质瘤组织中miR-520f-3p表达与肿瘤直径和WHO分级有关,表明miR-520f-3p在胶质瘤组织中的表达上调可能促进肿瘤增殖和转移。Xiao等[10]研究发现,AR / miR-520f-3p / SOX9信号轴通过增加CSCs参与改变肝细胞癌细胞在缺氧条件下对索拉非尼治疗的敏感性,提示miR-520f-3p与CSCs相关,因此我们设想在胶质瘤中表达增加的miR-520f-3p可能参与CSCs的干性调控。由于CSCs在肿瘤细胞中只是一小部分,需要经过分离扩大培养后进行研究,目前CSCs的分离方法主要是无血清悬浮培养方法和基于CSCs表面免疫学分子分选方法。无血清悬浮培养方法是利用CSCs具有较强的自我更新能力,而能在添加EGF、bFGF和B-27等生长因子的无血清培养基中生长增殖成肿瘤球,而普通的肿瘤细胞则发生凋亡[16]。同时CSCs表面特异表达一些免疫学分子,利用抗体抗原结合的原理将CSCs从肿瘤细胞中分离出,胶质瘤CSCs表面的免疫学分子标志物主要为CD133[17],本研究则采用上述两种方法筛选出93.08%的CD133+肿瘤细胞,Western blotting检测与CD133-瘤细胞相比,CD133+的肿瘤细胞中干性标志蛋白OCT4、Nanog和SOX2的表达显著升高,证实CD133+的肿瘤细胞为CSCs。而qRT-PCR检测结果发现,miR-520f-3p在CSCs中的表达高于U87细胞中,与其在胶质瘤组织中的表达具有一致性。进一步采用inhibitor抑制CSCs中miR-520f-3p的表达后,MTS增殖实验和Transwell实验结果显示,抑制miR-520f-3p表达后CSCs增殖和转移能力均下降,CSCs的生物学特性受抑。
此外,miRNAs通过结合靶基因mRNA的3′端非翻译区,在基因转录后水平以表观遗传修饰的方式调控靶基因的表达[7]。因此我们寻找miR-520f-3p的靶基因以进一步研究miR-520f-3p调控胶质瘤CSCs干性的作用机制,但每个miRNA的靶基因可存在数十个到数百个,而TargetScan7.1软件可在线预测miRNAs的靶基因,我们预测发现,LDOC1的启动子区有miR-520f-3p的结合位点,可能是miR-520f-3p的靶基因。LDOC1基因位于Xq27,为X连锁肿瘤抑制因子,编码146个氨基酸的蛋白质,其在N-末端结构域具有典型的亮氨酸-拉链基序,并且富含与SH3结合结构域相似的脯氨酸区域性,LDOC1通过这两个结构域与各种细胞蛋白相互发挥功能。LDOC1普遍表达于各种组织中,但在宫颈癌、卵巢癌、甲状腺癌等多种肿瘤中表达下调或沉默,并通过抑制肿瘤细胞增殖和转移以及诱导细胞凋亡而起到肿瘤抑制剂的作用[18~20]。同时LDOC1是已知的NF-κB转录抑制因子[21],荧光素酶报告基因实验结果显示LDOC1是miR-520f-3p直接调控的靶基因,而抑制CSCs中的miR-520f-3p表达后,qRT-PCR结果显示CSCs中LDOC1 mRNA表达增加,表明miR-520f-3p可能通过靶向负调控LDOC1抑制CSCs的生物学特性,具体机制仍需后续研究深入探讨。
综上所述,miR-520f-3p在胶质瘤组织和CSCs中均高表达,且高表达与肿瘤直径及WHO分级有关;miR-520f-3p可能通过负调控LDOC1增加CSCs的干性。

