KISS-1/GPR54在不同生长期大鼠睾丸中的表达分析
冯俊鹏 , 徐 瑞,2 , 唐玉玲 , 严 翊
(1.北京体育大学运动人体科学学院 , 北京 海淀 100084 ; 2.南京体育学院运动健康学院 , 江苏 南京 210014 ; 3.中国农业大学动物医学院 , 北京 海淀 100193)
KISS-1/GPR54被认为是青春期启动的“开关”,其中KISS-1调节生殖轴并作为青春期开始的分子开关[1]。随着动物进入青春期,生殖激素开始发挥作用。下丘脑促性腺激素释放激素(Gonadotropin-releasing hormone,GnRH)可刺激垂体前叶分泌的促性腺激素(Gonadotropins,Gn)、黄体生成激素(Luteinizing hormone,LH)和卵泡刺激激素(Follicle-stimulating hormone,FSH)增加。促性腺激素通过血液循环系统刺激、调节性腺的发育和功能。近几年来,KISS-1已被鉴定为下丘脑-垂体-性腺轴的上调基因,KISS-1在哺乳动物繁殖中的作用得到了广泛的研究。KISS-1主要由下丘脑神经元分泌,并通过刺激GnRH神经元上的同源受体GPR54起作用,然后激活调节青春期开始和生殖功能的下游基因。多年来关于KISS-1/GPR54研究的主要热点都在HPG轴上游的定位和功能,目前已经明确KISS-1/GPR54在多种组织中表达,特别是在胰腺和性腺中表达水平较高。
相关研究已经在人类[2]、小鼠[3]、大鼠[4]和青蛙的睾丸中检测到GPR54的表达,进一步增加了KISS-1也可以在睾丸发育中起作用的可能性。同时,KISS-1已被发现能在小鼠睾丸间质细胞内表达[5]。对于在人类精子中检测出的KISS-1和GPR54,主要的部位局限于精子的头部、颈部和鞭毛的中段[2]。然而,不同的研究对于KISS-1/GPR54在睾丸中的表达定位暂无一致结论,故暂无法推测KISS-1/GPR54在睾丸发育中的功能。由于在生长期过程中,大鼠睾丸结构和功能迅速成熟,故动态研究生长期过程中大鼠睾丸中KISS-1/GPR54表达的变化情况对于进一步探究KISS-1/GPR54在睾丸发育中的生理功能具有重要意义。
1 材料与方法
1.1 实验动物 SPF级3周龄(第21天)离乳大鼠,共60只,购自北京维通利华实验动物技术有限公司(许可证编号:SCXK京2012-0001)。经北京体育大学动物福利伦理委员会批准(批准号:2016021A),动物分笼饲养,室温20~24 ℃,相对湿度40%~60%,每日12 h光照/12 h熄灯,大鼠自由饮水、饮食。饲料采用高脂对照饲料,购自美国Research Diets公司(货号:D12451B)。
1.2 取样 根据前期试验结果和相关文献,确定第21天、第35天、第43天、第56天为4个取材时间点。大鼠称重后,2%戊巴比妥钠腹腔注射麻醉,剂量为0.025 mL/(kg·bw)。待麻醉后,腹主动脉取血,分别取两侧睾丸,剥离睾周脂肪及附睾后称重,并将一侧睾丸置于4%多聚甲醛中固定待用;另一侧睾丸于冰上剪碎,迅速用编好号的锡箔纸分包成2份,置于液氮中,后转移至-80 ℃超低温冰箱中待用。
1.3 主要试剂 KISS-1抗体(免疫组化用KISS-1 抗体,MABC60,Millipore产品);GPR54抗体(免疫组化用GPR54 抗体,GTX37417,GeneTex产品);KISS-1抗体(WB用KISS-1抗体,ab19028,Abcam产品);GPR54抗体(WB用GPR54抗体,bs-2501R,Bioss产品);二抗(Goat Anti-Rabbit IgG H&L,ab6721,Abcam产品);内参(GAPDH 抗体,ab8245,Abcam产品)。
1.4 免疫组化确定KISS-1/GPR54定位 制备睾丸组织石蜡切片后,石蜡切片经二甲苯脱蜡,梯度酒精脱水,下行至蒸馏水,进行抗原修复,羊血清工作液封闭后,滴加已稀释好的一抗(KISS-1抗体稀释比1∶500,GPR54抗体稀释比1∶100),4 ℃过夜,然后采用通用型二步法反应,滴加DAB显色液,室温避光作用2~10 min,经0.1 mol/L pH 7.4 的PBS蓝化作用15 min,经梯度酒精脱水,二甲苯透明后,中性树胶封片,镜下观察拍照(Olympus BX43)。
1.5 实时荧光定量PCR (Quantitative real-time PCR,RT-qPCR)测定KISS-1/GPR54基因表达 通过Primer-BLAST检索出相应基因的引物序列,引物由生工生物工程(上海)股份有限公司合成。按说明书步骤提取总RNA、合成cDNA,进行RT-qPCR试验。
1.6 Western Blot测定KISS-1/GPR54蛋白表达 按说明书步骤进行总蛋白提取和Western Blot样品制备。将样品置于15孔预制胶中,连接电泳仪,将电压调至140 V,时间为130 min,待Marker条带分层至10 kDa分子量标记显现时停止电泳。转膜后一抗封闭,在4 ℃下摇床过夜;第2天,二抗封闭,在4 ℃下摇床封闭1 h。TBST清洗后,进行曝光,曝光液分A、B液,按1∶1比例现用现配,准备高敏、超敏2种发光液,分别进行曝光,结果以图片形式进行保存。用成像系统(ChemiDocTM XRS+System,Bio-Rad)读取条带灰度值,以GAPDH作为内参,使用Image Lab进行相对定量分析。
1.7 统计方法 采用SPSS 20.0软件进行统计分析,数据采用平均值±标准差(Mean±SD)表示。所有数据在进行分析前经正态性检验和方差齐性检验,符合标准后,采用重复测量方差分析对结果进行统计分析,取P<0.05 为具有统计学意义显著差异,P<0.01为具有统计学意义极显著差异。
2 结果
2.1 生长期大鼠体重、睾重、睾丸指数变化情况 在第21天、第35天、第43天、第56天4个时间点进行动态取材,各时间点大鼠体重、睾重、睾丸指数变化见表1。如表1所示,大鼠体重、睾重、睾丸指数在第21天至第35天阶段均出现明显增加(P<0.01),其中体重、睾重均随鼠龄增加而增加(P<0.05)。对于体重,大鼠的体重发育具有一定的阶段性,本试验结果可以发现,雄性大鼠在第21天至第35天处于第1个生长高峰,第35天至第43天大鼠体重增加速度放缓,第21天至第35天体重增长速度最快。大鼠的睾丸重量及睾丸指数可以体现大鼠的睾丸发育水平,本试验结果可以发现,随着鼠龄的增加,大鼠的睾丸重量不断增加,第21天至第35天是大鼠睾丸重量增长最快的阶段,后逐渐放缓。大鼠睾重的变化趋势与体重基本一致。而大鼠的睾丸指数并不一直增加,在经过第21天至第35天的明显增加后基本稳定。

表1 生长期大鼠体重、睾重、睾丸指数变化情况Table 1 Changes of body weight,testis weight and testis index of growth period rats
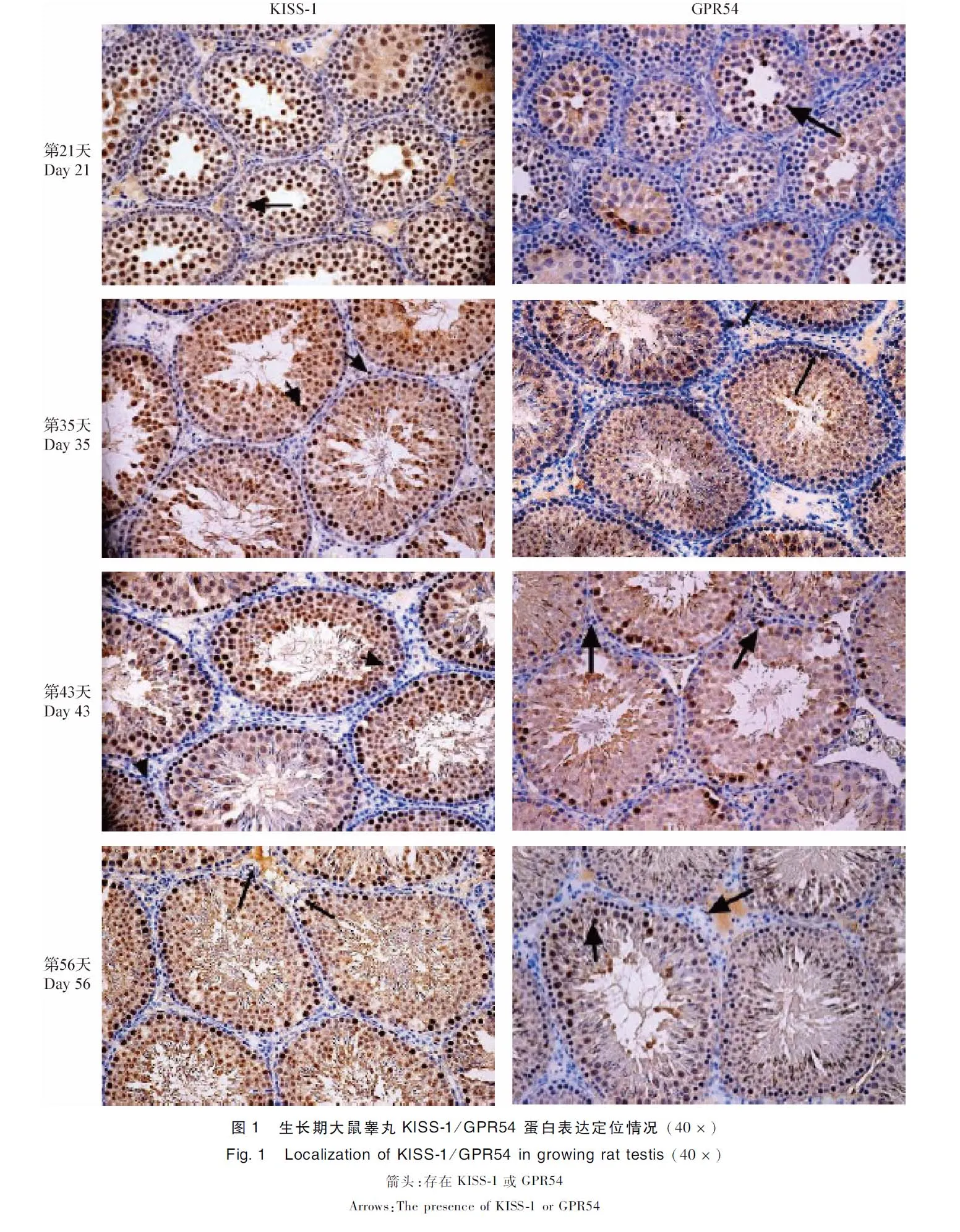
2.2 生长期大鼠睾丸KISS-1/GPR54蛋白表达定位情况 KISS-1/GPR54在生长期各阶段大鼠睾丸的生精细胞和间质细胞均见表达,见中插彩版图1。
2.3 生长期大鼠睾丸KISS-1/GPR54 mRNA表达情况 生长期各取样点大鼠睾丸KISS-1/GPR54 mRNA表达情况如表2所示。对于KISS-1 mRNA表达情况,可以看出在第35天处明显升高出现表达峰值(P<0.01),随后虽略有下降但第43天和第56天较第35天均无显著性差异(P>0.05)。对于GPR54 mRNA表达情况,可以看出第21天至第35天 表达情况几乎没有变化,第35天至第43天表达上升(P<0.01)并在第43天出现峰值,随后虽然在第43天至第56天出现下降,但第56天较第43天表达量无显著性差异(P>0.05)。

表2 生长期大鼠睾丸KISS-1/GPR 54 mRNA表达情况Table 2 KISS-1/GPR 54 mRNA expression in the testis of growth period rats
2.4 生长期大鼠睾丸KISS-1/GPR54 蛋白表达情况 生长期各取样点大鼠睾丸KISS-1/GPR54 蛋白表达情况如表3所示。随着鼠龄的增加,大鼠睾丸中KISS-1蛋白表达逐渐增高且各时间点较前一时间点均有显著性差异(P<0.05),特别是在第21天至第35天和第43天至第56天2个阶段出现非常显著性差异(P<0.01)。随着鼠龄的增加,大鼠睾丸GPR54表达也逐渐增加,第21天至第35天阶段无明显变化,第35天至第43天阶段蛋白表达极明显升高(P<0.01),第43天至第56天阶段基本不变。

表3 生长期大鼠睾丸KISS-1/GPR54 蛋白表达情况Table 3 KISS-1/GPR54 protein expression in the testis of growth period rats
3 讨论
3.1 生长期大鼠睾丸KISS-1/GPR54 蛋白表达定位 对于不同种动物的睾丸中KISS-1/GPR54表达的定位问题研究结果不一,在对五指山猪[6]和黄牛[7]的研究中发现,在睾丸间质细胞、各阶段的生精细胞中均发现KISS-1的表达,也有研究发现雄性大鼠睾丸的生精细胞中有KISS-1的表达,但在间质细胞中无表达。相关研究结果不一致影响进一步探究KISS-1/GPR54在睾丸中的生理功能。本试验通过对于生长期大鼠睾丸进行动态取点研究发现,从第21天开始KISS-1/GPR54在大鼠的间质细胞和生精细胞中均见表达,且随着青春期发育,在生精细胞的表达量增加。
许孟杰[8]对ICR小鼠的KISS-1/GPR54的蛋白表达定位进行了研究,发现针对ICR小鼠KISS-1仅分布于间质细胞,GPR54在精子细胞中特异性表达,而不是精原细胞、精母细胞或支持细胞。鉴于睪丸存在的“血睾屏障”结构,睾丸间质细胞所分泌的KISS-1无法与精子细胞中表达的GPR54结合产生作用,推测睾丸间质细胞所分泌的KISS-1另有功能。Anjum等[9]从出生到衰老各阶段小鼠睾丸中KISS-1的表达定位进行研究,发现在出生时在精原细胞中发现KISS-1,随着生长发育精原细胞中KISS-1免疫染色后颜色加深,睾丸间质细胞中颜色变浅,到青春期期间睾丸间质细胞中颜色变深,进入衰老期KISS-1主要集中在睾丸间质细胞表达。其他对于小鼠的研究也发现不同鼠龄特别是处于生殖周期的不同阶段,KISS-1/GPR54表达定位结果不同。据此可以推断,KISS-1/GPR54可能参与大鼠精子成熟和性激素分泌,但在生殖周期的不同阶段KISS-1/GPR54在大鼠睾丸中的生理功能可能有所不同。
3.2 生长期大鼠睾丸KISS-1/GPR54 mRNA和蛋白的表达情况 本试验采用动态取点的方法,取离乳期(第21天)、青春期前期(第35天)、青春期(第43天)、青春期后期(第56天)4个时间点进行研究发现,KISS-1/GPR54 mRNA在大鼠睾丸中均有表达,且呈现一定的时序性变化趋势。就KISS-1 mRNA表达情况来看,从第21天至第35天这个时间段,大鼠睾丸中KISS-1 mRNA表达明显增高,在第35天出现峰值,随后略有降低但无显著性差异。就GPR54 mRNA表达情况而言,第21天至第35天这个时间段GPR54表达基本稳定,第35天至第43天时间段出现显著性增加,第43天至第56天表达出现下降但无显著性差异。对比可以发现,GPR54表达峰值的出现晚于KISS-1表达峰值。可能由于KISS-1对于能量变化更为敏感有关,且GPR54为KISS-1的受体,当KISS-1表达增高并积累到一定程度时GPR54表达才出现增高。KISS-1/GPR54 蛋白在大鼠睾丸中均有表达,与mRNA的表达结果一致,但也表现出一定的时序性特点。就KISS-1蛋白表达情况来看,随着鼠龄的增加,KISS-1蛋白表达逐渐增加,在第43天至第56天表达增加更加明显,在第56天出现峰值。就GPR54蛋白表达情况来看,第21天至第35天GPR54蛋白表达基本保持不变,在第35天至第43天出现明显的增加,第43天至第56天基本保持不变,在第56天出现峰值。综上,KISS-1/GPR54在睾丸中表达蛋白峰值出现的时间点晚于mRNA峰值出现的时间点,且KISS-1峰值出现早于GPR54峰值的出现。
许孟杰[8]用细胞分离的方法研究发现,KISS-1 mRNA主要表达于睾丸间质细胞,GPR54 mRNA主要表达于生精小管细胞,而非睾丸间质细胞。曾泰祥[10]发现,对于12周龄的ICR小鼠KISS-1与GPR54都高度表达于睪丸的睾丸间质细胞中,由此推测,KISS-1可能分泌自睾丸间质细胞并作用于睾丸间质细胞本身而形成自分泌(Autocrine)路径。此外,同样的试验对于4周龄未进入青春期的ICR小鼠,发现未进入青春期的ICR小鼠睾丸间质细胞的KISS-1和GPR54表达量显著低于青春期后的小鼠。根据上述试验结果,虽然KISS-1可能通过自分泌途径直接作用于睾丸,但是KISS-1/GPR54系统在生殖功能调节中的确切生理作用仍有待阐明。
4 小结
本试验表明,KISS-1/GPR54在生长期大鼠睾丸生精细胞和间质细胞均表达。大鼠睾丸中KISS-1/GPR54表达呈现一定的时序性,mRNA和蛋白表达趋势基本一致,第21天至第56天整体上均呈现一定的表达上升的趋势。据此推测在生殖周期的不同阶段,大鼠睾丸中KISS-1/GPR54的生理功能可能有所不同。

