山东牛轮状病毒的分离鉴定及其卵黄抗体应用试验
秦晓冰 , 周建梅 , 张洪亮 , 单 虎
(青岛农业大学 山东省预防兽医学重点实验室 , 山东 青岛 266109)
牛轮状病毒(Bovine rotavirus,BRV)属于呼肠孤病毒科轮状病毒属,是以引起犊牛精神沉郁、食欲减退和水样腹泻为主要特征的一种严重危害养牛业的传染病,常伴有继发感染而引起犊牛死亡[1-2]。BRV普遍存在于污染的饲料、器具、饮水及患病牛的排泄物中,消化道为主要的传播途径,多发于30日龄内的犊牛,成年牛往往呈隐性感染而持续排毒。犊牛感染BRV尚无特效疗法,通常采取隔离和对症治疗,常因犊牛心衰和代谢性酸中毒而导致死亡,死亡率高达50%以上[3]。
BRV为双链RNA病毒,包含6种结构蛋白VP1~VP4、VP6、VP7和6种非结构蛋白NSP1~NSP6,根据VP4和VP7外壳蛋白基因型的差别BRV可以分为G型和P型,目前已经发现有12个G型和11个P型[4]。VP4、VP6、VP7这3种结构蛋白有良好的免疫原性,成为疫苗的研究热点,但不同基因型之间的交叉保护性差,使得BRV疫苗研究非常困难[5-6]。卵黄抗体作为一种特异性免疫球蛋白,已经在家禽和家畜的多种病毒病的防治中取得了显著的效果,但有关BRV的紧急预防与治疗的报道还非常鲜见[7]。
本试验利用山东省犊牛腹泻病料分离鉴定了BRV,制作了油乳剂灭活苗,并用该灭活苗多次免疫蛋鸡,利用纯化的卵黄抗体对犊牛进行了攻毒保护试验,旨在为犊牛BRV提供安全良好的保护,为有效预防和治疗犊牛BRV提供了一种新思路。
1 材料与方法
1.1 样本与细胞系 2018年7月在山东省莱西市某牧场采集犊牛腹泻样品6份,BRV参考毒株、MA-104(恒河猴胎肾传代细胞系)和兔抗牛源牛轮状病毒VP6重组蛋白的阳性血清,由山东省预防兽医学重点实验室提供。
1.2 主要试剂与仪器 DMEM培养基、胎牛血清,均购自生工生物工程(上海)股份有限公司;琼脂糖、50×TAE、核酸提取试剂盒,均购自宝生物工程(大连)有限公司;DL-2 000 DNA Marker、HiScriptII One Step RT-PCR Kit(Dye Plus),均购自Vazyme公司;0.25% DETA-胰酶,购自Gibco公司。Biofuge primor高速台式离心机(德国Heraeus公司);台式高速冷冻离心机(H-2050-R1型,湖南长沙湘怡检测设备有限公司);超低温冰箱(MDF382E型,SANYO公司);PCR扩增仪(Perkin Elmeter Gen Amp PCR System 9600);电子天平(德国Sartorius BS-210S);琼脂糖水平电泳槽(DYCD-31D,北京六一仪器有限公司);电泳仪(Powerpac basic型,BIO-RAD);光凝胶成像系统(AT126D型,台湾)。
1.3 病毒分离培养 用pH 7.0的PBS把病料稀释成0.2 g/mL的悬液,振荡2 min,5 000 r/min离心10 min,取上清。上清液除菌后加入终浓度为20 μg/mL 的胰酶,37 ℃激活30 min,接种1 mL于铺满单层MA104细胞的细胞培养瓶,37 ℃培养1 h,每瓶加入7 mL终浓度1 μg/mL胰酶细胞维持液,5%的CO2培养箱37 ℃培养,逐天观察,培养96 h后收毒。按上述方法继续传8代后,细胞出现稳定病变80%以上时收毒,-20 ℃冻存备用。
1.4 病毒纯化与毒价测定 将BRV病毒液加入到蜀牛瓶,加入NaCl和聚乙二醇PEG 6 000, 使其终浓度分别为2.5%和10%,4 ℃搅拌过夜,离心收集沉淀,加入缓冲液和氯仿后,离心收集上清液,4 ℃保存备用。
将激活的病毒液混合物用DMEM营养液10倍梯度稀释,从10-1到10-8稀释液依次吸取100 μL接种到长满单层MA104细胞的96孔细胞板上,设6个重复与正常细胞对照。37 ℃、5%的 CO2恒温培养箱中孵育1 h,加入100 μL的无血清终浓度1 μg/mL胰酶细胞维持液。连续观察5 d,计录细胞病变的孔数,按照Reed-Muench法计算病毒的半数组织培养感染剂量TCID50。
1.5 病毒鉴定。
1.5.1 RT-PCR 鉴定 根据GenBank登录的轮状病毒标准株NCDV和代表株IND株的高保守区VP6基因,设计上游引物:5′-GTCGAAGGCACATTATACTCC-3′;下游引物:5′-GATTGTGGTGCAATTCCATTT-3′。引物由上海派森诺生物科技有限公司合成,目的片段长度为284 bp。按TaKaRa 核酸提取试剂盒说明书进行病毒RNA提取,以RNA样品为反转录模板,依照HiScriptII One Step RT-PCR Kit(Dye Plus)说明书进行VP6基因的RT-PCR扩增。反应体系(50 μL):基因组RNA 2 μL,引物(20 μmol/L) 各2 μL,One Step Enzyme Mix 2.5 μL,2×One Step Mix 25 μL,RNase free ddH2O 16.5 μL。反应程序:50 ℃ 30 min;94 ℃ 3 min;94 ℃ 30 s,52 ℃ 30 s,72 ℃ 1 min,40个循环;72 ℃延伸5 min。用1%琼脂糖凝胶电泳,鉴定后回收。
1.5.2 病毒的电镜观察 将20 μL的病毒液滴在铜网上,静置20 min,吸去多余毒液,加5 μL的磷钨酸染色液染色4 min,用滤纸吸干,置透射电镜下观察。
1.6 BRV卵黄抗体的制备与效价检测 BRV病毒液中加入甲醛调终浓度为0.2%,混匀,37 ℃灭活48 h,将灭活液用1.3方法盲传3代,检查细胞有无病变。将灭活液与弗氏不完全佐剂按1∶2混合并充分乳化,2 mL/只三点肌内注射140日龄鸡,免疫后21 d和42 d各加强免疫1次,同时设立注射生理盐水对照组。收集首免后7~70 d的鸡蛋,采用水稀释硫酸铵盐析法提纯卵黄抗体,采用琼脂扩散法(AGP)测定收集的卵黄抗体IgY效价[8-9]。
1.7 BRV卵黄抗体保护试验 将血清和粪便BRV抗体均为阴性的初生牛犊分为试验组(A)和对照组(B),每组5头。试验组犊牛出生后6 h,饲喂卵黄抗体膏1次(20 g/头),24 h后重复饲喂,3日龄始每日上、下午各喂食1次卵黄抗体粉(10 g/头),饲喂至18日龄,对照组不使用抗体。犊牛4日龄检测粪便BRV为阴性后隔离饲养,2组全部经口接种BRV,剂量为2 mL/头(TCID50=10-5.62/mL)。4~7日龄,上下午各饲喂代用乳2L/头,8日龄后上下午各加喂250 g犊牛颗粒料,自由饮水。分别于犊牛1、4、5、8、11、14日龄和18日龄采用RT-PCR检测粪便BRV;用ELASA试剂盒检测犊牛血清IgG,并用酶标仪读取吸光值(OD值),计算抗体对BRV的抑制率,抑制率/%=[(阴性对照OD值-样本OD值)/阴性对照OD值]×100%。
2 结果
2.1 病毒的分离、纯化及毒价测定 病料接种MA104细胞后,盲传至第4代开始出现细胞病变(CPU),第8代CPU稳定。在接毒48 h后出现细胞固缩、变圆,72 h后细胞多数死亡,细胞液变黄,出现明显CPU,阴性对照细胞无病变,见中插彩版图1。经蚀斑纯化,病毒滴度为10-5.62TCID50/mL。

2.2 病毒鉴定
2.2.1 RT-PCR鉴定 纯化的病毒培养物经过RT-PCR扩增出284 bp的特异性条带,见图2,与预期目标条带一致。经BLAST比对,与GenBank中BRV的VP6基因序列相似性为99%,从分子水平证实该分离毒株为BRV,命名为SD-LX株。

图2 分离BRV毒株的RT-PCR鉴定Fig.2 Isolated BRV RT-PCR identification1:阴性对照; 2:阳性对照; 3:分离毒株培养物; M:DL-2 000 DNA marker1:Negative control; 2:Positive control; 3:Isolated BRV cultures; M:DL-2 000 DNA marker
2.2.2 SD-LX株电镜观察 将SD-LX株培养物电镜下观察,可见直径60~70 nm的病毒粒子,呈典型的车轮状形态(图3)。
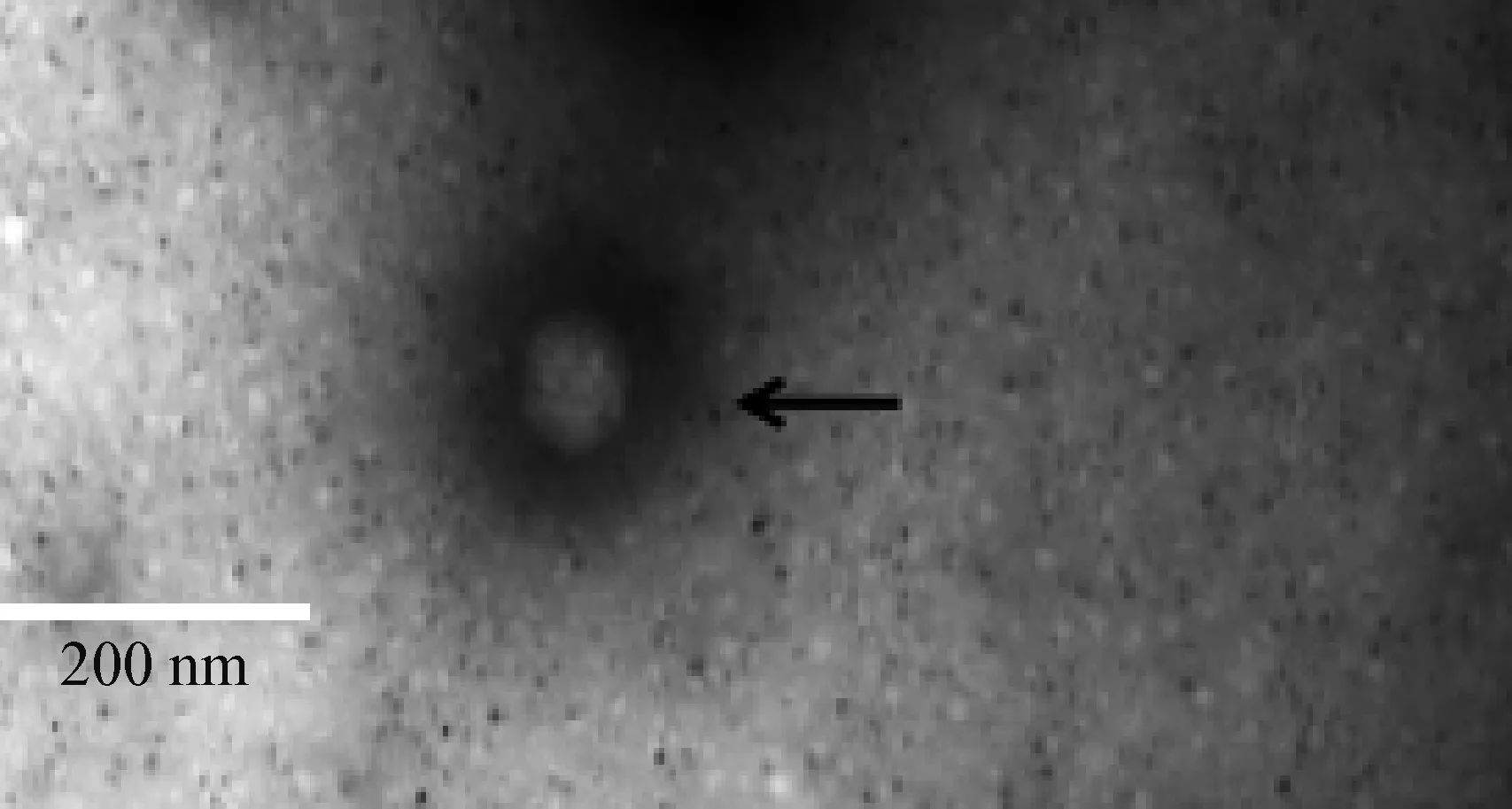
图3 SD-LX株培养物透射电镜观察Fig.3 SD-LX viral cultures observed through transmission electron microscope
2.3 SD-LX株卵黄抗体的制备与效价 灭活的SD-LX株病毒液接种于MA104细胞和盲传3代未有CPU,对照组细胞出现典型CPU。BRV油苗注射产蛋母鸡免疫后,卵黄抗体消长规律见图4。由图4可知,油苗首免后2~3周IgY效价约在1.8 log2,二免后达到4.8 log2,三免后第2周可测得IgY抗体效价达到峰值6 log2,之后处于约5.5 log2。
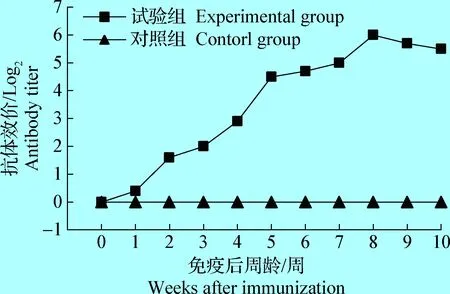
图4 免疫SD-LX株油苗后卵黄抗体制剂抗体效价消长规律Fig.4 IgY titers after immunized oil vaccine of SD-LX strain
2.4 卵黄抗体对犊牛保护试验 攻毒后12~24 h,对照组犊牛均出现体温升高,试验组有2头正常,3头升高。试验期内对照组犊牛体重降低,并出现不同程度的腹泻;试验组体重2头升高,3头降低,降低的犊牛出现轻微腹泻。犊牛粪便BRV检测见表1。由表1可知,卵黄抗体对A2、A3起到了良好的保护作用,治愈率为40%。

表1 攻毒前后犊牛粪便BRV检测Table 1 BRV in calf stools tested before or after challenges
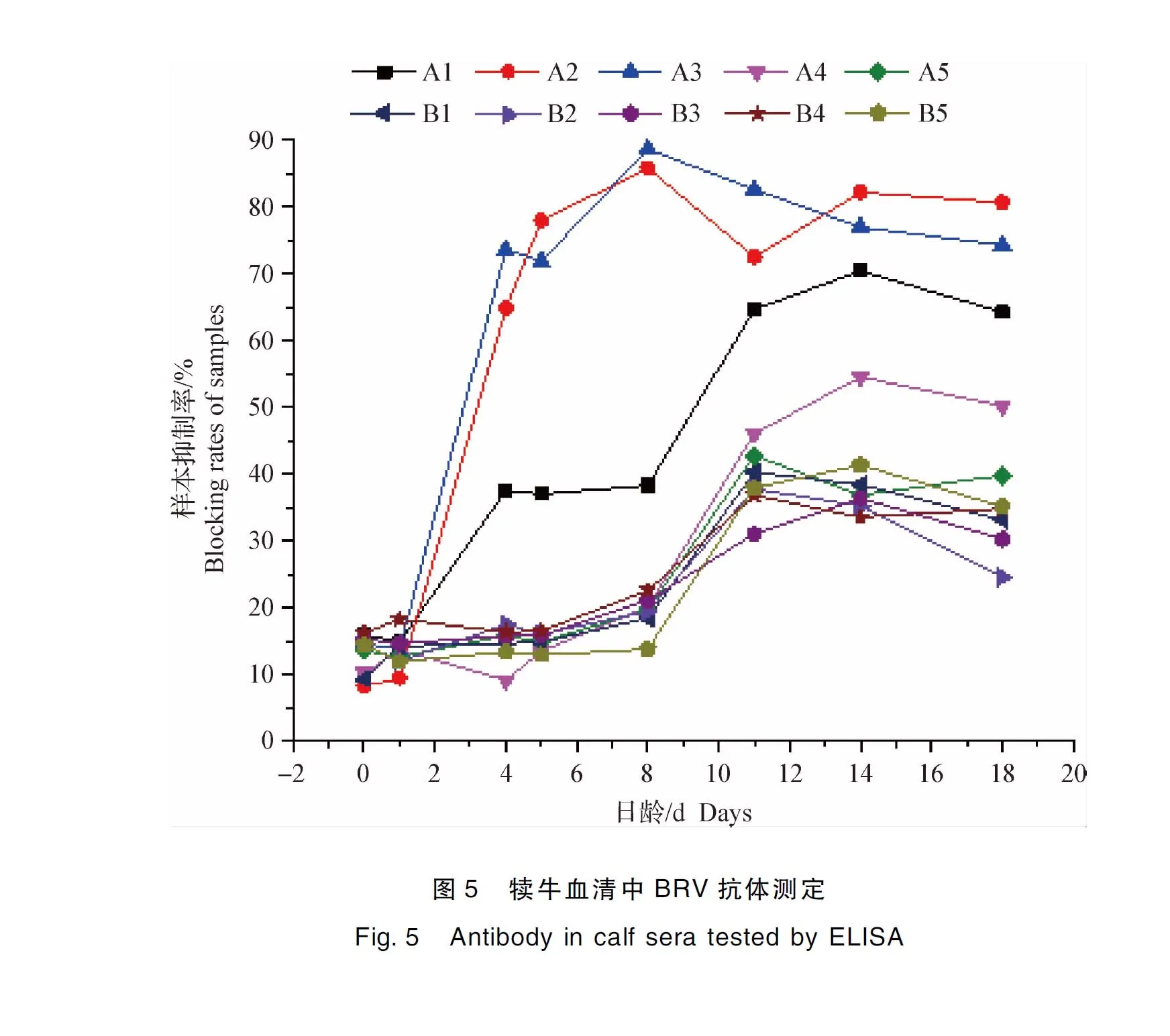
根据ELISA抗体检测试剂盒对分离的犊牛血清进行BRV的IgG检查结果与酶标仪读取的OD值(阴性对照:2.742 4;阳性对照:0.069 9),计算阳性抑制率,结果见中插彩版图5。由图5可知,A2与A3抗体水平较其他个体高,A1、A4、A5的抗体水平低于A2、A3,但总体高于对照组。经Duncan氏法分析,18日龄犊牛A1、A2、A3、A4抗体水平极显著高于对照组(P<0.01),A5显著高于对照组(P<0.05),说明卵黄抗体有效率为100%,但因犊牛的个体差异治疗效果不同。
3 讨论
倪亚炜1985年在北京地区检测了29份牛粪便,BRV的阳性率为55.2%[10]。李鑫等[11]在2005—2006年间对我国山东省、山西省、北京市、内蒙古等12个省市自治区的不同年龄、不同品种的1 760份 牛血清进行了BRV感染调查,发现总体阳性率达到了99%。张坤等[12]2014—2015年在新疆部分地区奶牛场,采集犊牛腹泻粪便91份,BRV阳性率为23.08%~90.91%。王牧川等[13]2015年对重庆市的8个肉牛场81份腹泻粪便样品进行BRV检测,阳性率为66.7%。表明BRV在我国分布广,危害性持久,是引起犊牛腹泻的主要原因之一,制约了养牛业的持续发展。
本试验采用MA104细胞分离BRV,优选浓度为20 μg/mL的胰蛋白酶处理病毒接种物以及无血清的终浓度为1 μg/mL胰蛋白酶的维持液,与魏锁成等[14]探讨的BRV细胞培养方法和葛雨[15]分离BRV的胰蛋白酶浓度均有所不同。表明BRV的分离培养与分离株的特性、病料新鲜度及阳性病料中病毒的含量等有着密切的关系。本试验检测BRV的PCR靶基因是编码VP6蛋白的基因节段,该片段是A群RV的特异性抗原,在BRV不同血清型之间具有高度的保守性,是检测BRV的首选靶基因[16]。这与周芳等[5]和陆亚东等[17]采用RT-PCR鉴定BRV的方法是一致的。
1973年美国农业部批准BRV的G6型减毒疫苗,是目前世界上唯一商品化的BRV疫苗,我国BRV疫苗防控尚处于研发阶段。常继涛等[18]依据我国地区BRV流行株G6和G10,制作减毒疫苗免疫产前奶牛,犊牛通过哺乳获得母源抗体从而获得保护,为疫苗的研制奠定了基础。卵黄抗体(IgY)是禽类血清中的免疫球蛋白(IgG)转移到卵黄中形成的特异性多克隆抗体,因质优价廉、性质稳定等优点,近年来广泛应用于动物疫病防控领域[19]。本试验采用水稀释法,结合盐析与透析来提纯BRV的IgY,对出生4日龄的犊牛进行了攻毒后口服保护试验,有效率与对照组相比达到了100%,治愈率为40%。这与Vega等[20]研究报道的口服BRV的IgY对犊牛可提供80%的保护,且能减少BRV导致犊牛死亡率研究结果相符。本试验人工感染犊牛BRV,犊牛口服卵黄抗体获得了有效的保护,表明IgY可以用于犊牛BRV的预防与治疗。

