SOX4介导的EMT在肺癌中的作用及其机制
余 坤,李鸿生,张琳玲,杜亚茜,李 权,王晓雄,蔡静静,马露瑶,周永春
肺癌作为当下“头号杀手”,是全球病死率最高、发展最快的肺原发性恶性肿瘤。2019年初,新的癌症统计名单公布,肺癌依旧独占鳌头[1-2],其中,女性肺癌例数呈逐年递增态势,防控形势严峻[3]。有研究[4]显示,带有转移灶的晚期肺癌患者,经治疗后的5年生存率不足10%,临床肿瘤患者90%以上死于肿瘤转移。转移是造成肺癌难以根治的最根本原因。国内外众多研究发现多种因子发挥转录与非转录作用参与肿瘤的生物学行为,其中,性别决定基因-相关蛋白结构域4[sex determining region Y-related(SRY)-type high mobility group (HMG)-box4,SOX4]基因位于Y染色体的6p22.3[5]可通过活化Wnt、TGF-β、Hedgehog及Notch等通路或经miRNA的调节,参与多癌种的增殖、迁移与侵袭。但到目前为止,对SOX4在肺癌发生发展中的作用机制尚未明确。因此,该研究通过细胞培养及分子实验探讨SOX4与上皮细胞-间充质细胞转化(epithelial to mesenchymal transition, EMT)间的相互关系及其机制,为精准医疗、临床监测、预后评估及科研工作提供理论指导,同时,为各类型肺癌的个体化诊疗提供新的生物学标志物和潜在的干预靶点奠定基础。
1 材料与方法
1.1 细胞株人正常上皮细胞(BEAS-2B);肺腺癌细胞(95D、A549、H1299、H23、H292、HCC827、SPCA-1、XWLC-05);肺鳞癌细胞(H226、SK-MES-1)、大细胞肺癌细胞(H460)由教育部高原区域性高发肿瘤国际合作联合实验室、云南省肺癌研究重点实验室提供;正常支气管上皮细胞16HBE、小细胞肺癌细胞H446、肺腺癌细胞H157由中国科学院昆明动物研究所陈勇斌课题组馈赠。
1.2 主要试剂质粒由上海吉玛公司构建;DMEM、RPMI 1640、FBS、Opti-MEM、0.25% Trypsin-EDTA (1X)购自美国Gibco公司;Lipofectamine 2000、TRIzol试剂购自美国Invitrogen公司;cOmpleteTMProtease Inhibitor Cocktail、PCR反应试剂盒购自美国Roche公司;BD Matrigel Basement Membrane Matrix购自美国B.D公司;6.5 mm Transwell® with 8.0 μm Pore Polycarbonate购自美国Corning公司;RABBIT anti-SOX4 polyclonal antibody购自美国Millipore公司;Anti-SNAIL antibody(Goat)、Anti-Vimentin antibody (Mouse)、Anti-N-Cadherin antibody (Rabbit)和Anti-E-Cadherin antibody (Mouse)购自美国Abcam公司;Anti-Mouse IgG(HRP-Linked)Antibody和Anti-rabbit IgG, HRP-linked Antibody购自美国CST公司;Rabbit Anti-Goat IgG(H+L)HRP购自美国Affinity公司。
1.3 主要仪器二氧化碳培养箱(型号:3311)、生物安全柜(型号:HYCD-282)购于美国Thermo Scientific公司;荧光定量PCR仪(型号:7500)购于美国Life Technologies公司;倒置荧光显微镜(型号:DMI4000B)购于德国LEICA公司;核酸蛋白定量仪(型号:NanoDrop2000)、酶标仪(型号:1510)购于美国Thermo公司。
1.4 实验方法
1.4.1细胞培养 BEAS-2B、SK-MES-1培养于DMEM高糖培养基(含10% FBS、1% PS),余细胞培养于1640完全培养基(含10% FBS、1% PS),放置37 ℃、5% CO2细胞培养箱中,细胞贴壁生长至80%左右,用血球计数板与细胞计数仪MoxiZ_Firmware计数,以每孔1.2×105个细胞进行6孔板铺板。参照Lipofectamine 2000转染试剂盒中提供的操作说明进行转染。设置Blank为空白对照组、GFP为质粒对照组、NC为shRNA对照组;pEX-2-SOX4为过表达实验组,siRNA803为沉默实验组。
1.4.2实时荧光定量聚合酶链式反应(quantitative real time polymerase chain reaction, qRT-PCR)检测目的基因表达情况 按TRIzol法提取RNA试剂盒说明书,提取各组对数生长期的细胞RNA。按照RNA反转录合成试剂盒将RNA 反转录为cDNA。本研究所用PCR引物由云南擎硕科技有限公司合成,引物序列见表1。以cDNA为模板,RPS18为内参,采用两步法行PCR检测:第1步预变性95 ℃、5 min;第2步变性95 ℃、5 s,退火延伸60 ℃、30 s;40个循环。以2-ΔΔCt表示mRNA相对表达水平。

表1 实时定量PCR目的基因的引物
1.4.3蛋白质免疫印迹(Western blot, WB)检测 成功转染目的质粒48 h后,在冰上用配好的裂解液进行总蛋白提取。BCA法进行标准曲线的绘制及蛋白浓度测定,以40 μg对应体积上样,经SDS-PAGE凝胶电泳后,将蛋白分子湿转到PVDF膜,用5%脱脂牛奶封闭120 min后加入一抗(SOX4稀释比例为1 ∶500;β-actin稀释比例为1 ∶1 000;E-钙黏附素(E-Cadherin,E-Cad)稀释比例为1 ∶500;N-钙黏蛋白(N-cadherin, N-Cad)稀释比例为1 ∶500;波形蛋白(vimentin, Vim)稀释比例为1 ∶500;Snail稀释比例为1 ∶500)。4 ℃摇床12 h,用TBST在摇床上漂洗3次,每次15 min后加入二抗(稀释比例均为1 ∶2 000)摇床12 h,用TBST在摇床上漂洗3次,每次15 min,用ECL通过GeneSys曝光成像,用Image J对目标条带进行灰度值分析。
1.4.4CCK8测定细胞增殖及细胞活性 转染目的质粒24 h后,收集细胞,计数,调整细胞悬液浓度至5×103/ml,接种细胞于96孔板,200 μl/孔,每组设置3个复孔。完成后将孔板置于培养箱中培养相应时长。吸弃待测孔的培养液后,每孔加入10 μl CCK8溶液+200 μl对应完全培养液混合液,继续在温箱中培养4 h。用酶标仪测定在450 nm处各孔的吸光度(OD值)。每隔24 h对下一板重复以上操作,以此类推。
1.4.5细胞划痕迁移实验 选取铺满6孔板状态较佳的目的细胞,用1 ml枪头比着消毒过的无菌直尺画九格宫,线条之间相距0.5 cm,PBS洗细胞2次,去除划下的细胞,加入无血清培养基。放入培养箱继续培养。每隔24 h观察细胞迁移情况。
1.4.6Transwell细胞迁移与侵袭试验 将冰上融化且配制好的1 mg/ml Matrigel 100 μl加入小室上层并凝固成胶状。选取生长态势较佳的目的细胞,按比例稀释至5×104个/ml,加200 μl到上室,而下室加800 μl 30% FBS的全培养基继续培养。48 h后丢弃小室废液, PBS冲洗及甲醇固定后,用结晶紫(0.1%)染色30 min,在清水下用棉棒头小心拭去表面多余细胞,在40倍及100倍镜下以交叉处为标记选8个视野拍照。最后再用33%醋酸1 ml浸泡每个孔2 h,洗脱结晶紫后,取200 μl至96孔板测OD值。迁移实验除了铺胶步骤缺省,余步骤一致。
1.4.7平板细胞克隆形成试验 取生长态势较佳的细胞重悬后以300个细胞的梯度密度分别接种6孔板培养至细胞克隆成型大于50个/克隆集落,4%多聚甲醛固定20 min左右,用结晶紫(0.1%)染色30 min。在100倍及200倍镜下拍照。最后再用33%醋酸1 ml浸泡每个孔2 h,洗脱结晶紫后,取200 μl至96孔板测OD值。
1.5 统计学处理通过ImageJ、GraphPad Prism 8进行图像处理、数据整理与统计分析,所有数据经正态性及方差齐性检验,对正态分布和方差齐完全随机设计的两组样本的数据用两样本t检验,就完全配对或配伍设计的样本用配对t检验,多组样本比较用One-way ANOVA方差分析,对于具有非正态性或方差不齐的数据,使用秩和检验进行统计分析。以P<0.05表示差异有统计学意义。
2 结果
2.1 细胞培养及转染对15株细胞进行培养,筛选出SOX4基因最有可能发挥作用的细胞株,即基础表达量较高的各类型细胞株进行目的基因转染(图1A~C),转染效率均大于60%,且通过细胞形态及分子实验证实成功过表达与沉默目的基因(图2A~C)。
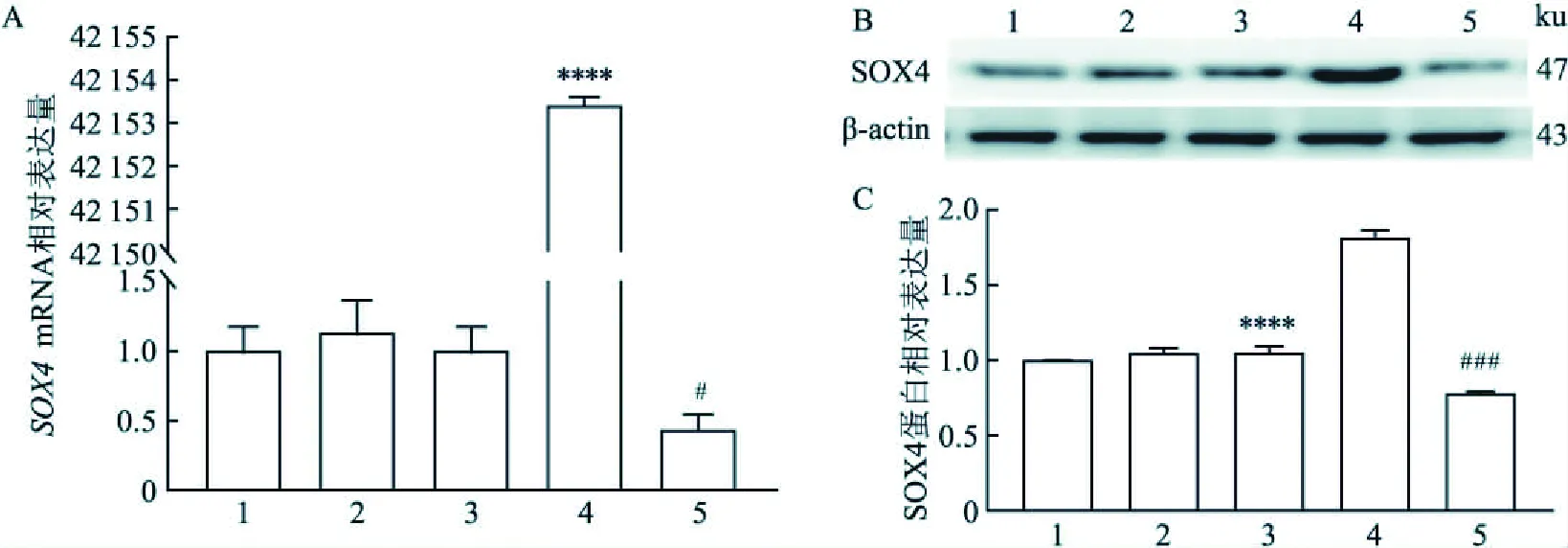
图2 目的基因转染后表达情况统计图A、B、C:转染目的质粒48 h,验证过表达与沉默SOX4对SOX4基因转录与翻译的影响统计图;与GFP组比较:****P<0.000 1;与NC组比较:#P<0.05,###P<0.001;1:Blank组;2:GFP组;3:NC组;4:pEX-2-SOX4组;5:siRNA803组
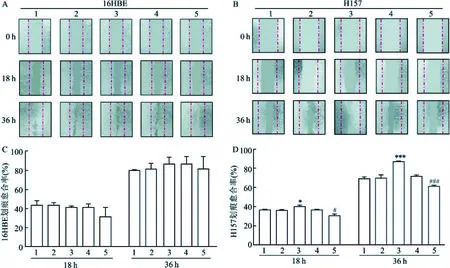
图3 细胞划痕愈合实验结果图与统计图A、B:16HBE及H157细胞转染目的质粒后,划痕实验镜下图×40;C:16HBE细胞划痕实验结果统计图;D:H157细胞划痕实验结果统计图;与GFP组比较:*P<0.05,***P<0.001;与NC组比较:#P<0.05,###P<0.001;1:Blank组;2:GFP组;3:NC组;4:pEX-2-SOX4组;5:siRNA803组
2.2SOX4对肺癌细胞生物学功能的影响16HBE、H157细胞转染目的质粒后,经细胞划痕实验观察细胞生长状况,H157细胞pEX-2-SOX4组的细胞愈合率最高,差异有统计学意义(P<0.05,n=3),而16HBE细胞实验组愈合率与对照组差异无统计学意义(图3A~D),且Transwell迁移与侵袭实验48 h后,可见对照组细胞迁移与侵袭数量少于pEX-2-SOX4组,差异有统计学意义(P<0.05,n=3)(图4A~F);CCK8细胞实验测得48 h后随着时间的推移(图5),pEX-2-SOX4组细胞增殖速率较对照组逐渐增高,差异有统计学意义(P<0.05,n=6);细胞克隆实验证实pEX-2-SOX4组细胞克隆形成率较对照组高,差异有统计学意义(P<0.05,n=3)(图6A~E)。
2.3SOX4介导的EMT相关因子的机制探究通过分子实验在转录水平验证SOX4对肺癌细胞EMT表型促进基因及诱导因子的表达影响(图7);利用统计软件对转染目的质粒的各类型细胞株EMT相关因子及多通路主要因子进行PCR数据整理与统计分析证实SOX4通过介导Wnt为代表的信号通路促进EMT(图8A~C)。
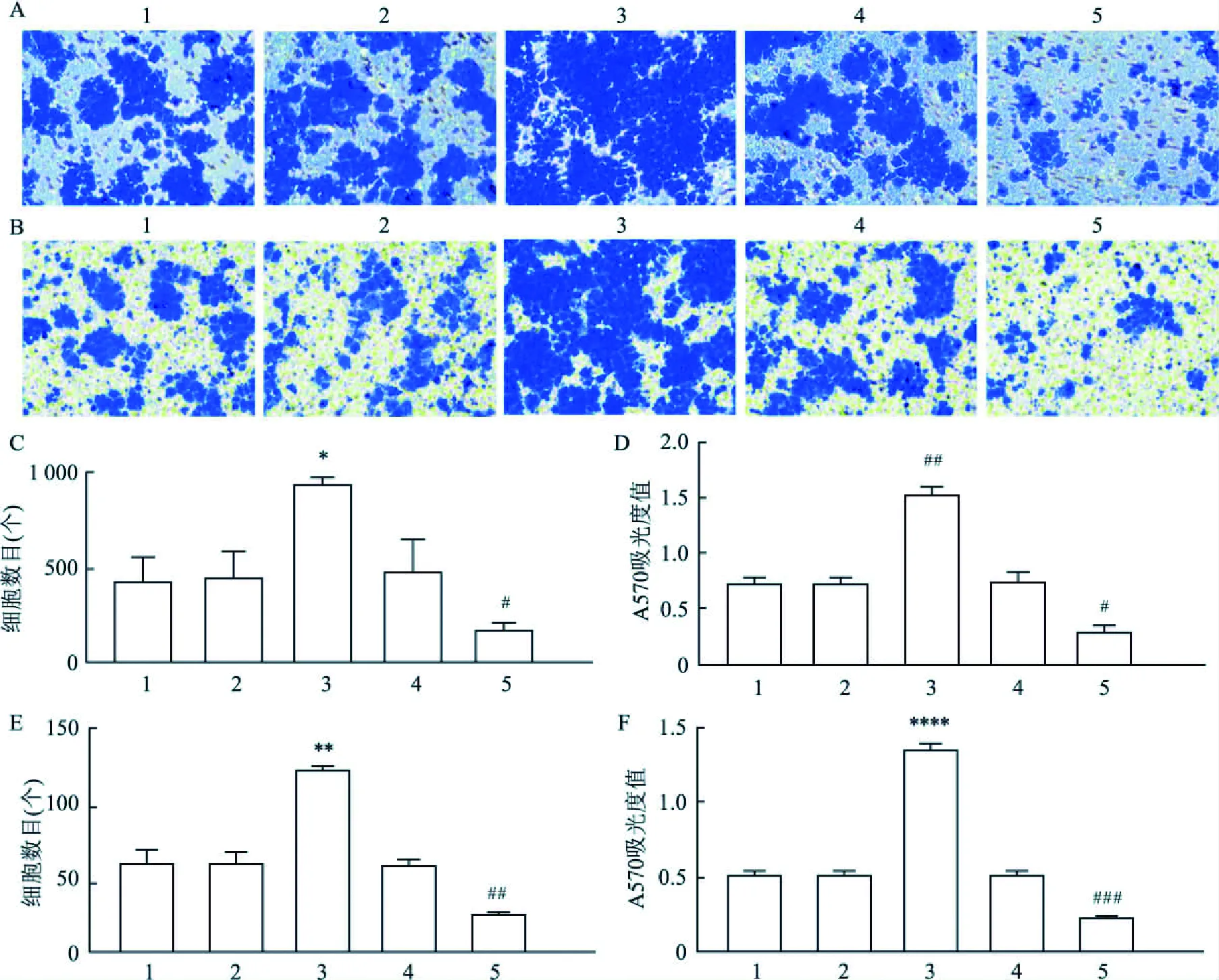
图4 Transwell细胞迁移及侵袭实验结果图与统计图A、B:Transwell细胞迁移及寝室实验结果图 ×100;C:细胞迁移实验成功迁移细胞数;D:细胞侵袭实验中结晶紫A570吸光值;E:细胞侵袭实验成功侵袭细胞数;F:细胞侵袭实验中结晶紫A570吸光值;与GFP组比较:*P<0.05,**P<0.01,****P<0.000 1;与NC组比较:#P<0.05,##P<0.01,###P<0.001;1:Blank组;2:GFP组;3:NC组;4:pEX-2-SOX4组;5:siRNA803组
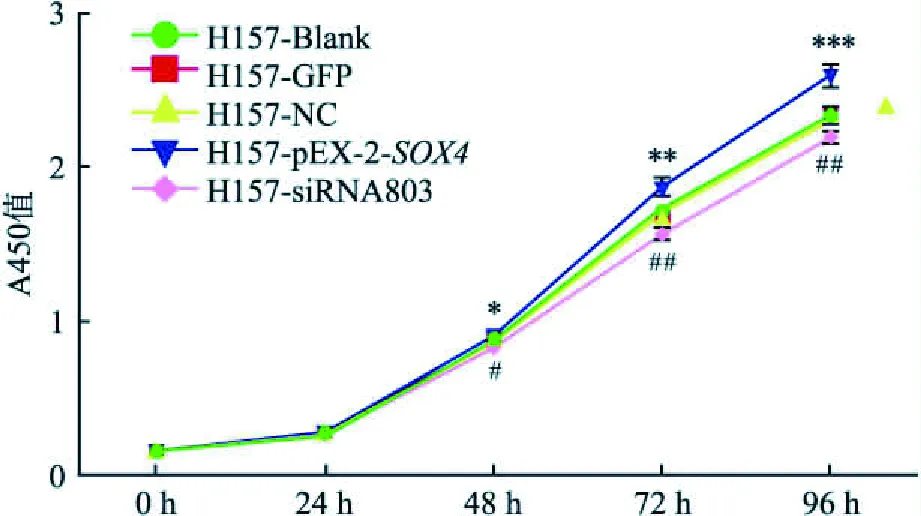
图5 CCK-8细胞增殖实验结果统计图与GFP组比较:*P<0.05,**P<0.01,***P<0.001;与NC组比较:#P<0.05,##P<0.01
3 讨论
SOX4参与胚胎发育与细胞命运的调控,可通过TGF-β、Wnt通路调节细胞分化、增殖和转移,并通过相关因子促发EMT,是人类肿瘤中普遍存在的具有标志性意义的64个基因之一[6]。本实验成功培养了15株肺正常上皮及肺癌细胞,以SOX4基础表达量为依据,筛选出SOX4表达量最高、作用最为显著的H157肺癌细胞进行细胞功能实验。同时,筛选SOX4表达最高的五种类型细胞各一株进行后续机制探究。
通过过表达SOX4,细胞首先从形态上发生了转变,由圆形、椭圆形逐步演化成长梭形,由聚集性生长,发展为趋向疏松性生长,镜下多见散在的细胞,由此猜想细胞间的链接变得不再那么紧密。CCK8及平板克隆检测过表达SOX4后细胞的增殖能力也显著增强;侵袭实验分析SOX4过表达后细胞侵袭能力也得到了一定的加强。划痕与Transwell迁移实验发现,过表达SOX4后,细胞的迁移能力呈现不同的增高,过表达SOX4能够增强肺癌细胞的增殖、迁移与侵袭的能力,但正常细胞的迁移能力并不受SOX4表达的影响。本课题组在前期实验中发现,SOX4在肿瘤细胞中的表达较正常肺组织显著增高[7],在体外实验中也发现SOX4的沉默,抑制了肿瘤的生物学行为[8]。本部分实验亦证实SOX4可通过介导上皮标志物E-Cad的缺失及间质标志物N-Cad、纤维连接蛋白(Fibronectin, FN)及Vim和EMT相关转录因子(Snail、Twist及β-catenin)的上调,以促进EMT的发生。在探究其具体机制中发现,SOX4在不同类型的肺癌中可通过多条信号通路发挥EMT的调控作用,进而促使肿瘤增殖、转移与侵袭,具体如下:① 以16HBE为代表的正常肺细胞主要通过Smad7、TJP-1、TJP-2和WIF1来增强Wnt及TGF-β负反馈通路拮抗SOX4介导的EMT进程[9-10]。② 以H446为代表的小细胞肺癌细胞主要通过SOX4促进ADAM28加强ECM的降解[11]及直接或间接增加β-catenin的表达而加强并稳定Wnt/β-catenin信号级联[12],与TGF-β通路协同参与上皮表型缺失,间质表型上调而介导EMT的发生[13]。③ 以H157为代表的肺腺癌细胞机制最为复杂,SOX4促使多种EMT促进因子上调,其中,以Twist抑制E-Cad的作用最为显著[14],其次,包括Notch和TGF-β等在内的多条信号通路都加强了Wnt/β-catenin级联,促进EMT的进展[15]。④ 以SK-MES-1为代表的肺鳞癌细胞主要通过SOX4介导ADAM28等因子促使ECM的降解,TGF-β、Wnt/β-catenin信号通路也有作用,但并不显著,推测SOX4的增高负反馈引起WIF1、Smad7增多,进而拮抗了以上通路的作用,SOX4对肺鳞癌EMT作用并不显著。⑤ 以H460为代表的大细胞肺癌细胞主要通过SOX4介导Twist、Snail、Wnt2、TGF-β的上调,增强Wnt及TGF-β等多条信号通路促进EMT的进展。
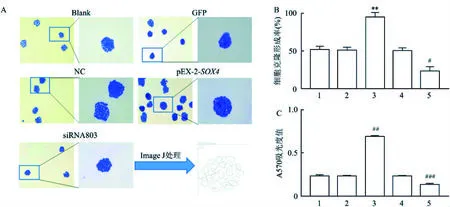
图6 细胞生物学功能实验结果图与统计图A:细胞克隆形成实验结果图 ×100/200;B:细胞克隆形成率;C:结晶紫A570吸光值;1:Blank组;2:GFP组;3:NC组;4:pEX-2-SOX4组;5:siRNA803组;与GFP组比较:*P<0.05,**P<0.01;与NC组比较:#P<0.05,##P<0.01,###P<0.001
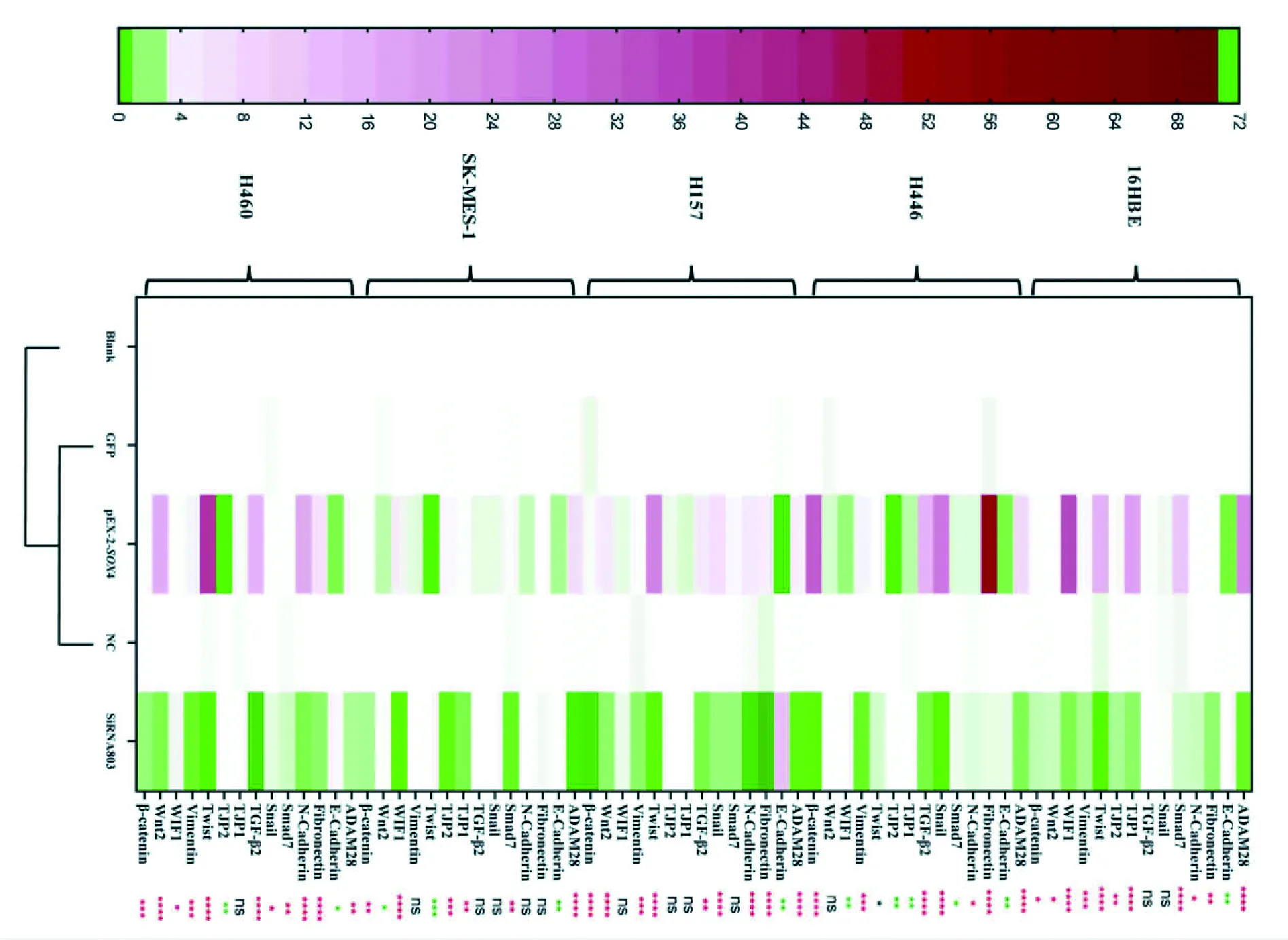
图7 EMT相关通路主要因子表达热图A:SOX4过表达和敲除后16HBE、H446、H157、SK-MES-1及H460细胞中EMT相关通路主要因子的表达热图;与GFP组比较,正向增加:nsP>0.05,*P<0.05,**P<0.01,***P<0.001,****P<0.000 1;与GFP组比较,反向减少:nsP>0.05,*P<0.05,**P<0.01,***P<0.001
综上,SOX4可通过影响EMT相关因子的表达促进肺癌细胞的增殖、迁移与侵袭,Wnt及TGF-β为其主要信号通路。SOX4有望成为小细胞肺癌、肺腺癌及大细胞肺癌EMT的主要标志物与诊疗的潜在靶点。
——一道江苏高考题的奥秘解读和拓展

