氧化低密度脂蛋白对大鼠血管内皮依赖的舒张功能的损伤及其机制
陈 硕,杜 鹃
动脉粥样硬化可诱发冠状动脉粥样硬化性心脏病、心肌梗死等心血管疾病[1],其病理机制十分复杂,至今尚未完全明确。近年有研究表明氧化低密度脂蛋白(oxidized low density lipoprotein, OxLDL)在动脉粥样硬化的发生、发展中,尤其是其内皮损伤方面起着重要的作用[2]。有研究[2]报道OxLDL可引起多种血管内皮损伤,造成其功能破坏,甚至发生血管内皮细胞的凋亡。
血管内皮介导的舒张反应是血管的重要功能之一,参与器官血流供应的调节,对器官的功能,尤其在缺血性损伤时发挥重要的影响,直接关系到缺血性损伤疾病的发生、发展及其转归。但目前尚未见有文献报道OxLDL对血管内皮介导的舒张功能的影响。该研究拟观察OxLDL对大鼠冠状动脉和肠系膜动脉的内皮依赖性舒张功能的影响,并初步探讨其可能的机制。
1 材料与方法
1.1 实验材料
1.1.1药品与试剂 OxLDL购自中国广州奕元生物技术有限公司;乙酰胆碱(acetylcholine, ACh)、U46619、Fura-2Am及毒胡萝卜素(thapsigargin, TG)购自美国Sigma公司;胰蛋白酶、胎牛血清及1640培养基购自中国台湾BI公司;一氧化氮(nitric oxide, NO)和硫化氢(H2S)检测试剂盒购自南京建成生物研究所。
1.1.2实验动物及细胞株 SD大鼠,雄性,180 ~ 220 g;合格证号:SCXK(皖)2017-001,购自安徽医科大学实验动物中心,饲养温度在(22±2) ℃,通风良好,可自由摄水进食;人冠状动脉内皮细胞株(human coronary artery endothelial cells, HCAECs),购自上海晶都有限公司公司。
1.2 实验方法
1.2.1血管张力实验[3]采用10%水合氯醛300 mg/kg麻醉SD大鼠,迅速打开胸腔和腹腔,取出心脏和肠系膜动脉(mesenteric artery, MA),放入通入95% O2+5%CO2的冰浴PSS液中。将心脏的尖端和右心房固定于平皿中,去除心外膜,从主动脉根部和动脉圆锥间浅表处的冠状动脉(coronary artery, CA)主干暴露并分离CA。将分离的大鼠CA和MA制成约2 ~ 3 mm长的血管环。
将大鼠血管环置入盛有5 ml 95% O2+5% CO2饱和的生理盐溶液[physiological salt solution,PSS;成分(mmol/L):NaCl 119、KCl 4.7、NaHCO324、KH2PO41.18、MgSO41.17、EDTA 0.026、CaCl21.6、glucose 5.5,pH 7.4]的DMT四通道血管张力测定仪的浴槽中。将一直径20 μm钢丝的头端顺时针固定于张力传感器上。调节显微镜放大倍数至能清晰看见钢丝尾端为宜,用显微镊夹住血管环一端缓慢通过钢丝正中并固定。再将另一根钢丝缓慢穿过血管环的管腔中,并固定于右侧传感器上。浴槽温度维持在37 ℃,并持续通入95% O2+5% CO2混合气体。血管张力采用ML785 PowerLab/4sp记录和分析系统测定。
血管在零张力状态下平衡60 min后,调整血管初始张力为1 mN。再平衡30 min,用30 mmol/L KCl收缩血管后,用PSS洗脱KCl,连续两次。若前后两次收缩幅度差异小于10%,表示血管环收缩活性良好。加入PSS或100 mg/L OxLDL预处理30 min后,用100 nmol/L U46619收缩血管,待收缩稳定后,加入累积浓度的ACh, 观察血管的舒反应。
1.2.2细胞培养[4]将HCAEC细胞接种于含10%胎牛血清的1640培养基中,并置于37 ℃的5% CO2培养箱中培养。2 ~ 3 d换液1次,4 d左右传代。当细胞融合度达到80%~90%时,用胰蛋白酶消化收集细胞开始实验。
1.2.3NO[5]和H2S[6]将上述培养的HCAEC细胞移入96孔培养板中(1×106/ml, 100 μl/孔),置37 ℃的5% CO2培养箱中预培养稳定12 h后,在其中5个孔的细胞中加入终浓度为100 μg/ml的OxLDL为实验组,在另外5个孔的细胞中加入PSS为对照组。各组细胞继续在37 ℃的5% CO2培养箱中培养24 h后,移入EP管中,3 000 r/min离心10 min。分别按照NO和H2S检测试剂盒说明书提供的操作方法,在550 nm和670 nm 处测定离心的上清液中NO和H2S的吸光度(OD)。
1.2.4钙库操纵性钙内流(store-operated calcium entry, SOCE)的测定[7 - 8]将上述离心沉淀的HCAEC细胞重新悬浮后,加入终浓度为5 μmol/L的Fura-2Am在37 ℃培养箱中孵育30 min后接种于多聚赖氨酸包被的玻片上。玻片用无钙PSS溶液(mM:NaCl 140、MgCl21.0、KCl 5.0、EGTA 0.2、glucose 10、HEPES 4.0,pH 7.4)清洗2遍后,置含有500 μl无钙PSS的钙成像仪浴槽中,实时记录细胞内游离的Ca2+浓度([Ca2+]i)的荧光信号。实验中,首先记录静息[Ca2+]i的荧光信号,然后加入终浓度为2 μmol/L的TG,耗竭性促进钙池释放Ca2+,最后加入终浓度为1 mmol/L Ca2+引起钙池操纵性钙通道( store-operated calcium channel, SOCC)介导的Ca2+内流(即SOCE),连续记录20 min。[Ca2+]i由钙荧光信号强度来表示,钙池释放Ca2+量和SOCE分别由加入TG时最高荧光信号强度与静息荧光信号强度之差和加入1 mmol/L Ca2+时最高荧光信号强度与静息信号荧光强度之差来表示。
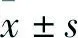
2 结果
2.1 OxLDL对大鼠血管内皮舒张功能的影响结果如图1所示,ACh在1×10-9~1×10-5mol/L范围内可显著地引起大鼠肠系膜动脉和冠状动脉的舒张(P<0.01)。与在大鼠肠系膜动脉上的作用一样,100 mg/L OxLDL预处理可明显减弱ACh诱导的冠状动脉舒张作用(P<0.01)。鉴于ACh诱导的血管舒张作用为内皮依赖性的,该结果提示OxLDL预处理可减弱大鼠冠状动脉的内皮舒张依赖的舒张功能。
2.2 OxLDL对HCAEC细胞中NO和H2S含量的影响结果如图2A所示,与对照组相比,当HCAEC细胞与100 μg/mL OxLDL孵育24 h时,培养上清液中NO含量没有明显的差异,提示OxLDL对HCAEC细胞中NO生成未见明显的影响;图2B表明 100 μg/ml OxLDL可显著地降低HCAEC细胞培养上清液中H2S浓度(P<0.01),提示OxLDL可抑制内皮细胞中H2S的生成。
图1 OxLDL对ACh诱导的大鼠血管内皮依赖性舒张功能的影响A:肠系膜动脉;B:冠状动脉;与PPS+PPS组比较:**P<0.01;与OxLDL+PPS组比较:##P<0.01;与PPS+ACh组比较:▽▽P<0.01

图2 OxLDL对HCAECs细胞培养上清液中NO和H2S含量的影响A:NO含量;B:H2S含量;与Control组比较:**P<0.01
2.3 OxLDL对HCAEC细胞SOCE的影响结果如图3A所示,100 μg/ml OxLDL孵育24 h虽可使HCAEC细胞中静息[Ca2+]i有增加的趋势,但与对照组比较无明显的差异;OxLDL可明显地减少TG诱导的钙库释放Ca2+(P<0.05),并进而抑制其诱导的SOCE (P<0.05),该结果表明OxLDL对TG诱导的钙库释放Ca2+和及其诱导的SOCE有明显的抑制作用。
3 讨论
众所周知ACh诱导的血管舒张反应为内皮依赖性。在去除内皮的血管上,ACh则丧失其血管舒张作用,甚至还会诱导轻微的血管收缩作用[9-10]。本研究观察到在1×10-9~1×10-5mol/L范围内,ACh可显著地舒张U46619预收缩的大鼠CA和MA,而100 mg/L OxLDL预处理可明显减弱ACh对大鼠CA和MA的舒张作用,表明OxLDL预处理对大鼠血管内皮介导的血管舒张功能有一定的损伤作用。
ACh诱导的内皮依赖性舒张反应是通过促进血管内皮合成和释放内皮衍生舒张因子而产生的。H2S作为一种新型的气体信号分子和内皮源性血管舒张因子受到了越来越多的关注。内皮源性H2S可由胱硫醚-γ-裂解酶催化半胱氨酸(l-cysteine)或3-巯基丙酮酸硫转移酶联合半胱氨酸氨基转移酶催化3-巯基丙酮酸生成的。血管内皮细胞通过这些酶促反应可产生足够量的H2S来舒张平滑肌细胞,降低血管的张力[11]。内皮源性H2S诱导的舒张作用与激活平滑肌细胞上的钙激活钾(KCa)通道有关[6, 12]。NO也是血管内皮生成的一种主要的舒张因子之一。为探讨OxLDL损伤血管内皮舒张功能的机制,本研究在体外培养了人冠状动脉内皮细胞(HCAECs细胞株),观察OxLDL对HCAEC细胞中NO和H2S生成的影响。结果表明OxLDL对HCAEC细胞中NO生成无明显影响,但可显著地降低H2S的生成,提示抑制H2S的生成可能是OxLDL损伤血管内皮舒张功能的机制之一。
当细胞中内质网等钙池中Ca2+减少到一定的程度,为补充钙池中Ca2+,可诱导钙库操纵的钙离子通道(store-operated calcium channel, SOCC)的激活,导致细胞外的Ca2+内流,即SOCE的发生。SOCE广泛存在于兴奋细胞和非兴奋细胞中,尤其在内皮细胞、上皮细胞等非兴奋细胞中是Ca2+内流产生的主要方式,可参与调节细胞的多种生物学功能。血管内皮祖细胞(endothelial progenitor cells, EPCs)可通过增殖和迁移对受损血管进行修复。有研究表明上调SOCE可增加[Ca2+]i,进而促进EPCs的增殖和迁移,对血管产生保护作用[13]。因此,SOCE可能是血管损伤的一个新的治疗靶点。
TRP4通道是内皮细胞中SOCC中不可缺少的组成部分。在TRP4-/-小鼠上,由于TRP4通道的敲除导致了SOCE的缺失,显著地减弱了ACh的血管内皮依赖性的舒张作用[14]。在豚鼠主动脉上,Ca2+载体A23187可通过一种未知的机制耗尽储存的Ca2+,激活SOCC,导致SOCE的发生,可产生内皮依赖性的血管舒张反应[15]。这些研究资料表明内皮细胞SOCE与血管内皮舒张功能密切相关,SOCE的缺失或减弱可损害血管内皮依赖性的舒张功能。本研究结果表明OxLDL可明显地减弱TG诱导HCAEC细胞钙库释放Ca2+,并进而抑制SOCE的发生,这与其减弱ACh诱导的大鼠血管内皮依赖性舒张反应是一致的,提示减弱内皮细胞SOCE可能也是OxLDL损伤血管内皮依赖性舒张功能的机制之一,至于详细机制有待于今后的进一步研究。
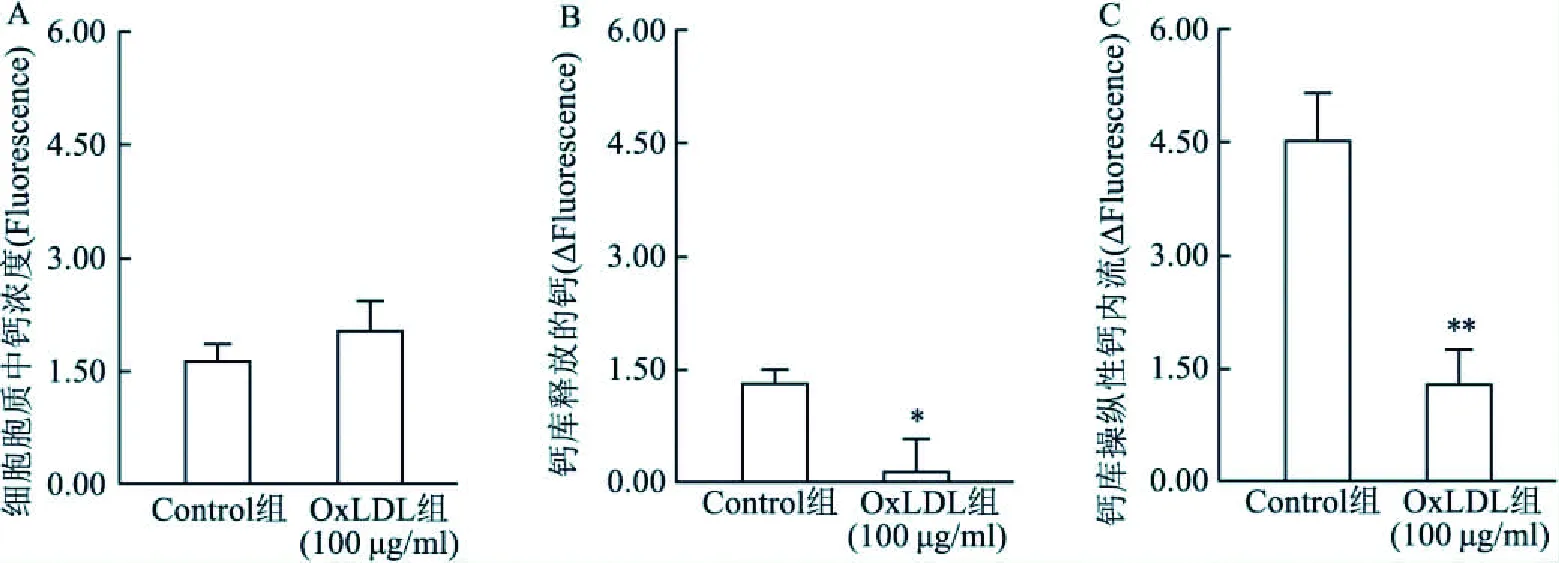
图3 OxLDL对HCAEC细胞的钙库操纵性钙内流(SOCE)的影响A:静息胞质钙浓度;B:钙库释放的钙;C:SOCE;与Control组比较:*P<0.05,**P<0.01

