自体脂肪间充质干细胞移植对急性心肌梗死大鼠心室重构及氧化应激的影响
张 建,钟 莉
急性心肌梗死主要是冠状动脉血流急性中断,心肌细胞供血不足而引起坏死的一类心脏疾病,而梗死后继发的心力衰竭、心源性休克等是患者死亡的主要原因[1]。尽管急性心肌梗死的临床治疗已取得显著的进步,但治疗效果仍存在一定的局限性,无法修复已坏死的心肌细胞。急性心肌梗死后心室重构和心肌细胞丢失是心力衰竭进展或患者死亡的主要因素[2]。因此,在临床上急需一种可以抑制急性心肌梗死患者心室重构和修复坏死心肌细胞的治疗方法。干细胞可在特定环境和条件下,分化成多种组织细胞,具有自我更新、多向分化的能力,已逐渐应用于急性心肌梗死的治疗[3-4]。目前,应用于心血管疾病的干细胞种类很多,相关研究表明,自体脂肪间充质干细胞(adipose derived mesenchymal stem cells, ADSCs)可有效改善缺血缺氧心肌损伤,促进血管新生和心肌功能的恢复[5],但其具体作用机制尚未完全明了。本研究拟从心室重构和氧化应激方面探讨ADSCs对急性心肌梗死大鼠的心肌保护作用。
1 材料与方法
1.1实验动物与分组 27只雄性SD大鼠由北京实验动物研究中心提供,动物许可证号:SCXK(京)2019-0005。周龄6~8周,体重200~240 g,适应性喂养7 d后,随机分为假手术组、模型组及ADSCs组,每组9只,按组别分笼饲养,自由摄食进水。
1.2ADSCs的分离、培养与鉴定 无菌条件下,取SD大鼠腹股沟皮下脂肪,剪碎后用Ⅱ型胶原酶(美国Gibco公司)消化为乳糜状,终止消化后加入培养基,过滤去除上层乳糜层,加入培养基重悬细胞后接种,于37℃、5% CO2培养箱中培养24 h换液,随后2~3 d换液;观察细胞状态,待细胞融合至80%左右时传代,取3~5代的细胞备用,经流式细胞仪鉴定符合间充质干细胞标准[6]。
1.3模型的建立与处理 腹腔注射戊巴比妥钠麻醉大鼠,取仰卧位固定,连接呼吸机(上海玉研科学仪器有限公司)和心电图(上海海哲仪器设备有限公司),于左侧第3和第4肋间作切口,逐层分离肌群和胸膜,暴露心脏,分离左前降支血管,于左心耳下缘处结扎,当心脏搏动减弱,呈暗红色,心电图显示R波升高、ST段明显抬高时,表明结扎成功[7]。术后给予青霉素抗感染处理,注意保暖。假手术组仅穿线、不结扎。ADSCs组于心肌梗死区边缘注射ADSCs细胞悬液200 μl,分4点注射;假手术组和模型组则以等量培养基替代。
1.4观察指标与检测方法
1.4.1超声心动图检测:于移植28 d后行心脏超声检测,检测各组大鼠左心室射血分数(left ventricular ejection fraction, LVEF)、左心室舒张末期内径(left ventricular end diastolic diameter, LVEDD)及左心室收缩末期内径(left ventricular end systolic diameter, LVESD)。
1.4.2HE染色:于移植28 d后处死大鼠,迅速取出心脏,置于4%多聚甲醛溶液中固定过夜,经常规石蜡包埋切片,进行HE染色,显微镜下观察各组大鼠心肌组织的病理变化。
1.4.3Masson染色:参照上述方法制备心肌组织切片,进行Masson染色(武汉纯度生物科技有限公司);纤维组织替代梗死组织被染成蓝色,正常心肌组织被染成红色,计算心肌纤维化程度。
1.4.4氧化应激因子水平检测:于移植28 d后处死大鼠,取梗死区心肌组织,加入生理盐水冰上匀浆,离心分离上清液,参照丙二醛(malondialdehyde, MDA)、超氧化物歧化酶(superoxide dismutase, SOD)及谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-PX)试剂盒(南京建成生物工程研究所)说明书进行操作,检测大鼠心肌梗死组织中氧化应激因子MDA、SOD及GSH-PX的含量。
1.4.5Western Blot检测:于移植28 d后处死大鼠,取梗死区心肌组织,加入RIPA裂解液进行匀浆,离心取上清液,经BCA法检测蛋白浓度;取50 μg蛋白进行SDS-PAGE凝胶电泳,待蛋白电泳至下端时,湿转至PVDF膜上;浸泡于5%脱脂奶粉中孵育1.5 h,封闭非特异性蛋白位点;添加相应蛋白一抗(美国Cell Signaling公司),分别为基质金属蛋白酶-2(matrix metalloproteinase-2, MMP-2)一抗(1∶1500)和鼠抗β-actin(1∶1000),4℃摇晃过夜;添加二抗(美国Cell Signaling公司),MMP-2添加山羊抗兔(1∶8000),β-actin添加山羊抗鼠(1∶8000),37℃摇晃1 h;经ECL法显示蛋白条带。
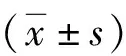
2 结果
2.1超声心动图指标比较 3组大鼠的各超声心动图指标比较差异均有统计学意义(P<0.01)。与假手术组比较,模型组的LVEF水平显著降低,LVEDD及LVESD水平显著升高(P<0.05);与模型组比较,ADSCs组的LVEF水平显著升高,LVEDD及LVESD水平显著降低(P<0.05)。见表1。
2.2心肌组织病理变化 HE染色结果显示,与假手术组比较,模型组大鼠心肌组织形态学变化显著,梗死区心肌细胞出现不同程度肥大、伸长或坏死,另有明显水肿和炎性细胞浸润,病变范围广泛;ADSCs组明显可见病灶吸收,但仍伴有炎性细胞浸润和纤维组织增生,病变程度较模型组轻。见图1。
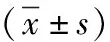
表1 3组大鼠的超声心动图指标的比较
注:ADSCs为脂肪间充质干细胞,LVEF为左心室射血分数,LVEDD为左心室舒张末期内径,LVESD为左心室收缩末期内径;与假手术组比较,aP<0.05;与模型组比较,cP<0.05

图1 3组大鼠的心肌组织病理变化(HE ×200)
ADSCs为脂肪间充质干细胞
2.3心肌纤维化程度比较 Masson染色结果显示,与假手术组比较,模型组大鼠心肌组织中可见大范围蓝色的间质纤维区,梗死部分纤维增生严重;与模型组比较,ADSCs组间质纤维增生明显减少。见图2。假手术组、模型组和ADSCs组心肌纤维化程度分别为(7.51±5.32)%、(48.37±8.26)%和(26.41±7.15)%。3组纤维化程度比较差异有统计学意义(P<0.01);与假手术组比较,模型组心肌纤维化程度显著升高(P<0.05)。与模型组比较,ADSCs组心肌纤维化程度显著降低(P<0.05)。

图2 3组大鼠的心肌纤维化程度(Masson ×400)
ADSCs为脂肪间充质干细胞
2.4氧化应激因子水平比较 3组MDA、SOD和GSH-PX水平比较差异有统计学意义(P<0.01)。与假手术组比较,模型组的SOD和GSH-PX水平显著降低,MDA水平显著升高(P<0.05);与模型组比较,ADSCs组的SOD和GSH-PX水平显著升高,MDA水平显著降低(P<0.05)。见表2。
2.5MMP-2蛋白表达水平比较 与假手术组比较,模型组心肌梗死组织中MMP-2蛋白表达水平显著上调(P<0.05);与模型组比较,ADSCs组心肌梗死组织中MMP-2蛋白表达水平显著下调(P<0.05)。见图3。
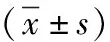
表2 3组大鼠心肌梗死组织中氧化应激因子水平的比较
注:ADSCs为脂肪间充质干细胞,MDA为丙二醛,SOD为超氧化物歧化酶,GSH-PX为谷胱甘肽过氧化物酶;与假手术组比较,aP<0.05;与模型组比较,cP<0.05

图3 3组大鼠心肌梗死组织中MMP-2蛋白表达水平比较
A.假手术组;B.模型组;C.ADSCs组;ADSCs为脂肪间充质干细胞,MMP-2为基质金属蛋白酶-2
3 讨论
目前,骨髓间充质干细胞是研究最为广泛的间充质干细胞,但骨髓间充质干细胞局限于取材部位,可获细胞数量少,而且取材过程比较痛苦,因而临床应用受到限制[8]。有研究发现,ADSCs与骨髓间充质干细胞具有相似的特性,而且ADSCs容易获得,体外扩增简单,是较为理想的间充质干细胞[9]。近年来,临床应用表明间充质干细胞移植能明显恢复急性心肌梗死后心肌功能。Jiang等[10]采用不同氧浓度缺氧处理ADSCs,发现3%氧处理后的ADSCs可有效改善心肌梗死大鼠的心功能,减少心肌梗死面积。张泽宇等[11]的实验研究表明,从大鼠中分离ADSCs移植于心肌缺血再灌注大鼠模型,能明显下调模型大鼠炎症水平和心肌梗死面积,有效改善大鼠心肌功能,可能通过调节免疫细胞水平发挥保护作用。本研究通过结扎冠状动脉前降支的方法构建急性心肌梗死大鼠模型,并发现移植ADSCs后,急性心肌梗死大鼠心肌组织病理变化明显减轻,与上述研究结果相符。
急性心肌梗死发病过程中,大量心肌细胞损伤、丢失,甚至坏死,机体会启动自我修复过程,即心室重构[12-13]。MMPs是巨噬细胞分泌的一类锌离子依赖的内肽酶,可降解细胞外基质破坏心肌细胞,MMP-2是MMPs家族的成员之一,在急性心肌梗死心肌组织中高度表达[14]。近年来,大量研究揭示了心肌组织纤维化在心室重构中的作用。心室重构过程中有大量成纤维细胞被激活,分泌大量胶原纤维及细胞外基质沉积,导致心肌间质纤维化[15]。本研究结果发现,ADSCs可明显逆转心肌梗死后出现的心室壁变薄、心室扩大及舒缩功能下降的现象,并显著下调MMP-2的表达。提示ADSCs可能通过下调MMP-2水平,防止心肌纤维化程度加重,从而抑制急性心肌梗死大鼠的心室重构。
近来研究发现,氧化应激也是心室重构发生的重要机制之一[16]。心肌缺血缺氧会引起大量氧自由基的沉积,对心肌细胞造成严重损伤,同时导致脂质过氧化物MDA的增多,进一步损伤心肌细胞[17]。本研究结果显示,ADSCs可明显上调心肌梗死组织中抗氧化剂SOD和GSH-PX水平,并降低MDA水平;提示ADSCs可能通过抑制氧化应激反应减轻心肌细胞损伤。师帅南等[18]研究也证明,ADSCs可调控氧化应激水平,减轻缺血再灌注损伤,与本研究结果相似。
综上所述,本研究数据表明应用ADSCs移植治疗急性心肌梗死大鼠,可修复其心肌组织病理改变,降低其心肌纤维化程度,抑制心室重构及氧化应激水平,阻碍急性心肌梗死的进展。但ADSCs是否通过分泌细胞因子起保护作用,尚待进一步研究证明。

