活血化瘀类中药抗胰腺癌作用机制研究进展
董姝洁 王琪瑞 孙思雅 来梦茹 葛宇清 程汝滨
【摘 要】 文章从影响细胞周期、诱导细胞凋亡、抑制肿瘤血管生成、抑制肿瘤侵袭转移和提高化疗药物疗效5个方面,对活血化瘀类中药的抗胰腺癌作用机制进行总结,对疗效确切、机制明确和开发前景巨大的活血化瘀类中药活性组分进行梳理,对后期活血化瘀类中药在胰腺癌中的应用前景进行展望和预测,以期加速活血化瘀类中药在胰腺癌治疗中的研发进程,为抗胰腺癌的临床治疗提供新的治疗策略。
【关键词】 活血化瘀类中药;胰腺癌;作用机制;研究进展
【中图分类号】R285.5 【文献标志码】 A 【文章编号】1007-8517(2020)21-0059-06
Abstract:This article summarizes the anti-pancreatic cancer mechanism of traditional Chinese medicine for promoting blood circulation and removing blood stasis from five aspects:influencing cell cycle, inducing cell apoptosis, inhibiting tumor angiogenesis, inhibiting tumor invasion and metastasis and improving the curative effect of chemotherapy drugs. The active components of traditional Chinese medicine for promoting blood circulation and removing blood stasis with definite curative effect, clear mechanism and great development prospect are sorted out. The application prospect of traditional Chinese medicine for promoting blood circulation and removing blood stasis in pancreatic cancer at the later stage is predicted, so as to accelerate the research and development process of traditional Chinese medicine for promoting blood circulation and removing blood stasis in pancreatic cancer treatment and provide new treatment strategies for clinical treatment of anti-pancreatic cancer.
Keywords:Traditional Chinese Medicine for Promoting Blood Circulation and Removing Blood Stasis; Pancreatic Cancer; Mechanism ;Research Progress
胰腺癌(Pancreatic Cancer)是常见的恶性肿瘤之一,其发病率呈逐年上升趋势, 死亡率已跃居所有肿瘤的前5位[1]。在过去的十几年中, 我国胰腺癌发病率增加了1.3倍, 死亡率增加了1.2倍[2-3]。胰腺癌的治疗手段以根治性手术切除配合化疗及靶向治疗等综合治疗为主,化疗常作为患者的辅助治疗措施。胰腺癌的早期诊断比较困难,当诊断出胰腺癌时,大多处在中晚期,手术切除的成功率只有约20%,且术后的高复发率和远处转移容易导致患者的预后情况极差[4-5],数据显示晚期胰腺癌的五年生存率仅为3%[6]。目前胰腺癌的靶向药物以血管内皮生长因子(Vascular Endothelial Growth Factor,VEGF)、表皮生长因子受体(Epithelial Growth Factor Receptor,EGFR)、柯尔斯顿鼠肉瘤病毒致癌基因(Kirsten Rat Sarcoma Viral Oncogene,KRAS)、尿激酶型纤溶酶原激活物受体(Urokinase-type Plasminogen Activator Receptor,uPAR)、转铁蛋白受体(Transferrin Receptor,TfR)、酪氨酸激酶受体2 (Human Epidermal Growth Factor Receptor-2,ErbB2)等为主要靶点,作用于胰腺癌细胞,降低对正常组织和细胞的毒副作用,增强治疗效果[7-8]。随着胰腺癌相关信号通路研究的深入,靶向治疗成为胰腺癌患者的选择之一,但也存在很多不足,如靶向药物价格昂贵、不良反应严重,比如粒细胞减少等[9]。除化学治疗和靶向治疗外,免疫治疗和中医药治疗也是抗胰腺癌的关键治疗手段[10]。研究表明,免疫治疗在抗胰腺癌方面有显著效果[11],但因其引起的不良反应等诸多困难也需要克服,迄今为止未能筛选获得有效的胰腺癌免疫治疗药物。中医药作为肿瘤治疗领域重要的替代和补充方法,从患者的全身特点和病程加以考虑用药, 在胰腺癌的综合治疗中具有独特的优势和地位。因此,重视中医药治疗是抗胰腺癌进程的重要举措之一。
胰腺癌在中医理论中可归属于“癥瘕”“积聚”“伏梁”“黄疸”等病证范畴,发病机制复杂[12]。中医认为,胰腺癌核心病机之一是“气滞血瘀”,气血是维持生命活动及生理功能的物质基础, 气行则血行, 气滞则血凝, 气滞血瘀日久, 则郁结成块, 形成肿瘤[13]。现代药理研究表明[14],活血化瘀法治疗肿瘤有积极作用,能有效抑制肿瘤的生长和转移,提高机体免疫力,在临床运用越来越广泛。活血化瘀类中药以活血为主要功效,大多味辛苦,具有活血、化瘀、通络、止痛等作用,典型的中药有姜黄、丹参、三七、红花等[15]。活血化瘀类中药的药理作用广泛、疗效确切。现代研究表明[16],活血化瘀类中药具有改善血液流变学、改善微循环、促血管再生、抗血栓、抗血小板、抗肿瘤等作用。万新焕等[17]研究表明,丹参可以抗炎、抗肿瘤、抗氧化、免疫调节、保护心血管系统,开发前景广阔。此外,活血化瘀類中药可通过多种途径发挥抗胰腺癌的作用。笔者通过综述活血化瘀类中药活性组分抗胰腺癌的作用和机制,为胰腺癌的中药治疗药物研发提供一定的参考借鉴,并为基于中西医结合的胰腺癌患者临床的治疗策略的制定和优化奠定基础。
1 影响细胞周期
细胞周期是细胞从一次分裂完成开始到下一次分裂结束所经历的全过程,癌症的发生与细胞周期失调、细胞增殖异常密切相关。相关研究表明多种活血化瘀类中药可以通过影响细胞周期、阻滞细胞增殖而发挥有效抵抗胰腺癌进展的功能。
1.1 姜黄 姜黄性寒味辛苦,辛散温通,具有活血行气、通经止痛的功效,从中提取的姜黄素(Curcumin)能诱导肿瘤细胞周期阻滞在G2/M期,且以劑量和时间依赖的方式抑制细胞增殖[18]。宋魏等[19]发现姜黄素对胰腺癌细胞的增殖抑制作用与下调人胰腺癌细胞SW1990 β-Catenin基因表达、抑制Wnt信号通路活化有关。此外,新型姜黄素衍生物C086对胰腺癌细胞Panc-1也具有明显的抑制作用[20]。
1.2 斑蝥 斑蝥味辛,性热有大毒,具有破血消癓、逐瘀散结的功效。从动物斑蝥中提取的斑蝥素(cantharidin)多用于治疗肝癌,且效果显著。王蓉[21]研究发现斑蝥素也可抑制胰腺癌细胞生长,其机制是通过抑制对细胞周期起重要调控作用的蛋白磷酸酶2A,利用PP2A/JNK/Sp1/CDK1信号通路诱导胰腺癌细胞G2/M周期阻滞, 从而显示出良好的抗胰腺癌活性
1.3 其他 雷公藤甲素(Triptolide)是从卫矛科植物雷公藤中提取的一种环氧二萜内酯化合物,是雷公藤提取物的主要活性成分[22],可阻塞Hedgehog信号通路以抑制胰腺癌细胞增殖[23]。此外,丹参酮ⅡA(TanshinoneⅡA)是丹参起活血化瘀作用的主要活性成分之一,可通过诱发内质网应激抑制人胰腺癌BxPC-3细胞增殖[24]。
2 诱导细胞凋亡
细胞凋亡是指为维持机体内环境稳定,由基因调控的细胞自主有序的死亡,其异常使人体器官无法清除多余、变异或恶化细胞,以致发生癌症等多种疾病[25]。研究发现,多种活血化瘀类中药可通过诱导胰腺癌细胞凋亡的途径发挥抗胰腺癌的作用。
2.1 雷公藤 雷公藤在诱导胰腺癌细胞凋亡治疗方面中有重大作用。林文杰等[26]发现14-3-3γ蛋白作为一种抗细胞凋亡因子,雷公藤甲素可显著抑制其在胰腺癌细胞的表达,促进细胞凋亡。朱陵霞等[27]发现雷公藤红素(Tripterine)可以抑制P21活化蛋白激酶1及其下游信号通路蛋白的表达,从而激活凋亡信号通路引发胰腺癌细胞发生凋亡。雷公藤红素还可以下调miR-223,从而诱导人胰腺癌细胞PC3发生凋亡[28]。
2.2 丹参 丹参作为活血化瘀要药,广泛应用于各种瘀血病症。最新研究发现[29],丹参二萜醌类活性成分隐丹参酮(Cryptotanshinone)、丹参新酮(Miltirone)、去氢丹参新酮(Dehydromiltirone)可促进胰腺癌AsPC-1和BxPC-3细胞凋亡发生,其机制可能是通过抑制PKCδthr505磷酸化水平,下调PKD1μser744/748磷酸化水平。课题组前期研究也发现,隐丹参酮能够通过降低信号转导和STAT3的活性使Caspase-3、Caspase-9和ADP核糖聚合酶的蛋白水平上调,同时下调C-myc、Survivin和Cyclin D1水平,诱导胰腺癌BxPC-3细胞凋亡[30]。
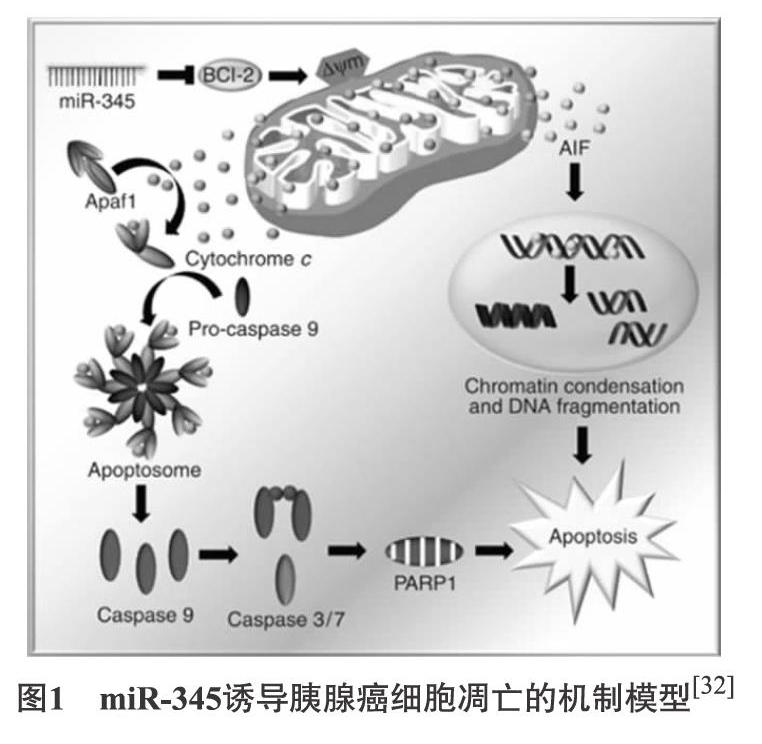
2.3 三七 三七性温,味甘微苦,功善止血,又能化瘀生新,有“止血不留瘀、化瘀不伤正”的特点。研究发现,三七总皂苷(Panax notoginseng saponins)可抑制人胰腺癌Panc-1细胞的增殖活力,可能通过上调促凋亡蛋白Bax及下调抗凋亡蛋白Bcl-2的表达来激活Caspase级联反应,从而诱导Panc-1细胞凋亡[31]。此外,研究还发现miR-345的功能靶点之一为抗凋亡蛋白Bcl-2,如图1所示,这使其在调节细胞凋亡中起着重要作用。
3 抑制肿瘤血管生成
血管生成是从现有的内皮细胞中生成新的血管,进而向各种器官提供充足氧气和营养的过程,其对于肿瘤的生长和转移至关重要,已被证明是肿瘤治疗的重要靶标[33]。研究显示,一些活血化瘀类中药具有抑制肿瘤血管生成的作用,可有效对抗胰腺癌。
3.1 大黄 陈敏远等[34]实验发现大黄素(Emodin)能抑制裸鼠SW1990细胞原位移植瘤的新生血管形成,其机制可能与下调VEGF表达以及调节与新生血管相关microRNA miR-20b、miR-21、miR-155、miR-210表达有关。大黄素也能改变新生血管相关的TGF-β1、Smad4的表达,从而对新生血管抑制效果显著[35]。Lin等[36]还发现大黄素可抑制体外和植入的胰腺癌组织中的肿瘤血管生成,降低血管生成相关因子(NF-κB及其调节因子VEGF、MMP-2、MMP-9和eNOS)的表达,并降低一氧化氮合酶的磷酸化。
3.2 姜黄 PTEN/AKT信号通路在肿瘤发展和进展中起重要作用,VEGF的表达与其显著相关[37]。有研究表明,姜黄素能通过抑制PI3K/AKT信号通路而激活Fox O1通路, 下调VEGF蛋白的表达, 阻滞肿瘤血管生成[38]。Shan[39]发现Tu1679-姜黄素也可抑制胰腺癌与星状细胞相互作用诱导生成的肿瘤血管。
4 抑制肿瘤侵袭转移
肿瘤细胞侵袭转移是癌症导致死亡的主要原因,因此,抑制癌细胞侵袭转移对抗肿瘤尤为重要。研究发现,多数活血化瘀类中药已有明确的抑制胰腺癌细胞侵袭转移的能力。
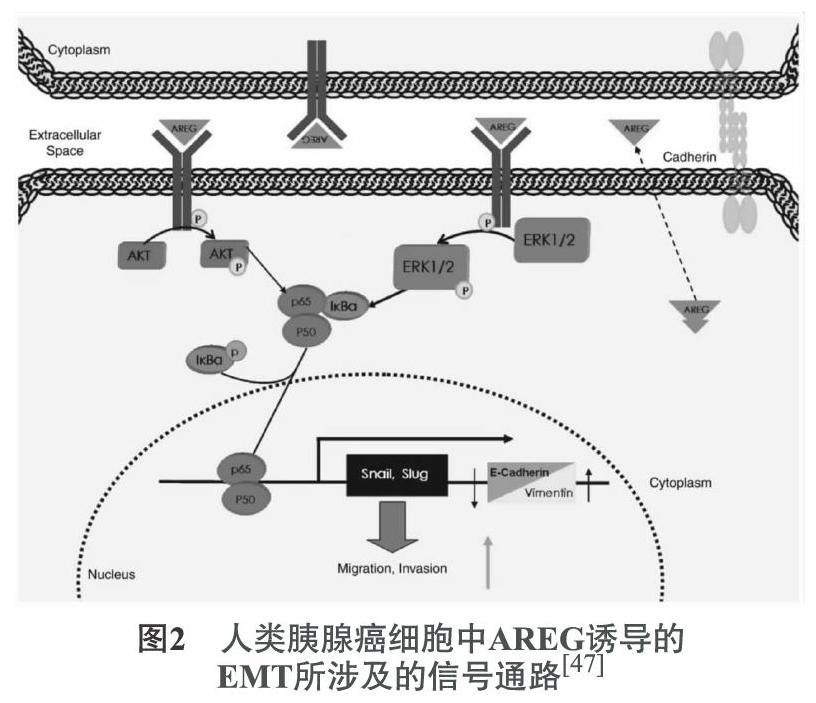
4.1 虎杖上皮间质转化 (Epithelial mesenchymal transition,EMT)是实现肿瘤侵袭和转移的重要途径[40]。如图2所示,AREG通过EGFR/ERK信号通路诱导NF-κB/p65的核积累,而后NF-κB通过调节人胰腺癌细胞中的EMT介导AREG诱导的细胞迁移和侵袭,使用不同的抑制剂阻断这些途径就可降低胰腺癌细胞的EMT。如从虎杖等植物中提取的一种多酚类化合物白藜芦醇(Resveratrol),国内外研究均显示白藜芦醇能显著抑制肿瘤侵袭转移。Li等[41]早期研究表明, 白藜芦醇可通过抑制PI3K/AKT/NF-κB途径来抑制EMT相关基因如上皮钙黏素、神经钙黏素的表达, 进而抑制肿瘤的侵袭转移。蒋正东等[42]发现白藜芦醇能够抑制胰腺星状细胞的活化,抑制α-SMA及YAP、CTGF及CYR61的表达,从而降低共培养条件下胰腺癌细胞Panc-1的侵袭能力和EMT转化。另有研究发现,白藜芦醇衍生物三乙酰白藜芦醇(Triacetyl resveratrol,TCRV)可以通过靶向Shh途径及其下游信号介质来抑制胰腺癌的生长和EMT转化[43]。
4.2 其他 Li等[44]实验发现miR-1271能显著抑制胰腺癌的EMT的转化,且经大黄素处理后的SW1990细胞的细胞侵袭力较对照组明显降低,而在40mol/L大黄素处理组中对EMT的抑制作用更为显著。这表明大黄素可通过提高胰腺癌细胞中miR1271的水平来抑制胰腺癌细胞的EMT。姜黄素能通过抑制ERK/AKT信号通道,降低由高血糖诱发表皮生长因子诱导的胰腺癌侵袭和转移能力[45]。Wang等 [46]认为姜黄素可通过降低肿瘤相关纤维母细胞(CAFs)的间充质特性达到抑制胰腺癌细胞迁移和转移。
5 提高化疗药物效果
化疗在恶性肿瘤的治疗中有着不可替代的地位,常作为胰腺癌根治性手术后的一线治疗手段,虽然疗效较好,但临床上常见不良反应较多,对患者机体的损害较为严重,如今仍然是肿瘤治疗的难题之一。研究显示,使用活血化瘀类中药辅助化疗医治胰腺癌,可减轻毒害、协同增效。
现有研究表明,活血化瘀类药通过多种途径达到增效减毒的目的。如雷公藤甲素可通过抑制TLR4/ NF-κB信号增强胰腺癌PANC-1细胞对吉西他滨的敏感性[48]。郭少贤等[49]临床实验也发现雷公藤多苷片联合吉西他滨治疗可改善中晚期胰腺癌患者的免疫功能。姜黄素可下调胰腺癌Panc-1细胞对凋亡抑制因子蛋白及mRNA的表达,克服IAP介导的化疗耐药[50]。姜黄素还可通过抑制PRC2-PVT1-c-Myc逆转胰腺癌PDAC细胞对吉西他滨的耐药性[51]。姜黄素逆转SW1990细胞对吉西他滨的耐药性,其机制可能与PI3K/AKT通路有关[52]。藤黄酸(Garcinia acid)可以通过抑制耐药基因RRM2的表达增加胰腺癌细胞对吉西他滨的敏感性[53]。大黄素可抑制细胞MDR-1基因的表达,改善胰腺癌细胞对吉西他滨的耐药[54]。白藜芦醇则通过靶向SREBP 1增强胰腺癌细胞的化疗反应并逆转吉西他濱诱导的干细胞增殖[55]。
6 展望
中医药诊治胰腺癌的思路强调以整体观念和辨证论治为前提,分清疾病病症主次,同时根据胰腺癌所处的不同阶段,治则相合,一方复法,多法并用,协同增效,减轻胰腺癌患者病痛,降低其复发转移风险,延长患者生存期[56],这为广大学者探究胰腺癌治疗拓展了思路。除前文所述中药活性化合物外,某些活血化瘀药的提取物也被发现具有显著的抗胰腺癌作用,如仙鹤草水提液(Water Extract of Agrimonia Pilosa)[57]、乳香提取物(Olibanum extract) [58]等,均对胰腺癌细胞增殖有抑制作用。以中药活性组分为依据进行相关药理学的研究,探究中药临床治病的多样性和多靶性,拓展中药的临床应用范围,是当代中药学研究的重要方向,这为抗胰腺癌的活血化瘀类中药的活性药物成分开发奠定基础。
此外,现阶段临床使用活血化瘀中药除了占比很大一部分的植物药外,动物类药也是活血化瘀中药重要的组成部分。《本草问答》中记载:“动物之功利,优甚于植物,以其动物之本性能行,而且具有攻击性”,明确指出了动物药的独特优势。目前临床中常用的活血化瘀中药动物类的有斑蝥、水蛭、蜈蚣、土鳖虫等,但对其抗胰腺癌作用的研究大多还停留在基础研究阶段,其作用机理仍未完全阐明,具有强大抗癌潜能的活血化瘀动物类中药仍待发掘。目前需要加快开展活血化瘀药相关活性成分及提取物的研究进程,倚靠系统化、规范化的技术平台,多角度进行药物的药效评估和安全性评价。积极发挥中西医结合治疗胰腺癌的优势,加快患者康复进程,为改善患者生活质量、延长患者生存时间、提高患者治愈率做出贡献。
参考文献
[1]SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2018[J]. CA:a cancer journal for clinicians, 2018, 68(1):7.
[2]CHEN W Q,ZHENG R S,BAADE P D,et al. Cancer statistics in China,2015[J]. CA:a cancer journal for clinicians,2016,66(2):115-132.
[3]BIAN X J,DAI H J,FENG J,et al. Prognostic values of abdominal body compositions on survival in advanced pancreatic cancer[J].Medicine,2018,97(22):e10988.
[4]HARMSEN FINN-J R,DOMAGK D,DIETRICH C F, et al. Discriminating chronic pancreatitis from pancreatic cancer:Contrast-enhanced EUS and multidetector computed tomography in direct comparison[J]. Endoscopic ultrasound,2018,7(6):395-403.
[5]王瑞芝,王小林.胰腺癌分子靶向治疗的研究进展[J].复旦学报(医学版),2018,45(1):77-86.
[6]SIEGEL R L,MILLER K D,JEMAL A.Cancer statistics,2020[J].CA-Cancer J Clin,2020,70(1):7-30.
[7]毛铁波,崔玖洁,王理伟.胰腺癌综合治疗的进展与突破[J].循证医学,2019,19(5):257-260.
[8]徐思羽.胰腺癌靶向药物研究进展[J].中国药事,2018,32(9):1257-1263.
[9]周渊,周雪亮,张荣丽,等.胰腺癌分子靶向治疗研究进展[J].中国继续医学教育,2019,11(23):111-113.
[10]方昀,来梦茹,葛宇清,等.胰腺癌药物治疗的现状与展望[J].中国中药杂志,2019,44(8):1509-1516.
[11] HE J C, ZHANG Z W,LV S Q,et al.Engineered CAR T cells targeting mesothelin by piggyBac transposon system for the treatment of pancreatic cancer[J]. Cellular Immunology,2018,329(4):31-40.
[12]金斗镇.中医对胰腺癌的认识和治疗方法[J].黑龙江中医药,2006(5):57-59.
[13]杨世红,曲强,杜雨锡.朴炳奎老师治疗肿瘤病思路探析[J].中国中医药现代远程教育,2015,13(12):35-36.
[14]汤芷妮,骆云鹏,葛菲,等.活血化瘀抗肿瘤中草药作用机制的研究进展[J].中国药房,2016,27(8):1146-1149.
[15]杭传珍.活血化瘀治则的药理学基础[J].中医临床研究,2019,11(1):34-35.
[16]高樱,杨龙飞,翟阳,等.具有活血化瘀功效的中药药理作用及机制研究进展[J].中华中医药杂志,2018,33(11):5053-5056.
[17]万新焕,王瑜亮,周长征,等.丹参化学成分及其药理作用研究进展[J].中草药,2020,51(3):788-798.
[18]ZHU Y P,BU S R. Curcumin Induces Autophagy, Apoptosis, and Cell Cycle Arrest in Human Pancreatic Cancer Cells[J]. Evidence-based complementary and alternative medicine:eCAM,2017,10(11):57-60.
[19]宋魏,崔云,张建波,等.姜黄素对人胰腺癌细胞增殖抑制作用及对Wnt信号通路的影响[J].世界中医药,2018,13(5):1226-1228.
[20]王晓露,刘碧,肖恒,等.新型姜黄素衍生物C086对胰腺癌细胞Panc-1的抑制作用[J].海峡药学,2018,30(2):20-22.
[21]王蓉. PP2A抑制劑诱导胰腺癌细胞G2/M周期阻滞的机制研究[D].苏州:苏州大学,2016.
[22]王亚丹,汪祺,张建宝,等.雷公藤制剂的化学成分及质量研究现状[J].中国中药杂志,2019,44(16):3368-3373.
[23]FENG J J, RAO M J, WANG M,et al.Triptolide suppresses pancreatic cancer cell proliferation by inhibiting hedgehog signaling pathway activity[J].Science China(Life Sciences),2019,62(10):1409-1412.
[24]SU C C. Tanshinone IIA Could Inhibit Pancreatic Cancer BxPC-3 Cells through Increasing PERK, ATF6, Caspase-12 and CHOP Expression to Induce Apoptosis[J]. Journal of Biomedical ence and Engineering, 2015, 8(3):149-159.
[25]赵相轩,温锋,卢再鸣.细胞凋亡在乳腺癌治疗中的研究进展[J].临床肿瘤学杂志,2017,22(2):175-179.
[26]林文杰,王伟,李新丰,等.14-3-3γ蛋白与雷公藤甲素诱导胰腺癌细胞凋亡机制的相关性研究[J].华中科技大学学报(医学版),2018,47(3):291-294.
[27]朱陵霞,孙晓艳,陈姣,等.雷公藤红素通过抑制PAK1抗胰腺癌作用及其机制研究[J].药学学报,2020,55(1):60-66.
[28]CAO L, ZHANG X, CAO F, et al. Inhibiting inducible miR-223 further reduces viable cells in human cancer cell lines MCF-7 and PC3 treated by celastrol[J]. Bmc Cancer, 2015, 15(1):873.
[29]叶晓鸥.丹参二萜醌类活性成分通过PKCδ/PKD1μ信号通路抗胰腺癌作用研究[J].浙江中西医结合杂志,2020,30(4):294-297,352.
[30]GE Y, YANG B, CHEN Z, et al. Cryptotanshinone suppresses the proliferation and induces the apoptosis of pancreatic cancer cells via the STAT3 signaling pathway[J]. Molecular Medicine Reports, 2015,12(5):7782-7788.
[31]姚黎超,王伟,武伦,等.三七总皂苷对人胰腺癌PANC-1细胞增殖、凋亡的影响[J].肿瘤药学,2019,9(6):870-874.
[32]SRIVASTAVA S K,BHARDWAJ A,ARORA S,et al. MicroRNA-345 induces apoptosis in pancreatic cancer cells through potentiation of caspase-dependent and -independent pathways[J]. British journal of cancer,2015,113(5303):660-668.
[33]LI M, ZHANG F, SU Y, et al. Nanoparticles designed to regulate tumor microenvironment for cancer therapy[J]. Life Sciences, 2018(201):37-44.
[34]陈敏远,郑晨果,刘长宝,等.大黄素抑制胰腺癌新生血管形成的机制研究[J].浙江中西医结合杂志,2019,29(9):709-713.
[35]徐锦波,陈敏远,徐宏涛.大黄素通过调节TGF-β1、Smad4抑制人胰腺癌的血管生成[J].医学研究杂志,2017,46(10):162-165.
[36]ZHANG L S, WEI W T, CHEN H, et al. Antitumor activity of emodin against pancreatic cancer depends on its dual role:promotion of apoptosis and suppression of angiogenesis[J].PloS ONE, 2017, 7(8):42-46.
[37]ZHANG Q B,LI X N,LI Y Q,et al. Expression of the PTEN/FOXO3a/PLZF signalling pathway in pancreatic cancer and its significance in tumourigenesis and progression[J]. Investigational new drugs,2020,38(2):321-328.
[38]ZHAO Z M,LI C G,XI H,et al. Curcumin induces apoptosis in pancreatic cancer cells through the induction of forkhead box O1 and inhibition of the PI3K/Akt pathway[J]. Molecular medicine reports,2015,12(4):5415-5422.
[39]SHAN S. Tu1679 - Curcumin Inhibits Angiogenesis Induced by Interaction of Pancreatic Cancer with Stellate Cells[J].Gastroenterology, 2018, 154(6):S-992.
[40]SHUANGSHUANG L, TASQEEN A, PAN D, et al. Genomic Variations in Pancreatic Cancer and Potential Opportunities for Development of New Approaches for Diagnosis and Treatment[J]. International Journal of Molecular Sciences, 2017, 18(6):1201.
[41]LI W,MA J G,MA Q Y,et al. Resveratrol inhibits the epithelial-mesenchymal transition of pancreatic cancer cells via suppression of the PI-3K/Akt/NF-κB pathway [J]. Current medicinal chemistry,2013,20(33):4185-4194.
[42]蒋正东,周灿灿,程亮,等.白藜芦醇通过调节Hippo信号通路抑制胰腺星狀细胞活化[J].西安交通大学学报(医学版),2019,40(4):512-516.
[43]JUNSHENG F U, ANJU S,SUSHANT S, et al. Triacetyl resveratrol upregulates miRNA200 and suppresses the Shh pathwayin pancreatic cancer:A potential therapeutic agent[J].International Journal of Oncology, 2019, 54(4):1306-1316.
[44]LI N, WANG C L, ZHANG P, et al. Emodin inhibits pancreatic cancer EMT and invasion by upregulating microRNA1271[J].Molecular Medicine Reports, 2018, 18(3):3366-3374.
[45]LI W,WANG Z,XIAO X,et al. Curcumin attenuates hyperglycemia-driven EGF-induced invasive and migratory abilities of pancreatic cancer via suppression of the ERK and AKT pathways[J]. Oncology reports,2019,41(1):650-658.
[46]WANG Q,QU C,XIE F,et al. Curcumin suppresses epithelial-to-mesenchymal transition and metastasis of pancreatic cancer cells by inhibiting cancer-associated fibroblasts[J]. American Journal of Cancer Research, 2017, 7(1):125.
[47]WANG L,WANG L L,ZHANG H, et al.AREG mediates the epithelial?mesenchymal transition in pancreatic cancer cells via the EGFR/ERK/NF-κB signalling pathway[J]. Oncology reports,2020,43(5):1558-1568.
[48]MA J X, SUN Y L, YU Y, et al. Triptolide enhances the sensitivity of pancreatic cancer PANC-1 cells to gemcitabine by inhibiting TLR4/NF-κB signaling[J]. American Journal of Translation Research,2019, 11(6):3750-3760.
[49]郭少贤,李亚杰,吕博杰,等.雷公藤联合吉西他滨治疗中晚期胰腺癌的临床效果及安全性分析[J].中国中西医结合消化杂志,2020,28(2):99-103.
[50]DíAZ O,CARLOS J,GONDA A,et al. Curcumin Induces Pancreatic Adenocarcinoma Cell Death Via Reduction of the Inhibitors of Apoptosis[J]. Pancreas, 2016, 45(1):101-109.
[51]KAZUHIRO Y, SHUSUKE T, PREETHI R, et al. Curcumin sensitizes pancreatic cancer cells to gemcitabine by attenuating PRC2 subunit EZH2, and the lncRNA PVT1 expression[J]. Carcinogenesis,2017,38(10):1036-1046.
[52]彭梦媛,邱峰,黄丹,等.姜黄素对胰腺癌SW1990细胞耐吉西他滨的逆转作用及机制研究[J].中国药房,2019,30(9):1192-1197.
[53]夏光概. 藤黄酸增加胰腺癌细胞化疗敏感性和促进胰腺癌细胞自噬的机制研究[D].上海:上海交通大学,2018.
[54]王文龙,孔庆志,卢宏达,等.大黄素通过下调多药耐药基因-1的表达改善胰腺癌细胞对吉西他滨的耐药研究[J].中国临床药理学杂志,2018,34(20):2427-2430.
[55]ZHOU C, QIAN W, MA J, et al. Resveratrol enhances the chemotherapeutic response and reverses the stemness induced by gemcitabine in pancreatic cancer cells via targeting SREBP1[J]. Cell Proliferation, 2019,52(1):n/a-n/a.
[56]姜菊玲,刘瑞,花宝金.《内经》“杂合以治”在胰腺癌辨治中的应用[J].吉林中医药,2019,39(11):1409-1412.
[57]蔡田恬,赵敏,王建平.仙鹤草水提液对胰腺癌细胞BXPC-3和PANC-1增殖的抑制作用研究[J].中国现代应用药学,2018,35(8):1208-1211.
[58]倪效,梁晓强,张静喆.乳香提取物抑制裸鼠胰腺癌生长的作用及机制研究[J].中国中西医结合外科杂志,2015,21(4):376-379.
(收稿日期:2020-06-01 編辑:程鹏飞)

