血府逐瘀汤对血管紧张素Ⅱ诱导大鼠骨髓源内皮祖细胞衰老、迁移功能及miR-34a表达的影响
何 莉,刘 芸2,张 瑶3,梁 昊,张秋雁,聂 娟,杨 漾,谢 辉
缺血性心脏病是由于冠状动脉循环改变引起冠状动脉血流和心肌需求之间不平衡而导致的心肌损害,其中以冠状动脉粥样硬化引起的冠状动脉狭窄和闭塞为特征的冠心病(coronary artery disease, CAD)是其最常见类型,严重危害人类健康,尽管人们采取了各种现代化治疗方法,如静脉溶栓、抗血小板聚集、心脏介入等,其发病率和死亡率均仍居各类致死性疾病前列。CAD发生后,除疏通阻塞的冠状动脉外,还可以通过血管新生产生侧支循环实现“自我搭桥”,挽救更多的心肌,从而降低病死率[1-2]。作为血管内皮前体细胞的内皮祖细胞(EPCs)在血管新生中扮演着重要的角色[3]。然而,病理状态下EPCs存在衰老现象,严重影响其增殖和功能[4]。因此,延缓EPCs衰老、促进EPCs的迁移是实现冠状动脉阻塞后血管新生的关键环节。
活血化瘀是中医学治疗冠心病的根本大法,血府逐瘀汤又是活血化瘀的经典名方,大量临床研究证实其具有较好的抗心肌缺血作用。研究发现血府逐瘀汤可诱导EPCs迁移至缺血区,促进血管新生,进而改善缺血区心肌缺血坏死[5],这种作用可能是通过抗EPCs衰老而实现的。本实验观察血府逐瘀汤对血管紧张素Ⅱ(AngⅡ)诱导的大鼠骨髓源内皮祖细胞衰老、迁移功能及miR-34a表达的影响,探讨血府逐瘀汤抗衰老的作用及机制。
1 材料与方法
1.1 动物 取原代EPCs用的SD雄性大鼠40只,4周龄,体质量100 ~110 g,动物合格证:43004700025025。取血清用的SD雄性大鼠,40只,体质量250 ~280 g,动物合格证:43004700024153。以上动物均由湖南中医药大学动物实验中心提供,湖南中医药大学实验动物中心清洁级动物房饲养,饲养环境:温度20~25 ℃,湿度55%~60%,通气良好。
1.2 药物 血府逐瘀汤出自王清任《医林改错》,组方:当归三钱(9 g),生地三钱(9 g),桃仁四钱(12 g),红花三钱(9 g),枳壳二钱(6 g),赤芍二钱(6 g),柴胡一钱(3 g),甘草二钱(6 g),桔梗一钱半(4.5 g),川芎一钱半(4.5 g),牛膝三钱(9 g)。药材购于湖南中医药大学第一附属医院。药液制备:加10倍量水浸泡0.5 h,然后用电热套加热回流提取1 h,滤过;第2次加8倍量水,同法再煮1 h。合并两次煎液,浓缩至含生药量1.56 g/mL。
1.3 试剂 EGM-2培养基:美国LONZA公司(CC-4147);青-链霉素:碧云天公司(ST488);大鼠骨髓源淋巴细胞分离液:天津灏洋公司(LTS1083);磷酸缓冲盐溶液(PBS):Hyclone公司(SH30256.01B);DMEM高糖培养基:Hyclone公司(SH30023.01B);胎牛血清(fetal bovine serum,FBS):BI公司(04-001-1A/B);细胞衰老β-半乳糖苷酶染色试剂盒:碧云天公司(C0602);β-actin:美国proteintech公司(60008-1-Ig);AngⅡ:阿拉丁公司(4474-91-3);CD133一抗:美国Novus公司(NB120-16518);CD34抗体:美国Santa Cruz公司(SC-7324-FITC);CD”133二抗:美国CST公司(14705s);mirVanaTMmiRNA 分离试剂盒:美国Life technologies公司(AM1556);iRNA逆转录试剂盒:美国GeneCopoeia公司(QP014)。
1.4 仪器 超净工作台:北京亚泰(YT-CJ-2NB)公司;低速离心机:知信仪器(SL02)公司;二氧化碳培养箱:上海三藤仪器(DH-160I)公司;立体显微镜:上海光学仪器一厂(XTZ-D/E)公司;台式冷冻离心机:德国eppendorf(TGL-18R);荧光定量RCP仪:美国Thermo(PIKO REAL 96);荧光PCR板:美国Thermo(SPL0960);恒温水浴箱:河南金博(HH-S2)公司;电泳仪:中国Bio-rad(164-5050);转膜仪:北京六一(DYCZ-40A)公司;磁力搅拌器:荣华(a85-1)公司。
1.5 大鼠骨髓源EPCs 的分离、培养 大鼠脱颈处死,浸泡在 75%乙醇里 15 min,移至消毒托盘内,将后肢去皮连同肌肉取下,放至玻璃培养皿内,无菌分离股骨、胫骨,将附着于骨头上的肌肉剔除干净,放至另一玻璃培养皿内,6 mL PBS 清洗3遍,将黏附肌肉清洗干净,剪断一端骨骺端,用注射器抽取 EGM-2 培养基 6 mL,将骨髓冲到离心管内,取大鼠骨髓淋巴细胞分离液 6 mL,使用 1 mL 枪头吸取细胞悬液沿管壁倾斜 45°小心加至淋巴细胞分离液上,注意保持两层间形成明显界面,水平离心 2 000 r/min,离心 20 min。离心后管内分3层,培养基在上层,红细胞、粒细胞以及其他杂质在下层,中层为淋巴细胞分离液,上、中层分界处有一以单个核细胞为主的云雾状薄层,用枪头小心插至云雾层,将此层细胞全部吸入到另一离心管中,并加入10 mL 培养液,轻轻吹打洗涤,1 000 r/min离心10 min。离心后去上清,底部沉淀即为单个核细胞,用培养基轻轻吹打混匀,制成细胞悬液,计数,将细胞悬液按1×106个/mL 浓度移入预先包被细胞纤维连接蛋白(fibronectin,FN)的培养瓶,置37 ℃、5% CO2的饱和湿度培养箱内静置培养,每 3 d换液 1 次。
1.6 EPCs的免疫荧光鉴定 细胞培养到第14天,使用胰蛋白酶对细胞进行消化,1 000 r/min离心5 min,收集细胞悬液,接种于预先放置爬片的培养板中,培养24 h;取出爬片,PBS清洗3次,将爬片用4%多聚甲醛固定30 min;PBS冲洗5 min×3次,5% tritonX-100通透37 ℃30 min;PBS冲洗5 min×3次;5% BSA封闭1 h;孵育一抗,滴加适当的一抗(CD34-FITC、CD133),4 ℃过夜。同样用PBS冲洗5 min×3次,滴加抗兔IgG标记荧光抗体200 L,在37 ℃下孵育90 min;PBS清洗5 min×3次,DAPI染核:DAPI工作液37 ℃孵育10 min;90%甘油封片,到荧光显微镜下观察。
1.7 含药血清制备 SD大鼠40只,适应性喂养1周,随机分为空白血清组和血府逐瘀汤含药血清组,每组20只,血府逐瘀汤含药血清组按14 g/(kg·d),即按70 kg成人体表面积(平均)换算,相当于成人用量的10倍剂量灌胃,空白血清组用等量生理盐水,1次/日,连续7 d。于末次用药后2 h,10%水合氯醛麻醉,腹主动脉取血,于4 ℃静置2 h,1 500 r/min离心15 min,提取上清液为含药血清,经56 ℃水浴中30 min进行灭活,0.22 m过滤器过滤除菌,放置-20 ℃保存备用,需要时用培养液配制成所需浓度的含药血清。
1.8 AngⅡ诱导EPCs 衰老及分组 将EPCs培养至第10天,根据文献资料[6],将细胞培养在100 nmol/L 浓度AngⅡ的培养液中,诱发EPCs的衰老,利用细胞衰老β-半乳糖苷酶染色试剂盒进行染色,验证AngⅡ诱导EPCs衰老是否成功。同时,将上述EPCs随机分为:正常组(不做处理)、模型组(15%对照组大鼠血清+100 nmoL AngⅡ处理)、5%含药血清组(5%含药血清+100 nmoL AngⅡ处理)、10%含药血清组(10%含药血清+100 nmoL AngⅡ处理)、15%含药血清组(15%含药血清+100 nmoL AngⅡ处理)、抑制剂组(miR-34a抑制剂+100 nmoL AngⅡ处理),分别处理24 h、48 h、72 h后收集细胞。
1.9 β-半乳糖苷酶检测EPCs衰老情况 细胞衰老染色试剂盒,以X-gal为底物,在衰老特异性的β-半乳糖苷酶催化下会生成深蓝色产物,从而在光学显微镜下很容易观察到变成蓝色的表达β-半乳糖苷酶的细胞或组织。按该原理定性、定量测定EPCs衰老情况,普通光学显微镜下随机选取每只5个视野观察,计数100个细胞中衰老细胞数目,取其平均数。
1.10 Transwell小室对EPCs迁移能力进行检测 在Transwell小室的下室铺FN,先将EPCs使用无血清及生长因子的培养基进行饥饿培养24 h,去除血清的影响;胰酶消化细胞,用PBS洗一遍,用无血清培养基将EPCs重悬 ,调整密度至1×105个;取200 μL细胞悬液加入上室,下室按分组分别加入空白血清培养基、5%、10%、15%含药血清培养基及miR-34a抑制剂培养基500 μL;常规培养18 h;用棉签将上室内的细胞擦去,将下室的细胞进行DAPI染色,显微镜下计数。
1.11 实时荧光定量PCR(qRT-PCR)法检测miR-34a的表达 提取细胞miRNA:分别干预24 h、48 h、72 h后,按试剂盒说明提取各组细胞的总RNA。逆转录。引物的设计与合成:U6:5′-GCTTCGGCAGCACATATACTAAAAT-3′rno-miR-34a-5p:TGGCAGTGTCTTAGCTGGTTGT。PCR扩增:Template(反转录产物)1 L,Primer A(10 m)0.5 L,Primer B(10 m)0.5 L,PCR H2O 13 L,2X SYBGREEN PCR Master Mix 15 L。上机95 ℃,10 min;95 ℃,15 s;60 ℃,60 s,共40个循环。

2 结 果
2.1 免疫荧光鉴定 荧光显微镜下观察,蓝色为DAPI蓝色染核(见图1),绿色为CD34荧光染色(见图2),红色为CD133荧光染色(见图3),阳性染色为CD34-FITC绿色和CD133红色荧光信号(见图4),阳性染色即为EPCs。

图1 DAPI染核(×400)

图2 CD34荧光染色(×400)
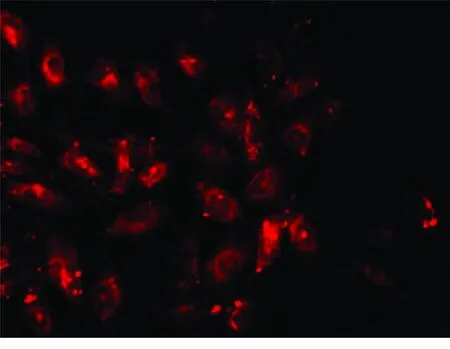
图3 CD133荧光染色(×400)

图4 CD34/CD133双染(×400)
2.2 对EPCs衰老的影响 镜下观察,蓝色即为衰老细胞。干预24 h、48 h、72 h与正常组比较,模型组EPCs衰老数量明显增多(P<0.01);与模型组比较,miR-34a抑制剂组和5%含药血清组、10%含药血清组、15%含药血清组EPCs衰老数量减少(P<0.01);与miR-34a抑制剂组比较,5%含药血清组、10%含药血清组、15%含药血清组EPCs衰老数量明显增多(P<0.01);与5%含药血清组比较,10%含药血清组、15%含药血清组EPCs衰老数量明显减少(P<0.01);与10%含药血清组比较,15%含药血清组的EPCs衰老数量减少(P<0.01)。各组EPCs衰老数量在24 h、48 h、72 h这3个干预时间比较差异无统计学意义(P>0.05)。结果表明,血府逐瘀汤含药血清能延缓EPCs衰老,在3个不同干预时间点比较差异无统计学意义(P>0.05)。详见表1。

表1 各组不同时间EPCs衰老数量比较(±s) 单位: 个
与正常组比较,①P<0.01;与模型组比较,②P<0.01;与miR-34a抑制剂组比较,③P<0.01;与5%含药血清组比较,④P<0.01;与10%含药血清组比较,⑤P<0.01。
2.3 对EPCs迁移功能的影响 与正常组比较,模型组EPCs迁移数量明显减少(P<0.01);与模型组比较,miR-34a抑制剂组、5%含药血清组、10%含药血清组、15%含药血清组EPCs迁移数量明显增多(P<0.01);与miR-34a抑制剂组比较,5%含药血清组、10%含药血清组、15%含药血清组EPCs迁移数量减少(P<0.01);与5%含药血清组比较,10%含药血清组、15%含药血清组EPCs迁移数量明显增多(P<0.01);与10%含药血清组比较,15%含药血清组EPCs迁移数量明显增多(P<0.01)。3个剂量以15%含药血清组对EPCs迁移作用效果最优。详见表2。

表2 各组EPCs迁移数量比较 (±s) 单位:个
与正常组比较,①P<0.01;与模型组比较,②P<0.01;与miR-34a抑制剂组比较,③P<0.01;与5%含药血清组比较,④P<0.01;与10%含药血清组比较,⑤P<0.01。
2.4 对miR-34a表达的影响 与正常组比较,模型组中miR-34a表达量在3个不同干预时间均显著升高(P<0.01);与模型组比较,miR-34a抑制剂组和10%含药血清组、15%含药血清组中miR-34a的表达量在3个不同干预时间均降低(P<0.01),5%含药血清组在干预48 h、72 h显著降低(P<0.01);与miR-34a抑制剂组比较,5%含药血清组、10%含药血清组、15%含药血清组中miR-34a表达量在3个不同干预时间均明显升高(P<0.01);与5%含药血清组比较,10%含药血清组、15%含药血清组miR-34a表达量在3个不同干预时间均明显降低(P<0.01);与10%含药血清组比较,15%含药血清组在干预48 h显著降低(P<0.01);3个浓度中以15%含药血清效果最佳,3组在不同干预时间点间比较多数差异无统计学意义(P>0.05)。详见表3。

表3 各组不同时间EPCs中miR-34a表达水平比较(±s)
与正常组比较,①P<0.01;与模型组比较,②P<0.01;与miR-34a抑制剂组比较,③P<0.01;与5%含药血清组比较,④P<0.01;与10%含药血清组比较,⑤P<0.01;与组内干预24 h比较,⑥P<0.01;与组内干预48 h比较,⑦P<0.05,⑧P<0.01。
3 讨 论
EPCs 是血管内皮细胞的前体细胞,亦称为成血管细胞,正常情况下大多处于休眠状态,在生理或病理因素刺激下能从骨髓动员到外周血、在体内缺血组织中整合形成新生血管的前体细胞。外源EPCs治疗冠心病已从基础研究推广至临床,能明显改善心肌梗死病人和介入手术病人的预后。EPCs具有分化、迁移、血管新生、修复功能,在冠心病的发生、发展中扮演着重要角色[7]。冠心病病人循环血中EPCs的数量下降了近50%,黏附、迁移能力受损,经过跟踪随访,EPCs数量及功能下降病人的预后更差[8]。大部分正常细胞在尽其有限的分裂后,衰老现象也会接踵而来,衰老虽然并不意味着细胞的死亡,但它的蛋白以及基因的表达谱可能翻天覆地改变,以至于在遇到刺激后不能再分裂。老龄、吸烟、动脉粥样硬化、高血糖等冠心病危险因素均可引起EPCs衰老,EPCs的衰老会使其增殖和功能受到影响,而冠心病病人多伴有以上危险因素,与EPCs衰老互为因果,形成恶性循环,阻碍血管新生,逐渐引起心血管领域学者的关注。
miR-34a属于miR-34家族,其生物学功能主要有细胞周期阻滞、促进细胞衰老及诱导细胞凋亡、组织细胞迁移[9]。自miR-34a被发现就一直因其对各类细胞的衰老、凋亡增殖作用而备受关注[10],许多细胞凋亡及衰老的研究就是以此作为突破点逐渐明确了某些疾病的发生机制及药物的作用机制[11]。有研究发现细胞转染miR-34a后,诱发细胞衰老[12-13]。
本课题组前期研究已证实,血府逐瘀汤可上调血管内皮生长因子(VEGF)、碱性成纤维细胞生长因子(bFGF)等血管新生因子的表达,促进心肌缺血区的血管新生[14-15]。本实验通过原代培养大鼠骨髓源内皮祖细胞,使用AngⅡ诱导其衰老,观察血府逐瘀汤对AngⅡ诱导的大鼠骨髓源内皮祖细胞、迁移功能及miR-34a表达的影响,结果表明:血府逐瘀汤能减轻内皮祖细胞的衰老,其机制可能与改善EPCs的迁移功能、下调miR-34a的表达有关。

