芪参益气滴丸含药血清抑制血管平滑肌细胞增殖作用的实验研究
张新颖
(天津市第四中心医院中医科,天津 300241)
中药复方研究注重中药作用整体性,往往局限于临床研究及动物实验研究[1]。有研究显示,直接应用中药复方作用于实验细胞后,细胞出现大量死亡现象。另有学者认为,中药在临床应用过程中常以复方形式治疗疾病,复方经过人体的消化与吸收后发挥药效可能不同于中药单一的作用效果。目前,中药血清药理学与血清药理化学的研究[2]及两者的相结合成为最新的研究热点,为中药复方研究及发展提供了新的研究方向[3]。本实验中提取中药复方含药血清作用于细胞实验中,探索细胞研究中的方法及应用,旨在为研究者开展血清药理学研究提供相应的理论与方法支持。
1 材料与方法
1.1 实验动物 雄性SD 大鼠11 只,体重180~220 g,6~8 周龄,由北京军事医学科学院实验动物中心提供,符合动物伦理要求。
1.2 试剂及仪器 芪参益气滴丸(天津天士力制药集团股份有限公司生产)、生理盐水、CCK8(日本同仁)、DMEM 培养基(Gibco 公司)、胎牛血清(FBS 兰州百灵优级血清)、倒置相差显微镜、二氧化碳恒温培养箱(IL-161HI)、酶标仪(flexstation3)、离心机(LD5-2A)。
1.3 大鼠血管平滑肌细胞(VSMC)体外培养 SD 大鼠提取原代细胞:3%的水合氯醛腹腔麻醉,打开胸腔,用眼科剪及眼科镊迅速分离出胸主动脉,放入无菌加入1%双抗的PBS 中。采用高糖DMEM 培养基培养,其中含有20%的FBS,1%双抗,细胞在37 ℃、5%CO2、饱和湿度条件下培养,1 周后观察细胞生长情况;若贴壁良好,观察到细胞已经从组织块爬出,可更换细胞培养液,待细胞生长至80%~90%融合时,进行首次传代[4];每3 天传代1 次,传至第3 代更换为含10%胎牛血清DMEM 培养基培养,并经血管平滑肌肌动蛋白(α-actin)免疫组织化学鉴定[5,6]。倒置显微镜直接观察细胞形态并拍照。
1.4 芪参益气滴丸含药血清制备 首先将大鼠进行标号,应用随机数字表法进行分组,分为含药血清组6 只,正常血清组5 只,含药血清组给予大鼠芪参益气滴丸,按0.135 g/(kg·d)灌胃(按照鼠与人体的每千克体重剂量折算系数6.25 计算)[7],每只大鼠2 ml/(次·d)灌胃,正常血清组灌服等体积生理盐水,连续灌胃5 d,末次给药2 次,中间间隔1 h。最后给药后1 h,10%水合氯醛(0.3 ml/100 g)腹腔麻醉、固定、消毒[8],无菌手术剪打开腹腔,分离腹主动脉。使用0.2 mm 血样采集针迎血流方向插入腹主动脉,将血接入不抗凝管中。室温下静置3~4 h,3000 r/min,离心15 min,无菌分离血清,同组血清混合,用0.22 μm微孔滤膜过滤,置于无菌离心管中,-20 ℃保存备用,使用之前经56 ℃水浴灭活30 min[9]。
1.5 CCK8 测定芪参益气滴丸含药血清对VSMC 增殖的影响
1.5.1 芪参益气滴丸含药血清对VSMC 影响 取3~8代对数生长期细胞,按照3000 个/孔密度种板。分为1%双抗的DMEM 培养液同步化组和非同步化组,每组分别再分为5%正常血清组、10%正常血清组、20%正常血清组、5%含药血清组、10%含药血清组、20%含药血清组,每组4 个复孔。细胞于37 ℃、5%CO2、饱和湿度条件下分别培养为24 h 后,加入预混均匀的100 μl 新鲜无血清培养基和10 μl 的CCK8溶液,将培养板在培养箱内孵育2 h,450 nm 处酶标仪检测其吸光度(OD 值)[10]。
1.5.2 芪参益气滴丸对VSMC 增殖的影响 取3~8代对数生长期细胞,按照3000 个/孔密度种板。用含有1%的FBS,1%双抗的DMEM 培养液同步化24 h,设定5 个浓度,即正常血清组:1%正常血清组、3%正常血清组、5%正常血清组、10%正常血清组、20%正常血清组。含药血清组:1%含药血清组、3%含药血清组、5%含药血清组、10%含药血清组、20%含药血清组,每组4 个复孔。细胞于37 ℃、5%CO2、饱和湿度条件培养,分别在血清作用6、12、24、48、72 h取样,用酶标仪在450 nm 波长处测定各组细胞的吸光度。检测时,用移液器吸弃待测孔培养基,并加入预混均匀的100 μl 新鲜无血清培养基和10 μl的CCK8 溶液,将培养板在培养箱内孵育2 h,450 nm处酶标仪检测其吸光度[10]。
1.6 统计学方法 数据采用SPSS 19.0 统计软件进行分析,对所测结果进行正态性及方差齐检验,所有符合正态分布的计量资料以()表示,组间比较采用单因素方差分析,若方差齐用LSD 检验,方差不齐采用Dunnett’T3 检验,P≤0.05 认为差异有统计学意义,P<0.01 表示统计学意义显著,P<0.001 表示统计学意义极显著。
2 结果
2.1 细胞鉴定结果 细胞培养2 周后呈放射性生长,细胞已经融合,部分地区高低起伏呈“峰-谷”生长,细胞形态多样,可见细胞呈梭形、多角形、不规则形等(图1A),符合平滑肌细胞峰-谷生长特点;经高内涵检测细胞形态多为梭形和菱形,符合VSMC 形态。同时细胞浆中α-actin 蛋白高度表达,呈阳性,显示所得细胞为纯度较高的VSMC(图1B)。
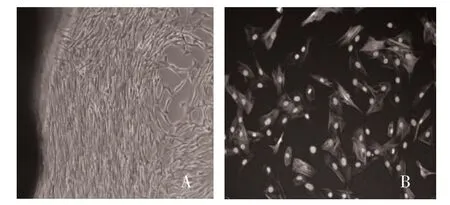
图1 细胞鉴定结果
2.2 同步化组与非同步化组对平滑肌细胞增殖影响同步化组与未经同步化组比较,同步化组细胞增殖稳定,误差较小;经24 h 含药血清作用,5%含药血清、10%含药血清、20%含药血清均能抑制平滑肌细胞增殖,且10%含药血清抑制更明显,20%含药血清抑制相对较差,见表1、图2。
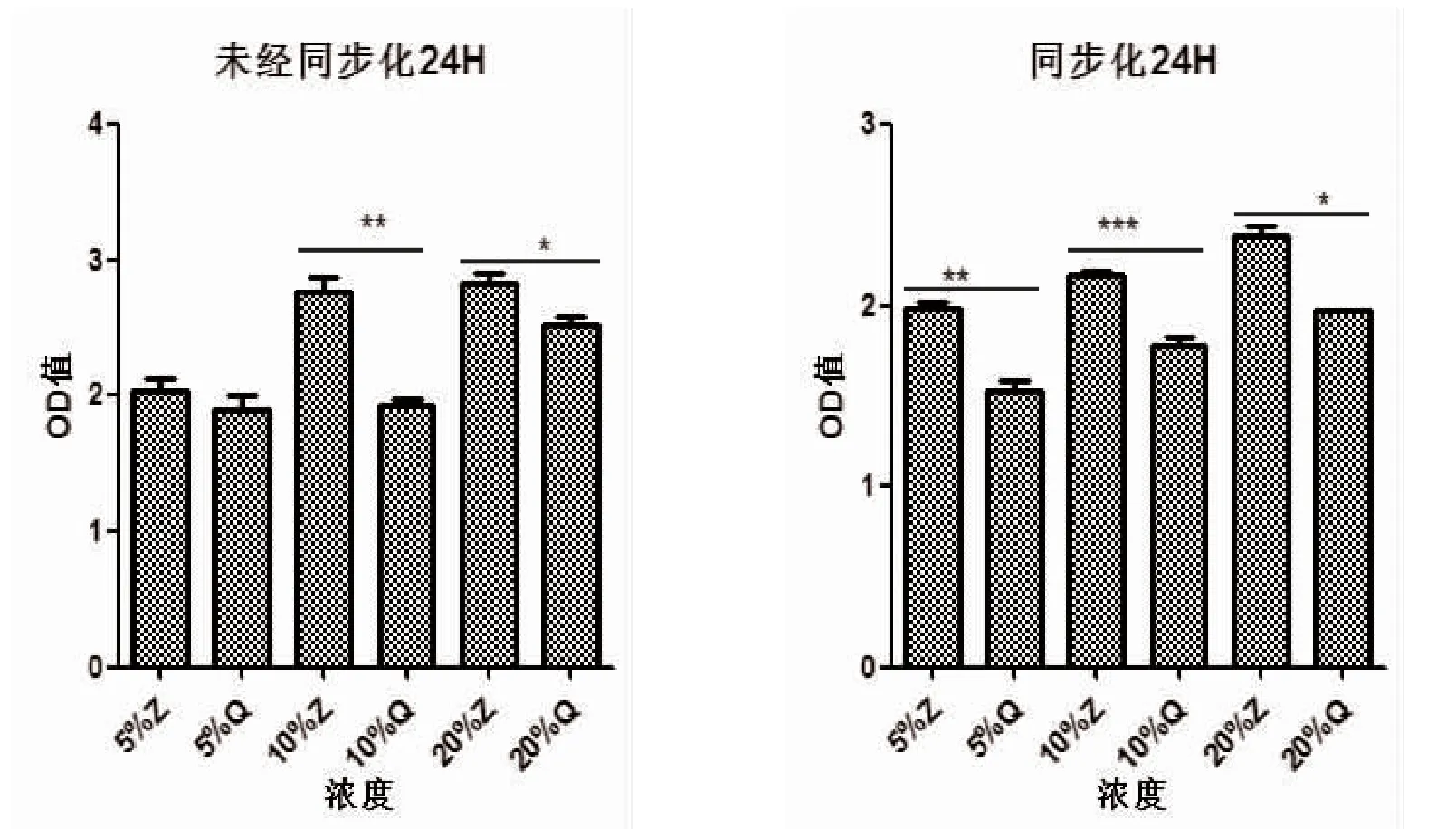
图2 两组不同浓度含药血清对细胞增殖作用比较
表1 同步化与未同步化组含药血清OD 值比较()

表1 同步化与未同步化组含药血清OD 值比较()
注:Z 表示正常血清组,Q 表示含药血清组;*P<0.05,**P<0.01,***P<0.001
2.3 不同浓度梯度及作用时间对VSMC 抑制作用1%含药血清组与1%正常血清组不同时间点OD 值比较,差异无统计学意义(P>0.05);作用于VSMC 6、12 h 后,不同浓度含药血清组与正常血清组OD 值比较,差异无统计学意义(P>0.05);作用于VSMC 24 h后,5%含药血清组OD 值低于与5%正常血清组(P<0.01),10%含药血清组OD 值低于10%正常血清组(P<0.001);作用于VSMC 48 h 后,10%、20%含药血清组OD 值低于正常血清组(P<0.05);5%含药血清OD 值低于5%正常血清组(P<0.001);72 h 后不同浓度梯度均出现较其他时间点下降趋势,3%、10%含药血清组OD 值分别低于同浓度正常血清组(P<0.05),5%含药血清OD 值低于5%正常血清组(P<0.001),见表2、图3。

图3 不同浓度含药血清在不同时间对细胞增殖作用曲线
表2 不同浓度含药血清在不同时间OD 值比较()

表2 不同浓度含药血清在不同时间OD 值比较()
注:Z 表示正常血清组,Q 表示含药血清组;24 h,5%Q 与5%Z 比较,P<0.01,10%Q 与10%Z 比较,P<0.001;48h,10%Q 与10%Z 比较,20%Q与20%Z 比较,P<0.05,5%Q 与5%Z 比较,P<0.001;72 h,3%Q 与3%Z 比较、10%Q 与10%Z 比较,P<0.05,5%Q 与5%Z 比较,P<0.01
3 讨论
中药成分复杂多样,药物进入人体,经代谢后产生的新的化合物更是复杂多样,且难以探究[11]。血清药理学通过给动物灌胃药物,取其血清作为药物源进行药理学观察,并进行药理实验,比较接近药物体内环境中产生药理作用的真实过程,能够很好的进行中药药效观察与研究[12]。提取的含药血清进行体外实验,能够防止中药粗制剂理化性质干扰,同时能够反映出中药经胃肠道消化吸收后,经生物转化,产生的药理效应[13]。现随着科学技术提高和新技术的应用,中药的单体成分成功分离,导致中药整体性被割裂[14];传统口服给药形式,使中药只有被消化道吸收进入体内,才能发挥中药活性,一部分是中药本身活性,一部分是中药进入人体产生代谢产物发挥的活性[15]。本实验通过灌胃芪参益气滴丸提取动物血清,并将其作用同源动物的平滑肌细胞,通过对血管平滑肌的作用,观察不同浓度的芪参益气滴丸含药血清对VSMC 的作用。
本研究结果显示,经同步化后正常血清组及含药血清组随浓度升高,细胞增殖及药效作用较未同步化稳定;经同步化更有利于结果可靠性;同步化的对照组与含药血清组比较,含药血清抑制能够对平滑肌细胞增殖,但不随浓度增加而增强;24 h 后10%含药血清组较10%正常血清组药效作用最强,48 h 后5%含药血清较5%正常血清组药效作用最强,说明在进行含药血清对平滑肌增殖实验时,并不是含药血清浓度越高,药效作用越大;芪参益气滴丸含药血清抑制血管平滑肌作用较短时间与正常血清组无明显差异,低浓度作用时间越长,药效作用越明显;高浓度同样短时间与正常血清组无差异,而作用时间越长,其药效的抑制作用并不会增强,考虑可能与除药物经代谢后的产生的化合物外,血清本身含有的生长因子有关。目前研究制备含药血清给药方法多样化,为使药物能够达到稳态需要浓度,现在主要采用每天灌胃1 次,连续给药7~10 d[8]及连续3次给药法[16],最后1 次灌胃后间隔1~2 h 取血的方法。本实验采用连续给药5 d,最后1 d 为保证药物浓度稳态加强给药,能够达到实验要求,提取后经体外实验药效作用验证,芪参益气含药血清能够抑制血管平滑肌增殖,并与含药血清浓度及作用时间密切相关,与既往研究一致[17]。
综上所述,在血清药理研究中,对于含药血清的提取必须经过合理的灌胃方法,以保证其含药物质的有效性,并通过细胞实验来明确其作用效果。在血清药理学研究中,含药血清中本身含有细胞增值所需要的营养物质,对于研究药物抑制增值相关实验时须经过细胞同步化过程,以更加准确的判断含药血清对细胞增殖的抑制作用。同时,含药血清抑制作用并不依赖含药血清的浓度,并非浓度越高抑制作用越强,其主要原因是由于增加含药血清浓度的同时增加血清中营养物质导致,故在研究含药血清抑制相关细胞增势的细胞实验时,须探索出最佳作用浓度,以确保含药血清抑制作用最强。因此,在血清药理学实验中,含药血清提取、同步化过程、含药血清浓度均是决定细胞实验成功与否的条件。

