茉莉酸抑制剂对马铃薯离体块茎形成和发育的影响
崔丹丹,杨巧玲,张俊莲,张峰
(1.甘肃农业大学生命科学技术学院,甘肃 兰州 730070;2.甘肃省干旱生境作物学重点实验室,甘肃 兰州 730070;3.甘肃农业大学园艺学院,甘肃 兰州 730070)
激素在植物生长发育过程中发挥着重要的调控作用[1].茉莉酸及其活性衍生物统称为茉莉酸类物质(jasmonates,JAs),是广泛存在于植物中一类重要植物激素,不仅参与调控植物生根、抑制种子萌发、加速细胞分裂、促进衰老等生长发育过程[2-6],还调节植物对病原菌侵害、干旱胁迫、盐胁迫和机械损伤等胁迫响应[7].茉莉酸类物质的合成主要包括三个阶段,分别在不同的亚细胞结构中完成,从不饱和脂肪酸到12-氧-植物二烯酸(12-oxo-phytodienoic acid,OPDA)的合成是在叶绿体中进行,从 OPDA到JA的转化是在过氧化物酶体中进,进一步的修饰则在细胞质中进行[8-9].
马铃薯块茎形成和发育过程分为匍匐茎诱导和发生、匍匐茎伸长生长、匍匐茎纵向生长停止、块茎发生及膨大等四个阶段[10],受多种植物激素调控.研究表明,JA可以促进马铃薯块茎细胞的分裂和膨大,有利于块茎形成和发育[11-12].脂氧合酶(lipoxygenase,LOX)是JA生物合成过程的关键酶,参与早期马铃薯块茎膨大[13].外源施加JA生物合成抑制剂水杨苷羟肟酸(salicylhydroxamic acid,SHAM)会抑制LOX活性,当LOX活性受到抑制时,使内源JA合成受阻,从而抑制马铃薯块茎形成和发育[14-16].使用浓度为10 μmol/L的JA处理马铃薯试管苗单节茎段,结薯率几乎接近100%[17];单独施加SHAM时,马铃薯块茎形成受阻,单薯鲜质量减小[18].块茎生育期内淀粉含量与其它糖类物质含量都影响马铃薯块茎形成[19].外源施加JA后,马铃薯离体块茎淀粉、还原糖和可溶性糖含量均显著增加[20].本研究选取马铃薯试管苗诱导的匍匐茎为材料,通过对匍匐茎施加不同浓度JA生物合成抑制剂SHAM,分析抑制剂作用下的JA对马铃薯离体块茎诱导的影响,为深入研究JA对马铃薯块茎形成和发育过程中的调控机理提供理论依据.
1 材料与方法
1.1 试验材料
马铃薯(SolanumtuberosumL.)普通栽培品种“大西洋”试管苗(由甘肃省作物遗传改良与种质创新重点实验室提供)为供试材料.
1.2 材料培养
将试管苗接种到MS液体培养基中,培养温度(22±1)℃,光照时间16 h/d,光照强度2 000 lx,30 d后转入含1.5 g/L活性炭的MS液体诱导培养基中,黑暗培养产生匍匐茎.将生理状态一致的匍匐茎接入含有不同浓度SHAM改良后的1/10 MS液体培养基[21],同时筛选出匍匐茎膨大完全抑制时的抑制剂浓度,与5 μmol/L JA共同处理匍匐茎,对照CK为不加JA及其生物合成抑制剂,每个处理5次重复.培养40 d后,收集诱导形成的离体块茎,液氮速冻,-80 ℃保存.
1.3 试验方法
1.3.1 马铃薯块茎形态观察与生物量测定 离体诱导培养40 d后,统计不同浓度JA生物合成抑制剂SHAM处理下匍匐茎结薯率,称量块茎鲜质量,用游标卡尺测量块茎直径,称量块茎鲜质量后在80 ℃下烘干至恒质量,并记录块茎干质量.
1.3.2 马铃薯块茎LOX活性测定 LOX活性测定采取Sakai和Zhao的方法[20],具体如下:反应底物制备:酶反应底物由2 mL 0.1 mol/L Na2HPO4(pH 9.0)缓冲液、0.1 mL Tween-20溶液和0.1 mL亚油酸(C18H32O2)溶液充分混匀,用0.5 mol/L NaOH滴定至溶液澄清,定容至25 mL.粗酶液提取:称取 0.5 g马铃薯块茎,加入2.5 mL 0.1 mol/L Tris-HCl缓冲液(1% PVP(W/V),1 mmol/L CaCl2,5 mmol/L DTT,10%(V/V)甘油,pH 8.0).冰上研磨至匀浆,4℃,12 000g离心15 min,重复2次,合并上清备用.(3)酶活性测定:加入0.2 mL酶反应底物、2.8 mL 0.1 mol/L Na2HPO4缓冲液(pH 9.0)和酶提取液50 μL组成酶反应混合液,反应温度为30 ℃,加酶液后分别在15 s和75 s后记录234 nm下吸光值.
1.3.3 碳水化合物含量的测定 淀粉含量测定根据Nelson方法[21]稍加改进.称取0.5 g马铃薯块茎,加入4 mL 80%乙醇研磨至匀浆,沸水浴10 min,4 ℃,12 000g离心15 min,弃上清.向沉淀中加入2 mL蒸馏水,沸水中进行10 min糊化反应,冷却后加入5 mL 35% HClO4溶液搅拌15 min,蒸馏水定容至25 mL,过滤后溶液补足为100 mL测定吸光值.
葡萄糖、蔗糖和果糖含量的测定参照Guimberteau和Halhoul方法[22]稍加改进:称0.1 g马铃薯块茎,加入1 mL蒸馏水,研磨至匀浆,转入离心管,加入2 mL蒸馏水,25 ℃,6 000g离心5 min,吸取上清2 mL,加入2 mL蒸馏水,重复三次,收集6 mL上清液定容至10 mL.果糖含量测定:取1 mL上清液,加入3 mL蒽酮,25 ℃常温显色5 min,640 nm波长下测吸光值.蔗糖含量测定:取2 mL上清液,加入1 mL KOH,水浴10 min,水浴冷却后取1 mL,加3 mL蒽酮,水浴5 min,冷却后,640 nm波长下测吸光值.葡萄糖含量测定:取1 mL上清液,加入3 mL蒽酮,沸水浴5 min,冷却后,640 nm波长下测吸光值.
1.4 数据分析

2 结果与分析
2.1 水杨苷羟肟酸(SHAM)处理后马铃薯离体块茎形态变化
不同浓度SHAM(0、100、200、300、400、500、600、700、800、900、1 000、1 200、1 300、1 400、1 500、1 800、1 900、2 000、2 100、2 200、2 300、2 400 μmol/L)处理马铃薯匍匐茎,培养40 d后形成的块茎形态差异显著(图1 A).随着SHAM浓度增加,匍匐茎结薯率呈现逐渐下降的趋势.当SHAM浓度为300 μmol/L、900 μmol/L和1 800 μmol/L时,结薯率下降较为显著,分别比对照下降了12.11%、29.61%和85.3%;当SHAM浓度达到2 400 μmol/L时,匍匐茎不再发生膨大形成块茎(图1-B).随着SHAM浓度增加,块茎直径逐渐减小.当SHAM浓度为600、1 500、1 800、2 100 μmol/L时,块茎直径显著下降,分别比对照降低了15.54%、37.82%、43.62%和54.41%(图1-C).同样,块茎鲜质量也随着SHAM浓度的增加逐渐下降.当SHAM浓度在100~400 μmol/L范围内时,块茎鲜质量急剧下降,而在400~2 000 μmol/L的浓度范围内,块茎鲜质量下降趋势逐渐变缓,其中在SHAM浓度为1 500 μmol/L和2 100 μmol/L时,块茎鲜质量分别比对照下降了62.68%和74.29%(图1-D).块茎干质量也随着SHAM浓度的增加逐渐下降.当SHAM浓度在100~400 μmol/L范围内时,块茎干质量急剧下降,当SHAM浓度在500~1 300 μmol/L范围内时,块茎干质量下降趋势逐渐变缓,其中在SHAM浓度为400 μmol/L时,块茎干质量比对照下降了37.57%(图1-E).
2.2 水杨苷羟肟酸(SHAM)处理的马铃薯离体块茎脂氧合酶活性变化
LOX是JA合成过程中的第一个关键酶,其活性影响着JA的生物合成积累,进而影响着块茎的形成和发育.结果表明,随着SHAM浓度的增加,LOX活性整体呈现降低趋势.在SHAM浓度为600 μmol/L时,LOX活性最高,比对照增加了4.23%.在SHAM浓度为2 400 μmol/L时,LOX活性最低,比对照降低了88.12%(图2).
2.3 水杨苷羟肟酸(SHAM)处理的马铃薯离体块茎碳水化合物含量变化
块茎中葡萄糖、果糖和蔗糖含量均呈现先增加后减少的变化趋势.在SHAM浓度介于100~900 μmol/L范围时,随着SHAM 浓度的增加,葡萄糖含量逐渐降低,浓度为900 μmol/L时最低(0.08 mg/g),比对照减少了97.1%;在SHAM浓度介于900~2 400 μmol/L浓度时,随着SHAM 浓度的增加,葡萄糖含量逐渐增加,在2 400 μmol/L时含量最高(8.81 mg/g),比对照增加了2.1倍(图3-A).果糖含量在SHAM浓度介于100~600 μmol/L内时,随着SHAM 浓度增加葡萄糖含量逐渐降低,在600 μmol/L时含量最低(4.00 mg/g),比对照减少了87.5%;在SHAM浓度介于600~2 400 μmol/L时,随着SHAM 浓度增加果糖含量逐渐增加,在2 400 μmol/L时含量最高(33.27 mg/g),与对照相比增加了0.33倍(图3-B).蔗糖含量在SHAM浓度介于900~2 400 μmol/L时,随着SHAM 浓度的增加蔗糖含量逐渐增加,在2 400 μmol/L时含量最高(20.8 mg/g),与对照相比增加了10倍(图3-C).离体块茎淀粉含量与糖含量的变化趋势相反,淀粉含量在SHAM浓度为1 200 μmol/L最多(40.78 mg/g),比对照增加了24.43%;在SHAM浓度为2 400 μmol/L时,块茎淀粉含量最低(9.51 mg/g),比对照减少了76.67%(图3-D).
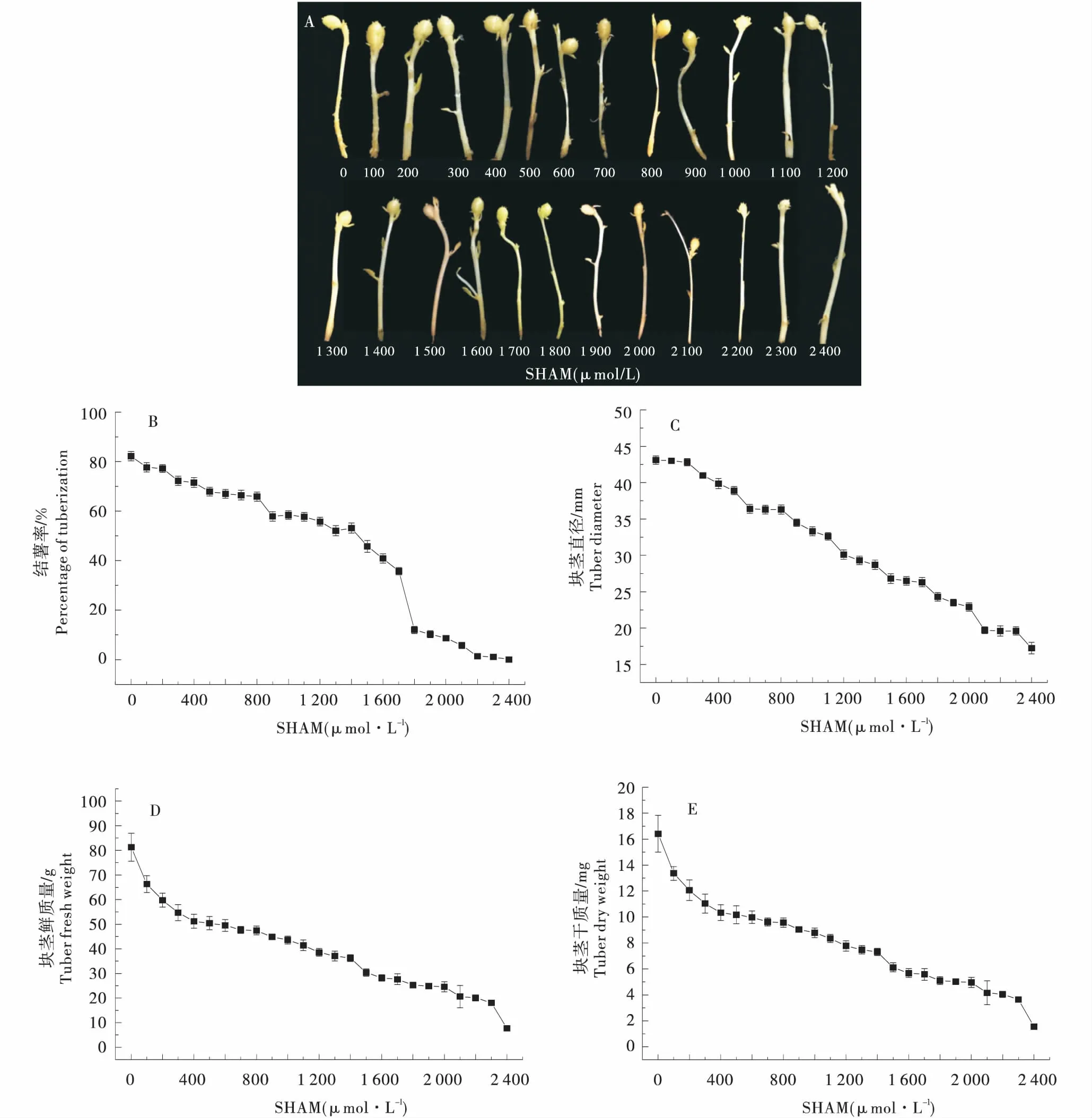
A:块茎表型;B:匍匐茎结薯率;C:块茎直径;D:块茎鲜质量;E:块茎干质量.A:Tuber morphology;B:Percentage of tuberization;C:Tuber diameter;D:Tuber fresh weight;E:Tuber dry weight.图1 不同浓度SHAM处理对马铃薯离体块茎形成的影响Figure 1 Effect of SHAM on potato tuber formation in vitro
2.4 JA、SHAM和JA+SHAM处理对马铃薯离体块茎形态特征的影响
单独施加5 μmol/L JA处理匍匐茎时,匍匐茎结薯率、块茎直径、鲜质量和干质量均显著增加,比对照分别增加了6.96%、26.21%、42.83%和42.53%.单独施加2 400 μmol/L SHAM处理匍匐茎时,匍匐茎不膨大形成块茎.5 μmol/L JA+2 400 μmol/L SHAM共同处理下,匍匐茎仍然不膨大形成块茎.
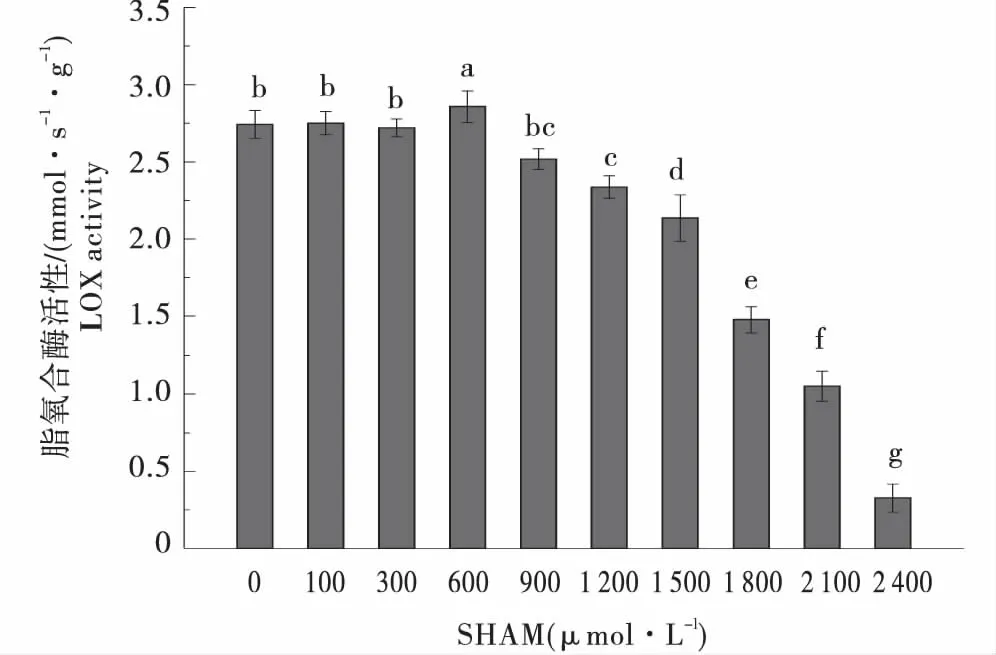
图2 不同浓度SHAM处理下马铃薯离体块茎的LOX活性变化Figure 2 The LOX activity changes of tubers under different SHAM concentration treatment in vitro
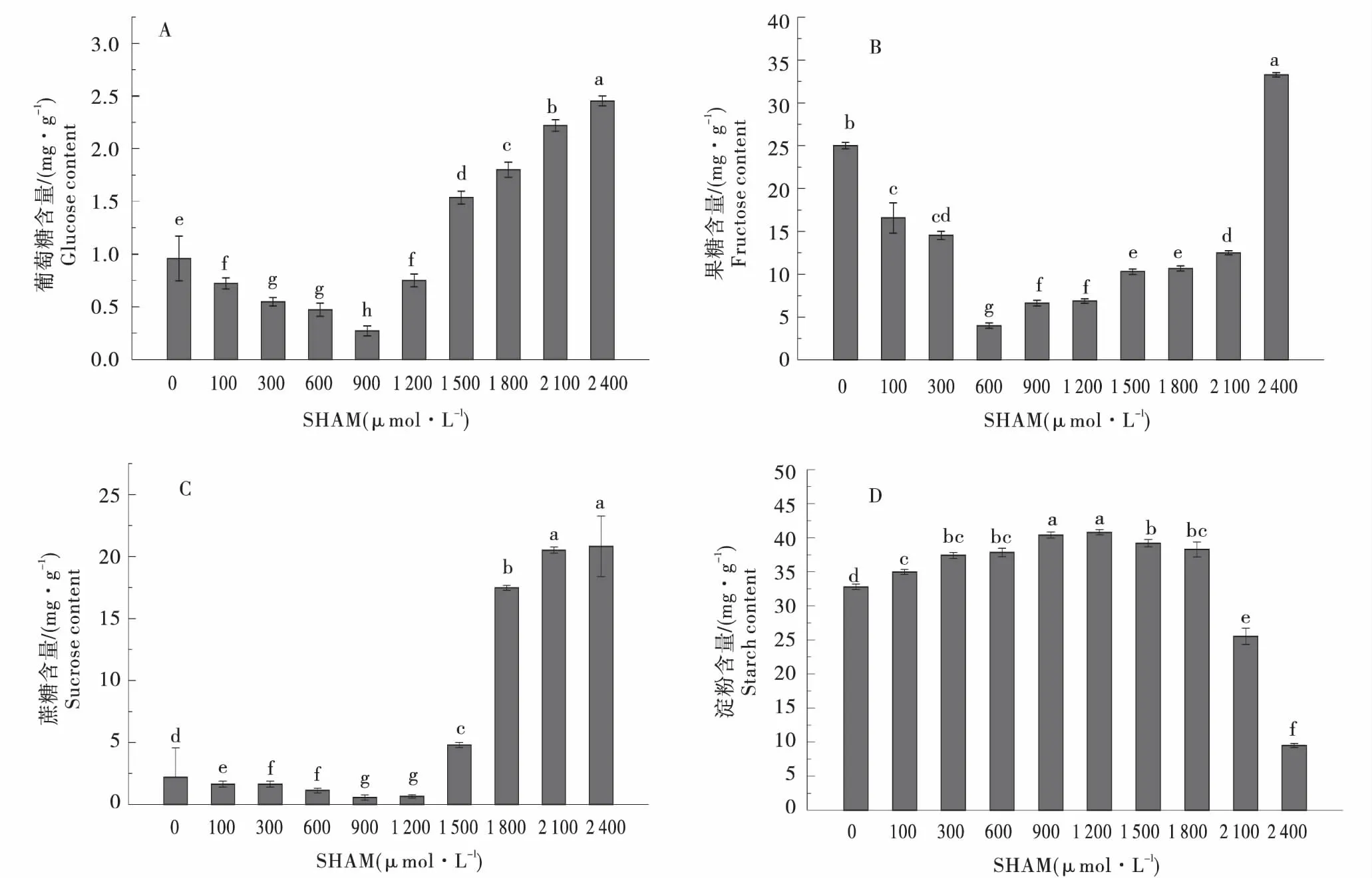
A:葡萄糖含量;B:果糖含量;C:蔗糖含量;D:淀粉含量.A:Glucose content;B: Fructose content;C:Sucrose content;D:Starch content.图3 不同浓度SHAM处理下马铃薯离体块茎碳水化合物含量变化Figure 3 The carbohydrate content changes of tubers under different SHAM concentration treatment in vitro
2.5 JA、SHAM和JA+SHAM处理对马铃薯离体块茎LOX活性的影响
由于单独施加2 400 μmol/L SHAM和5 μmol/L JA+2 400 μmol/L SHAM共同处理匍匐茎时,匍匐茎均不膨大形成块茎,此时测定匍匐茎中LOX活性.5 μmol/L JA单独处理比对照LOX活性无显著变化,2 400 μmol/L SHAM和5 μmol/L JA+2 400 μmol/L SHAM处理后,LOX活性显著降低,比对照分别降低了87.95%和89.12%(图5).
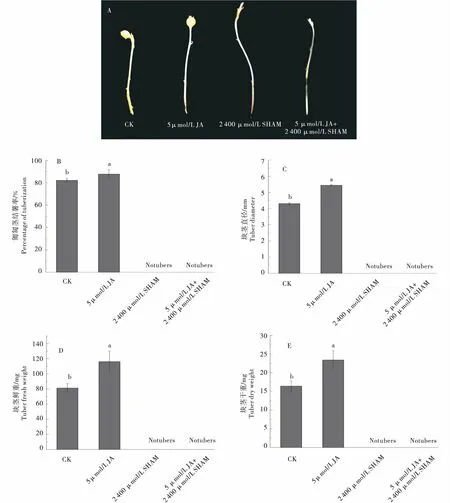
A:块茎表型;B:匍匐茎结薯率;C:块茎直径;D:块茎鲜质量;E:块茎干质量.A:Tuber morphology;B:Percentage of tuberization;C:Tuber diameter;D:Tuber fresh weight;E:Tuber dry weight.图4 JA、SHAM和JA+SHAM处理对马铃薯离体块茎形成的影响Figure 4 Effect of JA,SHAM and JA+SHAM on potato tuber formation in vitro
2.6 JA、SHAM和JA+SHAM处理对马铃薯离体块茎碳水化合物含量的影响
单独施加外源5 μmol/L JA,块茎内葡萄糖和果糖含量显著减少,比对照分别减少了25.74%和38.41%,蔗糖含量和淀粉含量无明显变化.由于单独施加2 400 μmol/L SHAM和5 μmol/L JA+2 400 μmol/L SHAM共同处理匍匐茎时,匍匐茎均不膨大形成块茎,此时测定匍匐茎中葡萄糖、果糖、蔗糖和淀粉含量.2 400 μmol/L SHAM单独处理匍匐茎时,匍匐茎中葡萄糖、果糖和蔗糖含量均显著增加,比对照分别增加了1.6倍、0.18倍和0.47倍;匍匐茎中淀粉含量显著降低,比对照降低了72.93%.5 μmol/L JA+2 400 μmol/L SHAM共同处理匍匐茎时,匍匐茎中葡萄糖、果糖和蔗糖含量均显著增加,比对照分别增加了177.37%、26.65%和51.13%;匍匐茎中淀粉含量显著降低,比对照降低了73.30%(图6).
3 讨论
JA对马铃薯块茎的形成和发育有重要调控作用.马铃薯块茎开始形成时,JA可以促进匍匐茎顶端膨大形成块茎,块茎鲜质量增加[23].本研究表明,外源添加JA使块茎体积膨大和单薯鲜质量增加.
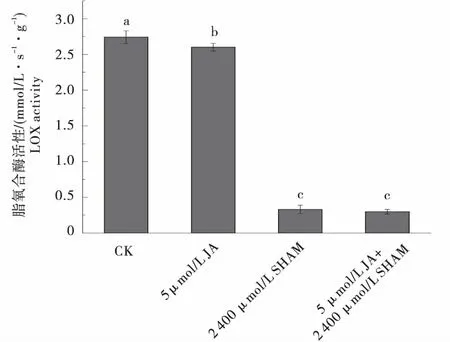
图5 JA、SHAM和JA+SHAM处理下马铃薯离体块茎或匍匐茎中LOX活性变化Figure 5 The LOX activity changes of tubers or stolons under JA,SHAM and JA+SHAM treatment in vitro
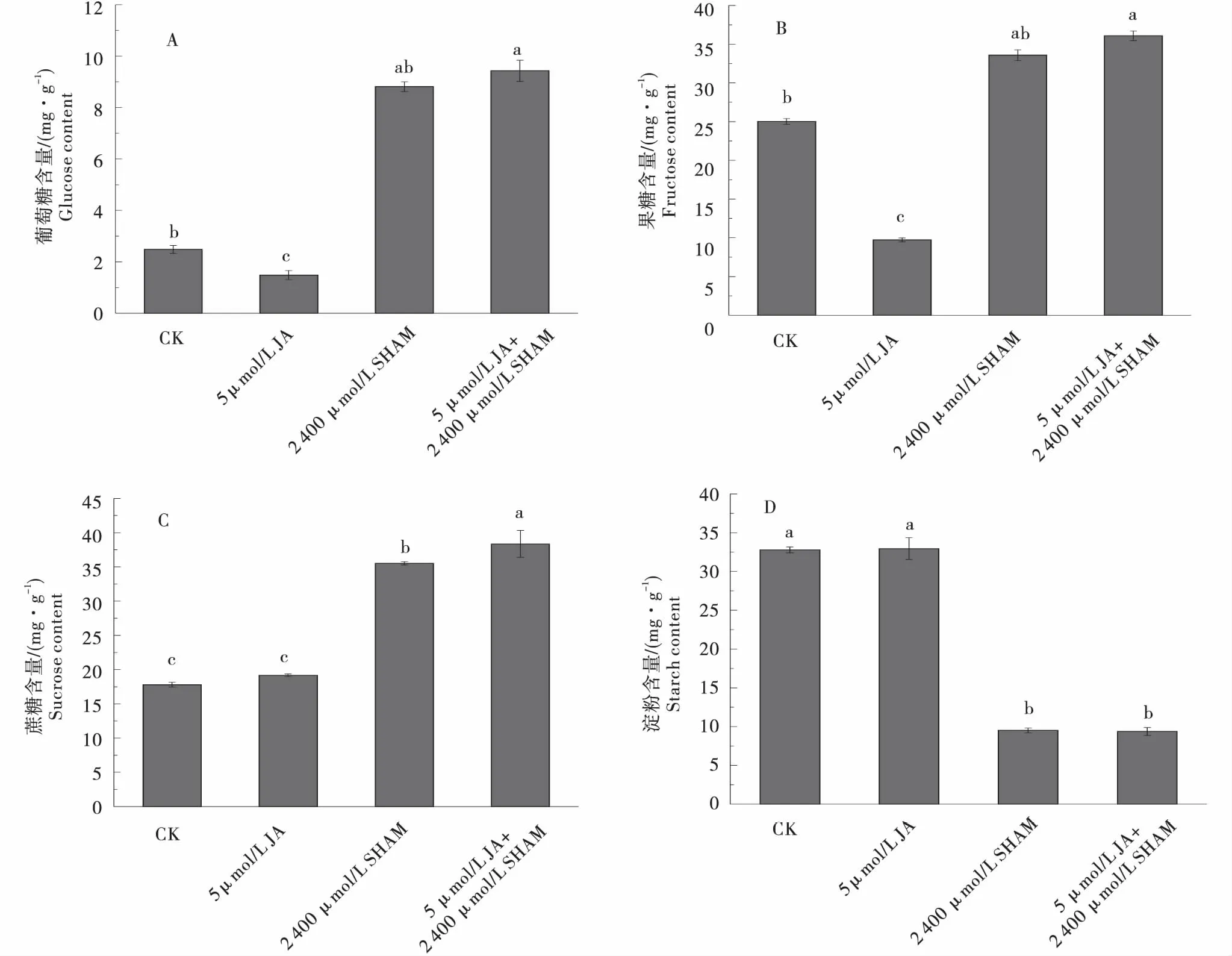
A:葡萄糖含量;B:果糖含量;C:蔗糖含量;D:淀粉含量.A:Glucose content;B:Fructose content;C:Sucrose content;D:Starch content.图6 JA、SHAM和JA+SHAM处理下马铃薯离体块茎或匍匐茎中碳水化合物含量变化Figure 6 The carbohydrate content changes of tubers or stolons under JA,SHAM and JA+SHAM treatment in vitro
随着SHAM浓度增加,匍匐茎膨大体积减小,块茎鲜干质量、直径和匍匐茎结薯率显著降低,说明SHAM能抑制JA对块茎形成发育的促进作用,当SHAM浓度超过2 400μmol/L时,对JA的合成抑制达不到马铃薯块茎形成所需要的JA含量,导致块茎不能正常形成;或过高浓度SHAM完全抑制了内源JA的产生后,破坏了内源JA与其他植物激素的动态平衡状态[24].
LOX在马铃薯块茎发育中发挥着重要的作用.由于LOX是JA生物合成途径中第一个重要的关键酶,当LOX的活性被抑制时块茎形成受阻、块茎体积变小以及块茎产量减少[25].SHAM通过抑制LOX的活性,阻碍JA的生物合成,影响块茎的形成[26].本试验JA处理后的马铃薯块茎中LOX活性显著降低,表明外源JA的添加会负反馈于内源JA的合成,结果和LOX的活性与JA的积累成负相关的结果一致[27].当施加的合成抑制剂达到一定浓度时,LOX的活性完全被抑制,中间产物OPDA无法合成,不能产生JA及其衍生物,即使外源添加JA,也无法恢复JA的合成机制调节块茎的生长发育;SHAM浓度达到阈值,植物激素调节的生长机制受到破坏,外源添加的JA无法运输到匍匐茎顶端和其他激素共同调节匍匐茎膨大形成块茎,这与前人研究发现的SHAM除了抑制JA的生物合成外,还会影响与其他植物激素(如生长素)的协同作用相符合[28].
JA与马铃薯离体块茎中的碳水化合物的代谢有紧密的关系[29].外源JA通过促进细胞内糖的合成而控制细胞的膨大[30],淀粉是马铃薯块茎的主要成分,匍匐茎顶端开始膨大时淀粉开始积累,JA促进细胞内淀粉颗粒的增多增大,马铃薯块茎膨大[31-32],本试验中,JA处理后马铃薯离体块茎碳水化合物合成与CK相比增加,与前人研究相符合.JA能促进块茎的形成,SHAM在一定浓度范围内则通过调节LOX活性而抑制JA对块茎形成的促进作用,从而导致淀粉含量的积累增加,超过一定浓度时,淀粉合成受阻,块茎无法形成[33-34],JA和SHAM共同处理下,块茎淀粉含量呈现出先增加后降低的正态分布趋势,与其相符合.在马铃薯块茎发育过程中,普遍发生碳水化合物之间的相互转化,糖含量发生着动态的变化,由于块茎中糖类可以转化为淀粉促进块茎膨大,当还原糖含量下降时,淀粉含量增加[35-36],本试验中糖含量表现出先降低又增加的变化趋势,这表明块茎的发育过程中部分糖类物质可以转化为淀粉,增加块茎储藏物质的积累.因此,外源添加的茉莉酸合成抑制剂达到一定浓度时,完全抑制脂氧合酶活性,茉莉酸合成机制受到破坏,即使添加外源茉莉酸,也无法调控马铃薯块茎的形成.

