高脂饲喂结合力竭游泳的气虚血瘀证动物模型的构建及评价*
张伟健,刘宏,苏薇薇,曾璇,王永刚,李沛波,彭维,姚宏亮
(中山大学生命科学学院/广东省中药上市后质量与药效再评价工程技术研究中心/广东省热带亚热带植物资源与利用重点实验室,广东 广州510275)
气虚血瘀证是中医临床常见症候之一,其既有气虚之象,同时又兼有血瘀,可见于心脑血管疾病的不同发展阶段。中医理论认为,气是人体赖以进行生命活动的基础物质,气为血之帅,气能行血,气虚则不能充分推动血液运行,以致血行不畅而瘀滞;血为气之母,血能生气,血瘀则脏腑失养、生气乏源,亦能致使气虚[1]。气虚与血瘀,往往同时并存,二者密不可分,相互影响。生活方式的改变致使气虚血瘀已成为大多数现代人的体质特征[2]。气虚血瘀证作为现代人群的一个突出的体质病理学特征,是许多疾病共有的病机特点。在临床上,气虚血瘀证常见于老年人的心脑血管疾病,如冠心病、脑卒中。王阶等[3]对324个患有冠心病的病人进行调查研究,发现气虚和血瘀是冠心病的最主要症候要素。
力竭游泳法是制作气虚血瘀证动物模型最为基础的研究方法,绝大多数的多因素造模方法均建立在力竭游泳法之上。在气虚血瘀证动物模型的建立上,前人已经取得了可喜的成绩,如单纯力竭游泳诱导的气虚血瘀模型[4]、综合饥饿、力竭游泳、寒凉等因素诱导的气虚血瘀模型[5]、力竭游泳复合药物诱导的气虚血瘀模型[6]、力竭游泳复合手术诱导的气虚血瘀模型[7]等。血脂代谢异常是心脑血管疾病发生的重要因素之一。临床上,肥胖人群患气虚血瘀型的心脑血管疾病趋势越发增高,然而,尚未见合适的动物模型以供相关中医药进行防治研究。为此,本研究在力竭游泳的基础上复合高脂饲喂,以建立新的气虚血瘀证动物模型,以期为中医药防治气虚血瘀型心脑血管疾病作用机理等基础研究提供较为理想的实验载体。
1 材 料
1.1 实验动物
SD雄性大鼠20只,体质量220~260 g,SPF级,由广东省医学实验动物中心提供。实验动物使用许可证号:SYXK(粤)2013-0002。
1.2 实验环境
实验所用大鼠均饲养在广东省医学实验动物中心SPF级动物房,饲养温度为20~26 ℃,相对湿度为40%~70%,试验期间,动物饲养所用的相应饲料均由广东省医学实验动物中心提供,动物自由进食饮水。
1.3 实验仪器
BS-3000A电子分析天平(上海友声衡器有限公司);Morris水迷宫水池(水深40 cm,直径160 cm,高50 cm,水温19~21 ℃);毛细管;秒表;华东电子DG5033A酶标仪(南京华东电子集团医疗装备有限责任公司);DS-261全自动生化分析仪(江苏英诺华医疗技术有限公司);UNICO-UV2000分光光度计(尤尼柯(上海)仪器有限公司);KDC-2046 低速冷冻离心机(科大创新股份有限公司中佳分公司)。
1.4 实验药品与试剂
戊巴比妥钠(德国默克,批号:150828),大鼠血清谷丙转氨酶(ALT)、谷草转氨酶(AST)、肌酐(Cr)、尿素氮(BUN)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、甘油三酯(TG)、乳酸(LD)、乳酸脱氢酶(LDH)、肌酸激酶同工酶(CK-MB)、超氧化物歧化酶(SOD)、丙二醛(MDA)、白介素-1β(IL-1β)、白介素-6(IL-6)、白介素-8(IL-8)、肿瘤坏死因子-α(TNF-α)、补体3(C3)、免疫球蛋白A (IgA)、免疫球蛋白G (IgG)、免疫球蛋白M (IgM)、血小板活化因子(PAF)、内皮素-1(ET-1)、前列环素(PGI-2)、血栓素(TXA2)等检测试剂盒均购自南京建成生物工程研究所。
2 方 法
2.1 动物分组及造模方法
大鼠随机分成空白对照组和模型组,每组10只动物。空白对照组大鼠给予普通饲料进行正常喂养,模型组大鼠给以高脂饲料持续喂养8周,从第9周开始,每天进行一次力竭游泳,持续16 d,期间继续保持高脂饲喂。游泳水温控制在19~21 ℃,每次游泳至大鼠动作失调、水淹没鼻尖,出现自然沉降10 s,即捞出,且游泳后不予擦拭水迹和保温措施。
2.2 气虚血瘀表征观察
造模期间,观察记录大鼠的精神状态、皮毛色泽、粪便、舌象、眼球、尾部等一般状况。判断大鼠是否出现气虚血瘀症状[1],如气虚症状:精神萎靡,倦怠嗜睡,四肢蜷缩,活动性差,攻击性、对抗性行为减少或消失;食欲不振,粪便烯溏;毛发稀疏,脱落,干燥无彩。血瘀症状:舌质较空白对照组明显绛紫暗;尾部自尖至根出现不同程度青斑或皮下瘀紫;眼球较空白对照组更鲜红或转为暗红。
2.3 血液指标检测
造模结束后,2组大鼠均禁食不禁水12 h,使用w=3%戊巴比妥钠麻醉,腹主动脉采血,一部分血样用于测定毛细管凝血时间,另一部分血样室温静置约30 min,然后进行10 min转速为3 000 r/min的离心,取血清,采用全自动生化分析仪检测肝肾功能指标ALT、AST、Cr、BUN、UA;血脂指标TC、TG、LDL-C、HDL-C;能量代谢及心肌酶指标LD、LDH、CK-MB。采用比色法检测氧化应激指标SOD、MDA。采用酶联免疫方法检测炎症因子IL-1β、IL-6、IL-8、TNF-α;免疫应答指标C3、IgA、IgG、IgM;血管内皮功能指标ET-1、PGI-2、TXA2;血小板活化因子PAF。以上操作均严格按照各类试剂盒(南京建成生物工程研究所)使用说明书进行。上述生化指标的检测均于2017年5月在南京建成生物工程研究所完成。
2.4 统计学分析
数据均采用“均值±标准差”呈现,组间差异统计采用t检验,SPSS 19.0软件实现,P值小于0.05或0.01认为具有统计学差异。
3 结 果
3.1 大鼠表征观察
与正常大鼠相比,模型大鼠出现了气虚血瘀症状,如精神萎靡,倦怠嗜睡,四肢蜷缩,活动性差,攻击性、对抗性行为减少或消失,后肢行动迟缓艰难(见图1),舌质较对照组明显绛紫暗(见图2)。
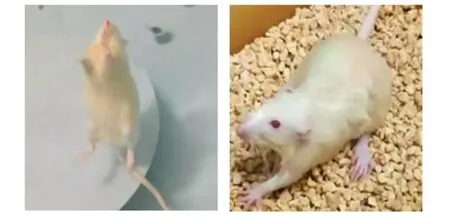
图1 单次力竭游泳的大鼠
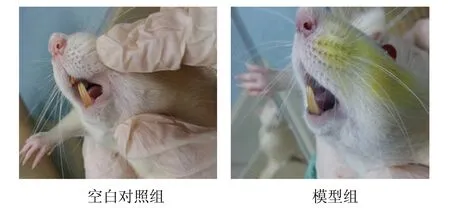
图2 模型大鼠气虚血瘀表征
3.2 生化指标检测
如表1所示,与空白对照组相比,模型组大鼠所检测26个指标均发生显著性变化(P<0.05或P<0.01),提示模型大鼠机体出现能量代谢紊乱,心肌损伤,氧化应激失衡,炎症反应、免疫应答功能失调,肝肾功能障碍,脂质代谢异常,内皮功能紊乱,凝血功能异常等气虚血瘀相关病变。
4 讨 论
目前,气虚血瘀证动物模型的制作方法多种多样,主要可分为单因素造模方法和多因素结合造模方法。多因素结合造模方法又可分为病因造模、结合现代药理因素造模以及病症结合这三种类型。力竭游泳法是制作气虚血瘀证动物模型最为基础的研究方法,众多学者也采用力竭游泳结合其他造模因素进行气虚血瘀大鼠模型的制作,见表2。
有研究表明动物力竭游泳两周即可出现气虚血瘀状态[4],在参考前人研究的基础上,本研究根据“肥甘厚味伤脾损气”“劳则气耗”等中医理论,对动物进行长期慢性高脂饮食,碍胃而伤脾,既可减少其生气之源,又可助生痰湿导致瘀血证的发生[8];力竭游泳以增加其正气消耗,“气为血之帅”,气虚则无力推动血液运行,经脉之血则停滞淤积形成瘀血[9]。本模型保证了气虚为始动因素,并作为主要因素贯彻了整个造模过程。本模型更加贴近临床,且模型动物气虚血瘀症候持续时间长,动物不易恢复。
表1 大鼠生化指标检测情况1)
Table 1 Biochemical index detection of the rats
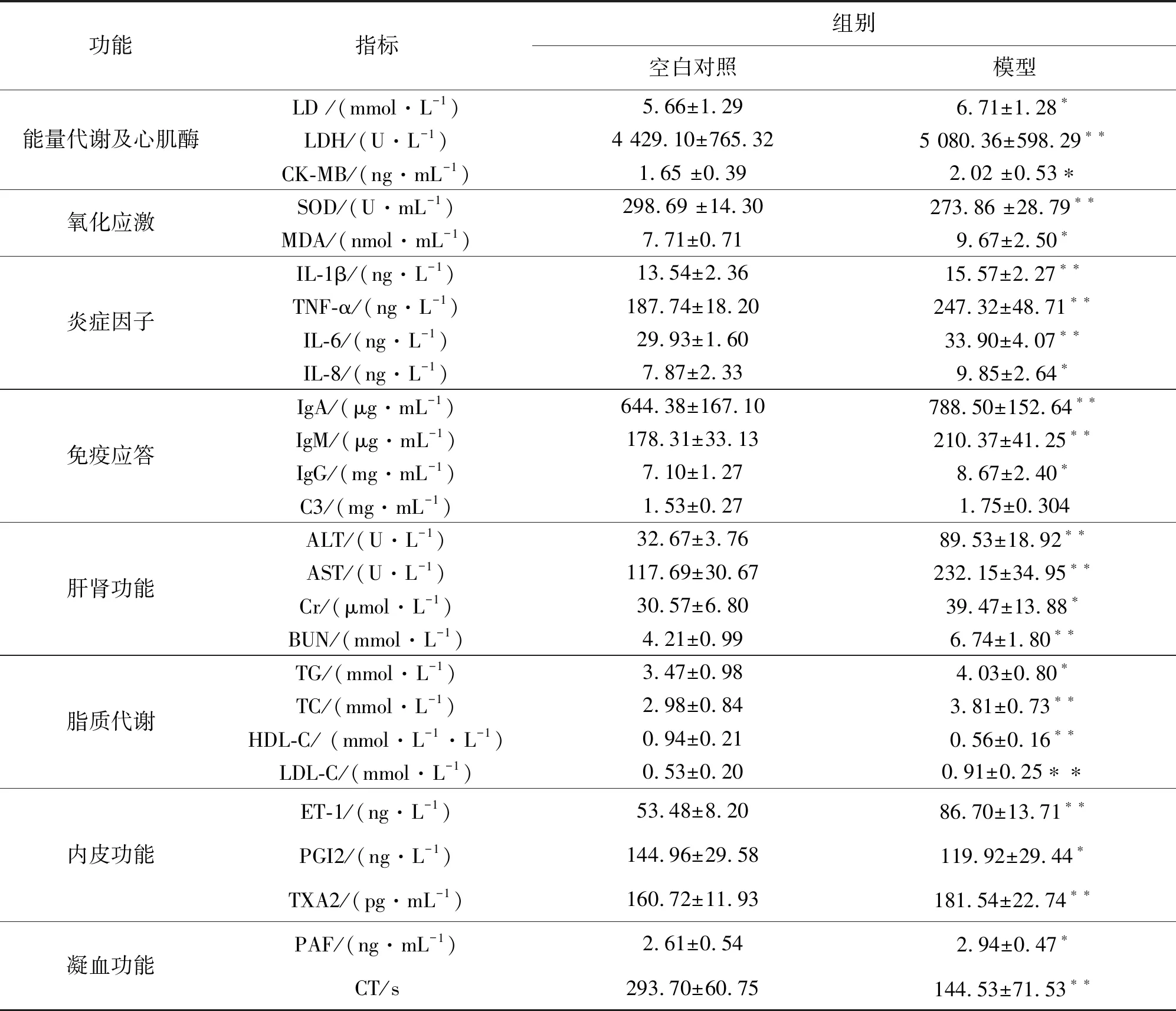
功能指标组别空白对照模型能量代谢及心肌酶LD /(mmol·L-1)5.66±1.296.71±1.28∗LDH/(U·L-1)4 429.10±765.325 080.36±598.29∗∗CK-MB/(ng·mL-1)1.65 ±0.392.02 ±0.53∗氧化应激SOD/(U·mL-1)298.69 ±14.30273.86 ±28.79∗∗MDA/(nmol·mL-1)7.71±0.719.67±2.50∗炎症因子IL-1β/(ng·L-1)13.54±2.3615.57±2.27∗∗TNF-α/(ng·L-1)187.74±18.20247.32±48.71∗∗IL-6/(ng·L-1)29.93±1.6033.90±4.07∗∗IL-8/(ng·L-1)7.87±2.339.85±2.64∗免疫应答IgA/(μg·mL-1)644.38±167.10788.50±152.64∗∗IgM/(μg·mL-1)178.31±33.13210.37±41.25∗∗IgG/(mg·mL-1)7.10±1.278.67±2.40∗C3/(mg·mL-1)1.53±0.271.75±0.304肝肾功能ALT/(U·L-1)32.67±3.7689.53±18.92∗∗AST/(U·L-1)117.69±30.67232.15±34.95∗∗Cr/(μmol·L-1)30.57±6.8039.47±13.88∗BUN/(mmol·L-1)4.21±0.996.74±1.80∗∗脂质代谢TG/(mmol·L-1)3.47±0.984.03±0.80∗TC/(mmol·L-1)2.98±0.843.81±0.73∗∗HDL-C/ (mmol·L-1·L-1)0.94±0.210.56±0.16∗∗LDL-C/(mmol·L-1)0.53±0.200.91±0.25∗∗内皮功能ET-1/(ng·L-1)53.48±8.2086.70±13.71∗∗PGI2/(ng·L-1)144.96±29.58119.92±29.44∗TXA2/(pg·mL-1)160.72±11.93181.54±22.74∗∗凝血功能PAF/(ng·mL-1)2.61±0.542.94±0.47∗CT/s293.70±60.75144.53±71.53∗∗
1)与空白对照组比较,*P<0.05,**P<0.01,每组10只动物
表2 气虚血瘀证动物模型制备方法比较一览表
Table 2 Summary of qi deficiency and blood stasis animal model
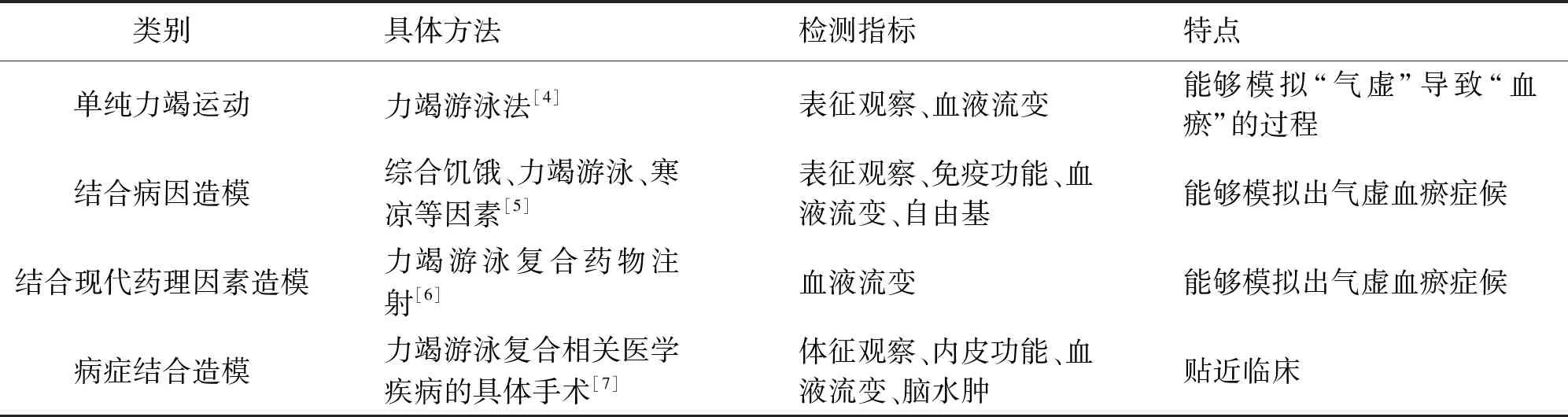
类别具体方法检测指标特点单纯力竭运动力竭游泳法[4]表征观察、血液流变能够模拟“气虚”导致“血瘀”的过程结合病因造模综合饥饿、力竭游泳、寒凉等因素[5]表征观察、免疫功能、血液流变、自由基能够模拟出气虚血瘀症候结合现代药理因素造模力竭游泳复合药物注射[6]血液流变能够模拟出气虚血瘀症候病症结合造模力竭游泳复合相关医学疾病的具体手术[7]体征观察、内皮功能、血液流变、脑水肿贴近临床
关于气虚血瘀证的评价体系,目前尚不完善。在以往的研究中,前人普遍从动物的整体表征及血液流变学的改变以判断气虚血瘀证模型的成立与否。随着现代生物学技术的发展,人们开始尝试研究相关的微观指标以科学客观地评价该证候,有研究报道分别从血管调控物质、能量代谢、血液流变学改变等多个微观角度初步揭示了气虚血瘀证的重要生物学基础,并指出脂质过氧化损伤与血管调控失常是导致气虚血瘀模型大鼠器官损伤的重要病理机制[10-11]。此后,在该证候动物模型的研究中不乏相关的生物学指标检测。
在本研究中,模型成立的评价标准除了动物宏观特征的观察外,还分别选取了能量代谢、氧化应激、脂质代谢、免疫炎症、内皮功能以及凝血时间等多个微观指标进行评价。本研究结果显示,模型大鼠在高脂饲喂结合力竭游泳后,表现出中医临床上气虚血瘀的敏感表征,如气虚的敏感表征:倦怠嗜睡,精神委顿,四肢蜷缩,活动性差等,以及血瘀的敏感表征:舌质较空白对照组明显绛紫暗等。以上表征的确立,证明了以高脂饲喂结合力竭游泳可以制备大鼠气虚血瘀状态。此外,微观生化指标的检测结果显示模型大鼠出现了气虚血瘀的发生发展密切相关的病变。
乳酸是糖酵解的终产物。乳酸脱氢酶是一种糖酵解酶,能催化乳酸与丙酮酸之间的相互转化。本研究中,模型组大鼠的乳酸含量与乳酸脱氢酶活力均显著升高,提示造模后,模型大鼠能量代谢不足,糖代谢多只进行到无氧酵解阶段,机体产生大量乳酸,使得机体处于倦怠状态,能量代谢的不足是气虚的典型表现。SOD是清除自由基的首要物质,人体内最主要的抗氧化酶。近年来研究发现,中医虚证的发生与SOD的活性下降关系密切[12]。MDA是生物体内自由基作用于脂质形成的氧化终产物,可体现机体内脂质过氧化的程度,并可间接表征细胞的损伤程度。模型大鼠SOD活力显著降低,MDA含量显著升高,表明机体处于自由基代谢失衡状态,机体自由基清除能力下降,自由基的增多加重机体的过氧化损伤,机体虚损程度较重。
血管活性物质失衡是临床气虚血瘀证重要的物质基础。ET-1是目前内源性作用最强的血管收缩肽[13]。TXA2促进血小板聚集,而PGI2扩张血管和抗血小板聚集。TXA2和PGI2平衡失调,会导致血栓形成[14]。模型组大鼠ET-1含量显著升高,PGI2含量显著降低,TXA2含量显著升高,表明模型大鼠血管内皮受到损伤,血管舒缩功能出现障碍,容易出现血栓。PAF是迄今发现的最具强烈活性的脂类介质,具有强烈的促血小板聚集和释放作用[15]。PAF含量显著升高,毛细管凝血时间显著缩短,表明模型大鼠血小板聚集增强,血液处于高凝高黏的状态,大鼠出现血瘀症状,符合气虚血瘀证的特点。
此外,模型大鼠还出现了免疫应答失调,有明显的炎性反应,且心肌出现损伤,肝肾功能出现障碍,由此得出模型大鼠组织器官损害较为显著,多个组织器官出现一定程度的损害提示在高脂饮食、劳倦等因素作用下,脏腑功能逐渐虚衰可致气虚血瘀,多器官的生理功能的减退,也在一定程度上体现出了模型大鼠全身性的气虚血瘀病变。
综上所述,本模型创新性地结合高脂饲养、力竭游泳这两种因素诱导气虚血瘀,这样的气虚血瘀证模型死亡率低,成功率高,且操作简单易行。该模型在能量代谢、氧化应激、炎症反应、免疫应答、内皮功能、脂质代谢、肝肾功能以及血流变等各个方面均发生显著变化,可应用于药物治疗气虚血瘀型心脑血管疾病疗效的考察,对中药多靶点综合作用的评价具有较高应用价值。

