瑞德西韦的合成、作用机制与应用
陆泓雨,张彦
1.北京大学 基础医学院,北京 100871;2.军事医学研究院 生物工程研究所,北京 100071
瑞德西韦(Remdesivir)是吉利德科学公司(Gilead Sciences)正在研发的一种核苷类似物[1],2012 年报道其具有抗RNA 病毒活性[2],此后,更多的体外实验和动物实验证明其具有治疗埃博拉病毒病[3]、中东呼吸综合征[4]等RNA 病毒感染的应用前景,但在埃博拉病毒病治疗的临床研究中效果不如单克隆抗体而被替换[5]。2020 年1 月31日,《新英格兰医学杂志》在线发表论文,首次介绍了美国新型冠状病毒肺炎(COVID-19)患者在使用瑞德西韦后临床症状迅速减轻的情况[6]。我国于2020 年2 月初批准进行瑞德西韦抗新型冠状病毒(2019-nCoV)的临床试验[7]。2020 年 3 月23 日,瑞德西韦被美国食品药品监督管理局(FDA)认定为“孤儿药”,涉及适应症为COVID-19[8],这将有助于加快其审批进程。
本文主要介绍瑞德西韦的作用机理、设计原理、合成路线和应用情况,以期对这一药物有一个相对全面的认识。
1 药物结构与作用机理
瑞德西韦,分子式C27H35N6O8P,相对分子质量602.576,是一种具有广谱抗病毒活性的核糖核苷类似物[9],进入人体细胞后被胞内脂酶分解为羧基结构,继续分解为单磷酸腺苷,磷酸化为三磷酸腺苷,参与并影响病毒RNA 复制的过程而发挥抗病毒作用。其结构式及体内转化过程见图1。
瑞德西韦的抗病毒作用原理是通过磷酸化后形成的三磷酸核苷类似物被RNA 聚合酶识别,参与病毒基因组的合成,而瑞德西韦经过修饰的糖基会引起病毒RNA 空间空间构象的变化,阻止磷酸二酯键的形成致使链合成的终止[1],即通过抑制RNA 依赖性的RNA 聚合酶(RNA-dependent RNA-polymerases,RdRp)活性从而发挥作用,此机制已经被证明是其抗埃博拉病毒的原因[4]。
2 合成路线研究
2.1 药物设计路线
药物设计的第一步是设计并筛选能与靶向目标互作的活性物质,具体到病毒则是筛选能抑制病毒生长活性的核苷类似物。目前已可利用人工智能和机器深度学习辅助完成这一步[10]。经过实验筛选发现化合物A(图2)有抑制活性,其主要结构特征有二:母核为鸟嘌呤类似物,戊糖与母核的C9 经C-C 键相连[11]。与正常鸟苷的CN 键相比,这种C-C 键结构既可以使1′位取代的化合物更稳定,也可以使其磷酸化后成为RdRp的底物,从而插入病毒的RNA 链。经过对化合物A 及其结构相似的化合物进行细胞实验,发现与其结构相似的化合物对病毒活性较弱,说明化合物A 的活性和选择性在筛选的化合物中都呈优化状态,构效关系相对严格[1]。
然后需要对选定的化合物A 进行前药修饰。核苷类药物插入RNA 链中抑制病毒的复制需要发生3 次磷酸化反应才能活化,而第1 个磷酸化反应是限速步骤,对起效和作用强度影响最大。为此将一个磷酸基团与核糖的5′位相连,这样有利于直接进行后2 步磷酸化反应,利于发挥药效。在插入磷酸基团后,其负电荷会影响药物分子的极性,降低药物的体内运输能力。为此用非极性前药进行遮蔽,形成化合物B 的一般结构(图3)[11]。最后对取代基进行优化,经过动物实验筛选,得到了瑞德西韦的最终结构。
2.2 合成路线
目前瑞德西韦主要有2 条合成路线(图4、5)。2 条线路的前半部分合成核苷类似物(Nuc)的方法相同,都是由带有保护基团的内酯(化合物1)和卤化的氨基氮杂吲哚(化合物2)为原料反应生成化合物3,然后通过一步取代反应生成化合物4,去保护基生成核苷。合成的后半部分路线上,第一代直接合成得到的化合物7a 是消旋体,需要高效液相色谱法进行分离才能得到单一构型化合物;第二代方法在核苷基础上先形成缩醛对顺式邻二醇进行保护形成化合物5,再与化合物6 反应生成单一构型化合物7。
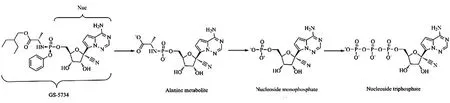
图1 瑞德西韦结构式及其体内转化过程[4]
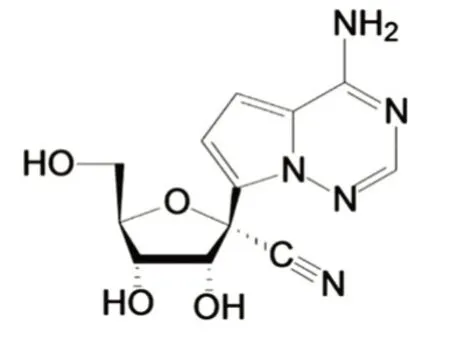
图2 化合物A 的结构[11]

图3 化合物B 的结构[11]
2.3 讨论与评价
瑞德西韦上述2 条合成路线的主体思路是相同的,其合成步骤基本相似,第二代合成路线相比于第一代主要是在细节上的优化,包括反应条件与催化剂的重新选择、基团的保护与手性合成的优化。
在第一步糖基化步骤中,使用碘代物取代第一代方法中的溴代物,并使用格氏试剂进行卤素交换,使产率达到40%,并且温度和试剂选择更温和,有利于大规模生产;第二步反应在大于95∶5 的投料比的条件下可以获得85%的产率,并且加入三氟甲磺酸(TfOH)是促进高产量和高选择性的关键;BCl3处理对苄基的去保护作用较好,使化合物4 易于结晶分离;2,2-二甲氧基丙烷在H2SO4存在的情况下可以使羟基化合物的保护率达到90%,并且经研究消旋的化合物9 在异丙醚作为溶剂重结晶的情况下得到单一构型化合物6(图6),高产的化合物5 与单一构型的6 进行反应,再进行脱保护反应就可以顺利得到高产率的单一构型的最终化合物[3]。上述反应条件的优化直接导致了产率的提高和产量的增加。
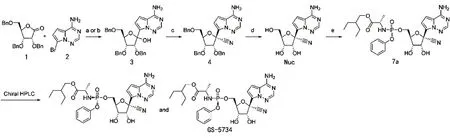
图4 瑞德西韦的第一代合成路线[3]
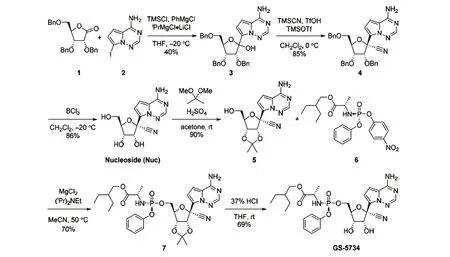
图5 瑞德西韦的第二代合成路线[3]
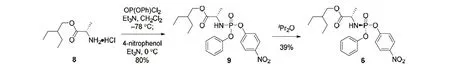
图6 制备单一构型化合物6 的过程[3]
此外,第二代合成线路通过选择更优质和特异性更高的反应物、控制反应条件(温度、溶剂等)、进行立体化学设计等方法,实现了对合成线路的优化,从而提高反应选择性、降低反应成本、提高产率,可以在实验室进行百克级合成[3],甚至达到了工业批量生产的要求,为未来的临床研究和临床使用做好准备。
作为一种研究时间较短的在研药品,目前对瑞德西韦的研究特别是合成研究尚不充分,第二代合成路线还会有改进的空间,如何改进其合成路线也会是一个值得研究的问题。通过不断优化反应条件并创造新的半合成、全合成路线,甚至借助人工智能与深度学习对药物的设计、合成进行优化,都会让合成路线的效率和产率得到进一步提高。
3 药物应用研发进展
瑞德西韦作为一种具有广谱抗RNA 病毒活性的药物,在预防和治疗RNA 病毒病上有着广泛的应用。在COVID-19 出现前,其已经完成了多项动物活体实验和临床试验,主要是针对埃博拉、中东呼吸综合征等病毒。
针对埃博拉病毒,瑞德西韦在体外实验和灵长类动物实验中体现出抑制病毒复制的活性[4],但在临床试验中被单克隆抗体替换,原因是后者死亡率更低[12]。
针对中东呼吸综合征,小鼠实验证明瑞德西韦有比较好的对非人哺乳动物的治疗效果,预防性和治疗性用药均可改善肺功能,降低肺病毒载量,减轻肺病理学损伤[5]。这也是在COVID-19 暴发后选择瑞德西韦进行临床试验的原因之一。
瑞德西韦已经被证明可以在体外有效抑制新近出现的2019-nCoV[13],并且在美国的1 例COVID-19 临床治疗中产生了一定的效果[6],证明其可能在人体内具有抗2019-nCoV 活性。在中国,瑞德西韦已经开始进行针对COVID-19 的临床试验,但目前尚没有结果证实或证伪其可以作为 抗 2019-nCoV 药 物 使用[14]。
4 结语
通过对瑞德西韦分子设计方法的研究,讨论了药物分子的稳定性与化学键、成键基团等多种因素的关系,讨论了药物的体内反应条件和物理化学性质在药物设计中的重要影响,对掌握药物设计的一般规律有指导意义。通过对瑞德西韦2条合成路线的讨论,明确了改变反应条件和立体化学在有机合成中间的重要作用,对实验室有机合成和进行工业生产都具有重要的指导意义。

