液相芯片技术与实时荧光定量PCR在检测儿童感染性腹泻病原体的比较
汉聪慧,曹广进,张福真,胡亮杉,曹东林*,李 凌*
(1.南方医科大学 公共卫生学院 三级生物安全实验室,广东 广州 510515; 2.广州市番禺区疾病预防控制中心,广东 广州 511400; 3.广东省第二人民医院 临床检验中心,广东 广州 510317)
感染性腹泻广义指各种病原体肠道感染引起的腹泻,除外霍乱、细菌性和阿米巴痢疾、伤寒和副伤寒的感染性腹泻[1]。据估计,2016年全球共有40亿感染性腹泻患者,其中160万患者死亡。发展中国家的儿童最容易受到影响[2-3]。截至2017年,约53万名5岁以下儿童因腹泻而死亡[4],其中大部分发生在世界上最贫穷的国家。国家卫生健康委员会公布,2018年中国感染性腹泻病发病率为92/10万,病死率为0.001/10万。
多种细菌、病毒均可引起感染性腹泻病,且存在2种或2种以上的病毒或(和)细菌混合感染的情况[5]。研究表明,一年内中国5岁以下儿童出现腹泻病原体的混合感染可达到27.60%[5]。腹泻病患者数量大、病原体复杂且多混合感染,目前中国肠道门诊常规检测包括的感染性腹泻病原体种类有限,特殊检测周期长,存在一定的局限性。液相芯片具有高通量、快速、可靠和经济等特点,可实现临床快速确诊[6]。因此,本研究运用液相芯片技术快速检测感染性腹泻病病原体,分析检出病原体特征,并与实时荧光定量PCR比较,评价其在感染性腹泻病快速诊断中的应用前景。
1 材料与方法
1.1 材料
1.1.1 样品来源:粪便样品来自于2017年11月至12月广东省第二人民医院门诊就医的96例儿童及0月~5岁婴幼儿腹泻患者,其中男性54例、女性42例,年龄中位数为2.05岁。就诊前患儿未服用抗生素、抗病毒及抗阿米巴药物。本研究获得医院伦理委员会批准(批准文号:2017-SCZYF-JYK)。
1.1.2 试剂:胃肠道病原体检测试剂盒(Luminex公司);核酸抽提试剂盒(Qiagen公司);样品预处理缓冲液(Biomerieux公司);Bertin SK38粪便核酸提取微珠试管(Bertin公司);质粒小提试剂盒、切胶回收试剂盒、pMD 19-T载体及氨苄青霉素(TaKaRa公司)。
1.2 方法
1.2.1 粪便标本的预处理:将100~150 mg粪便样品添加到含Bertin SK38微珠的粪便样品裂解液中。每份样品加入10 μL的xTAG®MS2作为液相芯片检测的内参对照。将预处理试管涡旋5 min,室温下静置10~15 min,再以14 000 r/min离心2 min,得到样品上清液。
1.2.2 核酸的提取:取200 μL的样品上清液,按照核酸抽提试剂盒说明书进行操作,最终得到60 μL核酸洗脱液。
1.2.3 液相芯片检测
1.2.3.1 多重RT-PCR反应:每个反应管中加入xTAG®RNase-free水2.5 μL、5×xTAG®OneStep RT-PCR缓冲液7.5 μL、xTAG®GPP 引物混合物2.5 μL、xTAG®BSA(10 mg/mL)0.5 μL和xTAG®OneStep 酶混合物2.0 μL,共15 μL,配制96例样品所需试剂量,同时设置阴性对照。再加入96例样品核酸洗脱液10 μL/管,阴性对照中加入xTAG®RNase-free水10 μL。将配好的各PCR管短暂离心。在PCR仪中以53 ℃ 20 min,1个循环;95 ℃ 15 min,1个循环;95 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,38个循环;72 ℃ 2 min,1个循环,进行多重RT-PCR反应。
1.2.3.2 多重PCR产物与微球杂交反应:在每个0.2 mL PCR管中加入xTAG®GPP Bead Mix 20 μL、1×SA-PE报告溶液75 μL、多重RT-PCR产物5 μL,配制成100 μL/管的杂交体系。最后,在提前预热至60 ℃的PCR仪中以60 ℃ 3 min、45 ℃ 45 min进行分子杂交反应。
1.2.3.3 xTAG®GPP检测:将PCR管放置于提前预热至45 ℃的加热器,检测后使用xTAG®Data Analysis Software (TDAS) 软件分析结果。
1.2.4 实时荧光定量PCR检测:采用实时荧光定量PCR试剂盒(探针法)对1.2.2步骤所提取的核酸进行qPCR。qPCR检测所用引物序列(表1)[7],所用基因探针序列(表2)[7]。
1.2.5 多重PCR产物的克隆、测序分析:将多重PCR产物克隆到pMD19-T载体,转化、挑取单菌落、扩大培养、进行菌液PCR、琼脂糖凝胶电泳验证,最后提取菌液质粒送至公司进行测序、BLAST分析。
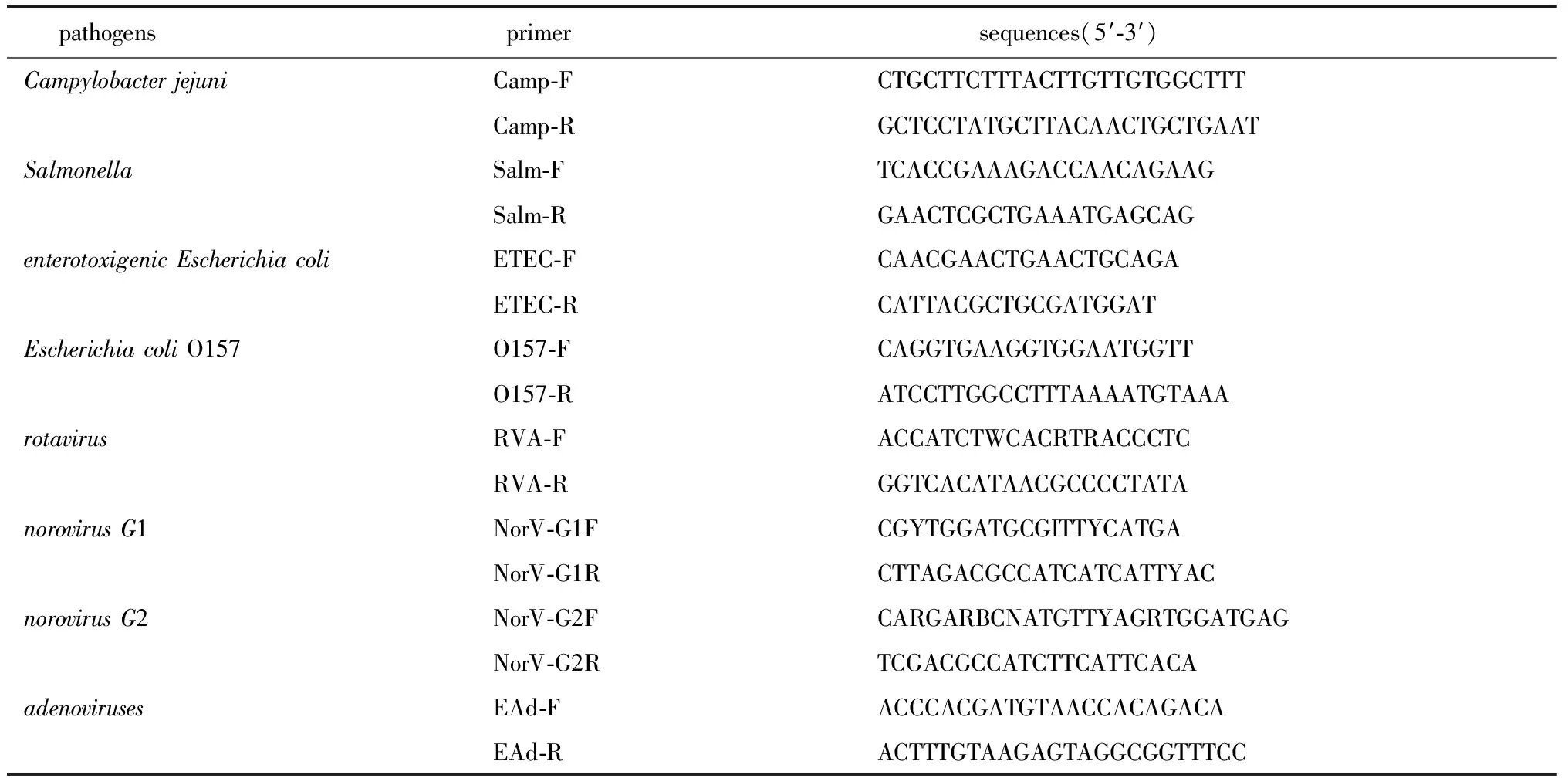
表1 实时荧光定量PCR引物Table 1 Primer sequence of real-time PCR

表2 实时荧光定量PCR探针序列Table 2 Gene probe sequence of real-time PCR
1.3 统计学分析
计数资料以例数n、百分率(%)表示,采用SPSS 20.0对液相芯片与实时荧光定量PCR的检测结果进行配对计数资料的χ2检验,以敏感度和特异度、阴性预测值和阳性预测值为检测指标。
2 结果
2.1 腹泻病原体检出情况
xTAG®GPP试剂盒共检出7种病原体63例,阳性检出率为65.63%(63/96)。其中检出最多的是沙门氏菌48例(50.00%),其次是空肠弯曲杆菌20例(20.83%)、A组轮状病毒16例(16.67%)、诺如病毒14例(14.58%)、肠道腺病毒3例(3.13%),产肠毒素型大肠杆菌和大肠杆菌O157均为2例(2.08%),没有检出霍乱弧菌、小肠结肠炎耶尔森杆菌及志贺氏菌。实时荧光定量PCR检出62例样品为阳性,阳性检出率为64.58%(62/96)。
2.2 两种方法检测结果的比较
4种病原体(包括沙门氏菌、A组轮状病毒、诺如病毒和空肠弯曲杆菌)检出率均有差异(P<0.05);液相芯片检测7种腹泻病原体的敏感度、特异度、阴性预测值、阳性预测值(表3);正确指数为82.76~97.62,表明液相芯片检测腹泻病原体的真实性较高。
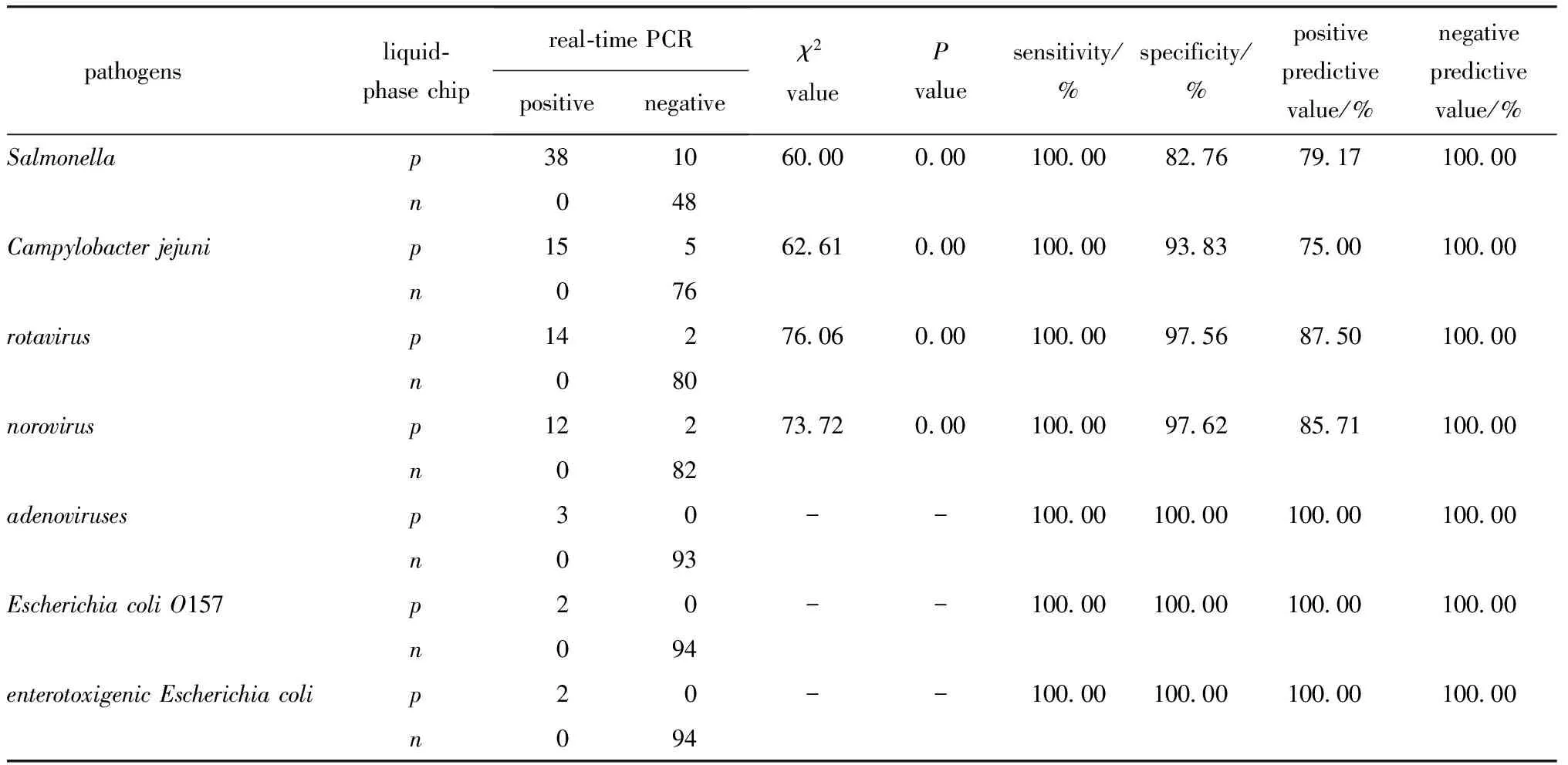
表3 液相芯片和实时荧光定量PCR方法对每种肠道病原体检测结果比较Table 3 Comparison of liquid-phase chip and real-time PCR method for detection of each intestinal pathogen
-.no data;p.positive;n.negative.
液相芯片与实时荧光定量PCR检测结果相同的共有83例,一致率为86.46%(83/96),其中真阴性占39.76%(33/83),真阳性占60.24%(50/83)。对沙门氏菌、A组轮状病毒、诺如病毒和空肠弯曲杆菌的kappa值分别为0.79、0.83、0.92和0.91,说明两种方法的一致性好。
经χ2检验分析可知,与实时荧光定量PCR相比,液相芯片检测感染性腹泻病原体的敏感度为100.00%,特异度为71.74%,阴性预测值和阳性预测值分别为100.00%和79.37% (χ2=53.73,P<0.05)。
2.3 混合感染检出情况
在96例样品中,液相芯片与实时荧光定量PCR检出只感染一种病原体的样品例数(百分率)分别为38例(39.58%)、39例(40.63%),混合感染例数及病原体检出种类见表4。液相芯片检出的细菌混合感染为7例(7.29%),病毒混合感染为1例(1.04%),细菌病毒混合感染为17例(17.71%);实时荧光定量PCR检出的细菌混合感染为7例(7.29%),病毒混合感染为1例(1.04%),细菌病毒混合感染为15例(15.63%)。
3 讨论
感染性腹泻是全球的重要公共卫生问题[8]。
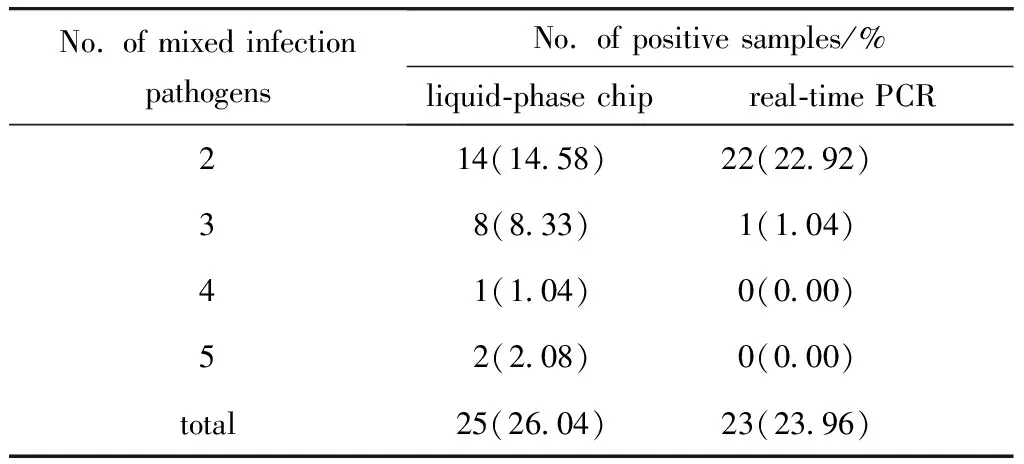
表4 两种方法对混合感染检测效果Table 4 Detection of mixed infection by two methods
多种病原体如细菌、病毒和寄生虫都能引起腹泻,在发展中国家,沙门氏菌感染致腹泻是儿童死亡的主要原因之一[9]。
本研究运用液相芯片对7种细菌和3种病毒进行快速、平行检测,结果发现患儿腹泻中细菌性感染较多,这可能与区域季节性的细菌性流行相关[10]。腹泻患儿粪便中沙门氏菌检出率高达半数,这与报道结果[11]类似;其次为空肠弯曲菌,该厌氧菌对营养要求较高,临床常规方法如细菌培养、生化鉴定等,耗时长达1周,因此,液相芯片技术对以空肠弯曲菌为代表的肠道厌氧菌的检测极具优势[12]。本研究病毒性感染以A组轮状病毒最多,其次为诺如病毒和肠道腺病毒,这与国内报道的感染情况[13-14]一致。上述结果表明,液相芯片技术可有效用于感染性腹泻病原体的快速检测。
腹泻病原体混合感染较常见。本研究液相芯片检测出多种细菌或病毒或细菌和病毒的混合感染,其中沙门氏菌、空肠弯曲菌两种细菌混合感染比例最高达72.00%(18/25),这与报道的细菌性混合感染病原体类型相似[10]。面对混合感染时,实时荧光定量PCR不仅耗费大量的人力、物力,还可能会因病原体种类较多而延误最佳治疗时机,而液相芯片一次能检测多种病原体,这对混合感染的腹泻病的快速诊断具有重要意义。
本研究中同一份样品用两种方法检出的一致率较高,且液相芯片的敏感度和特异度与报道结果[12]相似。对不一致样品进行测序分析,结果显示与qPCR检出结果一致,表明液相芯片检测中出现了1~3个病原体的误检。液相芯片的假阳性可能与产物的切胶回收、克隆等操作有关,或因上次扩增产物密闭不严致所用试剂、加样枪、环境出现极微量或微量的非目的核酸污染。可采取的措施包括阴性对照的设置,试剂、加样枪和环境的预处理和分区操作等,实现腹泻病原体的准确检测。
综上所述,无论是单一腹泻病原体感染还是混合感染,与qPCR相比,液相芯片技术都显示出了高通量、快速、准确的优势。液相芯片技术对临床快速检测腹泻病原体具有积极意义。

