耐多药结核患者T细胞及细胞因子的变化对临床疗效的评估
叶 静,孙海柏,杜钟珍,梅早仙 (天津市海河医院,天津 300000)
WHO显示调查数据:在中国每年死于结核病的患者数多达13万[1],且耐多药较多[2]。这一情况严重威胁了患者的生命健康,成为我国严重的公共卫生问题。耐多药结核(Multi drug resistant tuberculosis MDR-TB)是指人体感染的结核菌经检测证实至少对利福平、异烟肼同时耐受的一种结核类型,中国MDR-TB病患者数占全世界MDR-TB病患者数的13%[3]。可分为初始耐药及获得性耐药,总体治愈率较低,初治耐药患者的治愈率往往显著高于复治患者。MDR-TB病情容易反复,诊治时间长、临床治疗难度大、治疗费昂贵、治愈率低、死亡率高。由于治疗周期长,故在治疗过程中能进行及时而准确的评估就显得尤为重要。抗结核治疗后若能对患者病情好转或恶化进行及时评估,则可及时决定是否需要调整治疗方案,从而更加精准的进行治疗。目前临床上对于病情好转或恶化常用的评价指标有临床表现、营养状态评估、痰抗酸染色、痰结核菌培养、胸部X线片CT等,但都有其局限性,临床表现及营养状态评估往往不能体现结核菌清除状况,痰抗酸染色阳性率低,痰结核菌培养所需时间长,胸部X线片或CT所示病变均吸收缓慢,以上都可以造成结论滞后。结核分枝杆菌侵入人体后,活化的CD4+T细胞(Th)产生特异性细胞免疫应答能有效抵抗结核菌感染,T细胞可分化为T helper (Th)1细胞、Th2细胞及调节性T细胞(regulatory T cell Treg)亚群,细胞亚群Th17主要通过白介素17激活相关炎性反应和其他效应性T细胞结合发挥作用。根据体内结核菌含量的多少从而观察CD4+T细胞变化的规律,通过规律性的观察可以了解治疗效果与体内辅助性T细胞以及相关细胞因子之间的变化规律。本研究通过分析T细胞的变化以及其相关细胞因子的表达情况,分组分析变化趋势,从而推断诊疗的成功与否,对疗效评估、转归给出快速的判断和依据,同时也为将来进行耐多药结核患者的基因多态性的研究以及该病种进行基因免疫制剂治疗开拓了新的思路和方向。
1 对象与方法
1.1研究对象:耐多药结核组选自从2016年3月~2017年3月我院就诊依据《结核诊断和治疗指南》标准诊断的73例耐多药结核患者符合以下要求:临床症状:发热、咳嗽、咯痰、咯血、胸痛/闷、盗汗、乏力、纳差等。部分患者可无临床症状、轻者可无体征。影像学检查:提示结核病影像学变化特征。痰液检查:结核菌液体培养结果阳性,耐药菌检测结果至少对利福平、异烟肼同时耐药,年龄在16~78岁之间,男55例,女18例。将耐多药结核组分成:①初治组43例,复治组30例。②培养未转阴组15例,确诊耐多药结核治疗过程中第6个月末或疗程结束后,痰结核菌培养检查结果仍然为阳性以及痰培养未转阴组;培养转阴组58例,疗程内经过周期性的痰检,连续两次痰培养转阴的患者。健康对照组为体检中心筛查除外结核病史且体健的人员共计56人,男34人,女22人,年龄25~55岁。
1.2治疗方案:按照诊疗规范中提出的标准治疗方案进行治疗:包括吡嗪酰胺(Z)、左氧氟沙星(Lfx)、卡那霉素(Km)、对氨基水杨酸(PAS)、丙硫异烟胺(Pto)五种统一采购的进口的抗结核药物。
1.3仪器:FACSCantoⅡ型流式细胞仪(FCM)
1.4试剂:①BD公司诊断试剂:标记个:MultiTEST CD3-异硫氰酸荧光素(fluorescein Isothiocyanate) FITC/CD8-藻红蛋白(phycoerythrin,PE) /CD45-多甲藻素叶绿素蛋白(peridinin-chlorophyll-protein PerCP)/CD4-别藻蓝蛋白(allophycocyanin,APC),FACS溶血剂,BD FACS七色校准微球,以及相关配套质控物,标准品。②BD CBA法人Thl、Th2、Th17试剂盒(BD CBA Human Thl、Th2、Thl7 Cytokinc Kit,BD Bioscicnccs,USA)。试剂盒主要包含IL-2、IL-4、IL-6、IL-10、TNF-α、IFN-γ、IL-17A 捕获微球各0.8 ml,人Thl、Th2、Th17藻红蛋白检测试剂1 ml,人Thl、Th2、Th17细胞因子标准品(冻干粉)0.2 ml,荧光素的质控液包括:异硫氰酸阳性质控品0.5 ml,藻红蛋白的质控品4 ml,专用洗液130 ml,试验稀释液30 ml的CBA Flex Set检测试剂盒,均为美国BD(Becton Dickinson)公司产品。
1.5方法:本研究对耐多药结核患者淋巴细胞相关细胞及细胞因子的检测采用常规的流式细胞仪法流式细胞术(FCM)检测细胞亚群的相对计数,采用流式微球分析法(Cytometric Bead Array CBA)对血清中细胞因子含量进行测定,本质是通过将不同亮度的微球作为载体,将荧光素标记的针对同一待测抗原的抗体作为探针通过物理吸附等方法与抗体相结合特异性识别待测抗原,形成免疫复合物,最后通过流式细胞仪的激光对其进行分类检测,以获得被固定的待测抗原的种类和数量信息[4],是液相多重蛋白定量检测方法,集微球、荧光、激光、流体学、数据分析一体,通过微球表面的荧光信号进行定量分析。其技术原理为:CBA可以同时检测多种蛋白组合,不同的微球对种抗体进行化学编码,将微球混合在同一系统内再进行多重复合测定。CBA法、酶联免疫吸附试验(ELISA) 、 Western印迹、实时荧光定量PCR ( RT-PCR) 、Luminex液相悬浮芯片技术都能够对细胞因子进行定量检测,但与其他检测技术相比较分析,此类方法具有其独有的特点[5],占据绝对优势,所用标本量较少,且具有较高的灵敏度、较好的密封性,对于高度传染性的患者标本能有效降低交叉感染的几率[6],有很宽的检测范围和更好的重复性,检测的过程可以做到6~7种细胞因子的同时段测量。
1.5.1标本准备:选取实验组用药前以及正常对照组枸橼酸钠充分抗凝抽取的4 ml空腹静脉血;根据药敏试验和指南接受正规化疗,通过制定表格形式统计总结其治疗过程及转归情况,所有耐多药结核患者组都分别在治疗前及治疗后2个月、 6个月取血检测各组人群血清中上述细胞因子水平。样品制备:各组均采集的空腹静脉血4 ml,进行离心(4 000 r/min)后,提取血清进行分装,置-80 ℃冰箱进行备用,待标本收集完成统一实验。
1.5.2检测步骤
1.5.2.1流式细胞仪相对计数T细胞亚群:①提取100 μl全血加入到流式专用管;②各管移入10 μl荧光抗体试剂,避光30 min;③加入溶血剂1 ml,避光10 min;④上机检测,为使其分辨率达到仪器的最佳实验状态使用荧光微球7-colour进行仪器光路的校准;⑤采用Canto软件获取与分析数据;⑥调整仪器状态,细胞在图中合适的位置上;⑦在FSC/SSC上圈出淋巴细胞群为(RI);⑧SSC/CD3上圈出CD3+T细胞群(R2);⑨形成CD4/CD3,CD8/CD3散点图并设置为显示G3=Rl*R2的细胞;⑩一共需要获取10 000个细胞,分析Th(CD3+CD4+)和Ts(CD3+CD8+)细胞的相对计数情况。
1.5.2.2CBA法检测血清细胞因子:①准备检测试剂:将试剂盒及缓冲液取出后,置于室温平衡1 h;②制备标准品:使用专用稀释液把7种标准品按1∶2、1∶4、1∶8……梯度依次稀释到1∶256后,充分混匀;③阴性对照为专用稀释液;④将微球制成混悬液;⑤用微球稀释液稀释混合捕获微球达50I/测试的标准,室温15 min;⑥制备PE标记的信号试剂;⑦实验组血清、7种标准品、捕获微球各50 μl置于流氏管中,室温避光1 h;⑧各加入50 μl的PE信号抗体,室温避光2 h;⑨1 ml洗液置于试管内,离心5 min,离心力为200 g,反复清洗2次,倒去上清液后,加入300ml专用洗液,4个小时内进行完成检测。
1.6统计学方法:利用SPSS 17.0统计分析软件;Excel 2007建立所需数据库;采用率(%)表示计数资料,用χ2检验。
2 结果
2.1T细胞亚群的检测结果:耐多药结核患者用药前T细胞亚群与正常对照组进行比较分析,总T细胞及CD4+T细胞检测两组差异无统计学意义(P>0.05),CD8+T细胞较对照组有所增高,差异有统计学意义(P<0.05),CD4+/CD8+发生变化,差异无统计学意义(P>0.05)。见图1。
2.2Cell Quest软件获取点图:血清中7种细胞因子(cytokine,CK)的 CBA法检测用 Cell Quest软件获取每个样本的点图,依次为IL-2、IL-4、IL-6、IL-10、TNF-α、IFN-γ、IL-17群微球阴性结果与IL-2、IL-6、IL-10、IFN-γ、IL-17阳性结果的散点图进行比较。见图2。
图1 两组T细胞亚群检测结果比较分析
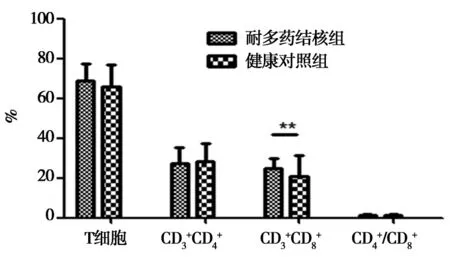
图2 CBA检测法显示微球获取的散点图图谱
2.3耐多药结核组与对照组中细胞因子含量对比分析:耐多药结核患者在用药前检测的结果与健康对照组检测结果比较IL-17、IL-6、IFN-γ、TNF-α的含量存在显著性差异均较正常对照组有所升高,IL-2结果间差异有统计学意义(P<0.05),较正常对照组低。见表1。
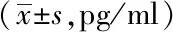

细胞因子耐多药(n=73)健康对照(n=56)χ2值P值IL-17344.7±89.00121.00±65.0018.33<0.001IL-6231.2±58.00200.00±54.003.11<0.01IL-2110.00±29.00120.00±23.402.106<0.05IL-102.08±0.681.98±0.730.8010.424IFN-γ2.40±0.670.56±0.673.394<0.001TNF-α7.06±2.015.02±2.0332.36<0.001IL-47.02±0.357.01±2.560.1650.869
2.4耐多药患者中初治组、复治组用药前细胞因子的变化规律:IL-17、IFN-γ初治组较复治组含量高具有统计学意义(P<0.05),IL-2、IL-4、IL-6复治组较初治组含量高具有统计学意义(P<0.05)。见图3。
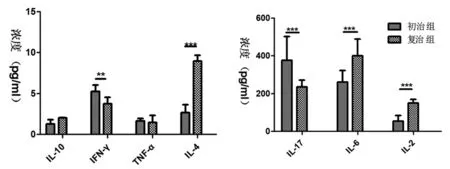
图3 初治组、复治组细胞因子表达:*代表P<0.05,**P<0.01,***P<0.001
2.5耐多药患者中培养转阴组用药前、后细胞因子的变化规律:对于58例培养转阴组IL-6、TNF-α、IL-17、IL-10、IFN-γ用药周期内呈现逐渐下降的趋势;IL-2呈现逐渐升高的趋势且均有统计学意义(P<0.05),逐渐恢复到正常水平,IL-4用药前后无显著统计学差异(P<0.05)。见图4。
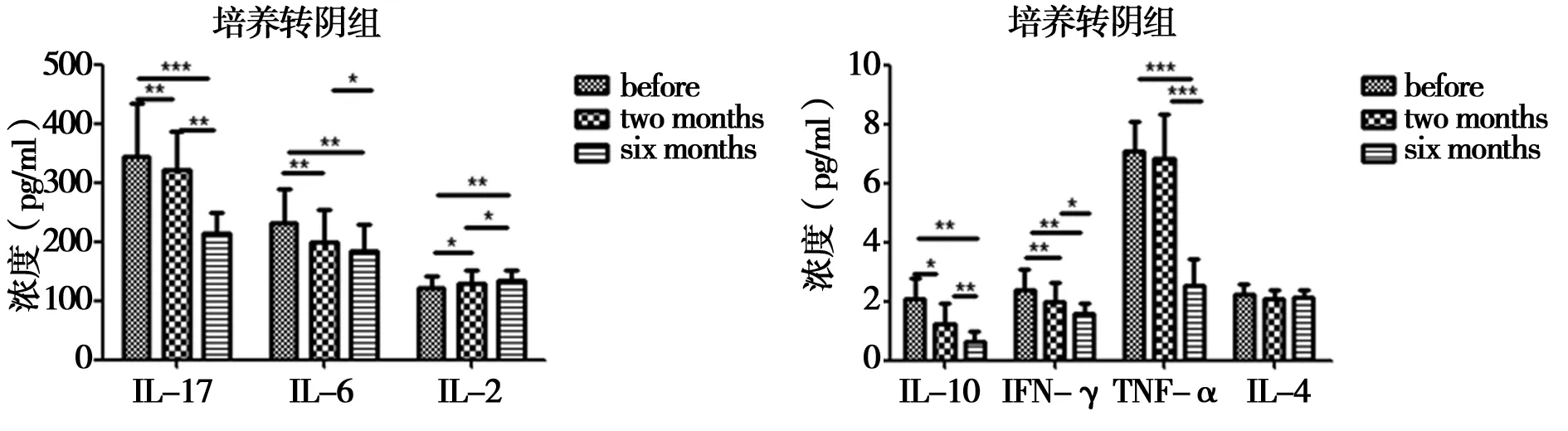
图4 培养转阴组中细胞因子周期性表达:*代表P<0.05,**P<0.01,***P<0.001
2.6耐多药患者中培养未转阴组用药前、后细胞因子的变化规律:15例培养未转阴组中IL-17、IL-6、TNF-α、IL-4五种细胞因子在初治患者治疗前后随着疗程的进展呈现显著性差异(P<0.05),IL-2、IL-10、IFN-γ周期性治疗过程中无显著性差异(P>0.05)。见图5。
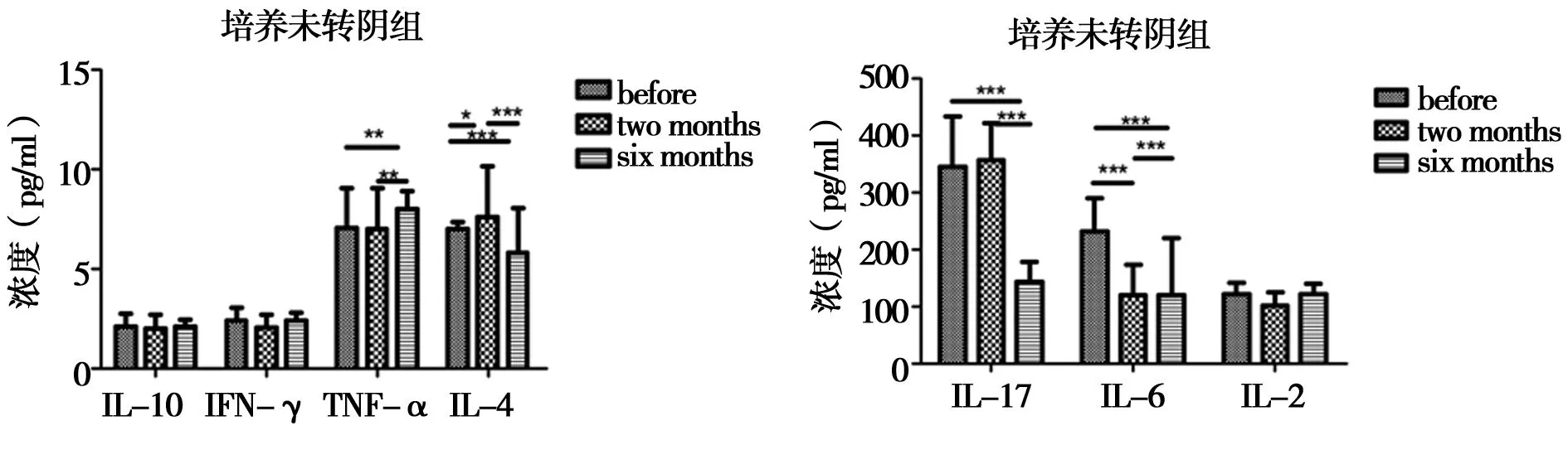
图5 培养未转阴组细胞因子周期性表达:*代表P<0.05,**P<0.01,***P<0.001
3 讨论
结核病的发病机制相当复杂,在免疫功能缺陷或低下人群中发病率相对较高[7],耐多药结核患者用药前T细胞亚群与健康对照组进行比较分析,总T细胞、CD4+T细胞、CD4+/CD8+检测两组无统计学差异,CD8+T细胞较对照组有所增高,差异有统计学意义(P<0.01),说明患者体内免疫系统发生了变化。结核分枝杆菌感染人体后,体内的免疫系统功能紊乱[8],CD8+T细胞数量升高,可能是因为结核菌引起机体内限制性粘附细胞及抑制性T细胞出现的缘故,结核菌细胞壁内物质可以导致携带抗原的巨噬细胞与抗原特异性淋巴细胞相互作用,同时产生活性物质使免疫调节机制中的抑制作用增强,对机体内的免疫活性细胞产生直接抑制,从而使患者体内的免疫细胞数量减少,因此总的T细胞较正常对照变化不大。在耐多药结核患者发病后机体内的免疫系统释放大量的免疫细胞发挥免疫活性作用。免疫状态发生变化,致使一部分T细胞激活同时释放出细胞因子,刺激NK细胞的固有免疫体系形成,消除感染因子,未消除的部分进入体内引导产生特异性T细胞免疫应答。体内的细胞免疫及细胞因子的参与对耐多药结核患者的病情变化及治疗效果发挥着主要作用。
本文研究七种细胞因子在耐多药结核患者体内发生变化:耐多药结核患者在用药前检测的结果与健康对照组检测结果比较IL-17、IL-6、IFN-γ、TNF-α的含量差异有统计学意义(P<0.05),均较正常对照组有所升高,IL-2结果间差异有统计学意义(P<0.05),较正常对照组低。显示机体感染耐多药结核后启动了人体的免疫系统包括细胞和体液免疫两种,造成免疫系统的功能紊乱释放出大量的细胞因子参与到免疫调节,从而杀死结核菌。43例初治组与30例复治组治疗前细胞因子的比较IL-17、IFN-γ,初治组较复治组含量高,差异具有统计学意义(P<0.05),IL-2、IL-4、IL-6复治组较初治组含量高,差异具有统计学意义(P<0.05)。初治患者的主要发病原因是因为呼吸道在人群中的传播,进而感染,机体接触到结核菌后激活效应细胞启动免疫机制,释放出大量的细胞因子,IL-17也随着体内致炎作用的逐渐减少,含量也随之减少。IFN-γ增强辅助T的作用,对于机体杀灭病原菌具有一定的作用,对于初治患者来讲,用药前机体会释放大量的IFN-γ,随着诊疗活动的开展体内的细菌含量逐渐减少,IFN-γ也逐渐减少。由于大部分患者身体抵抗力较弱所以发生的免疫反应存在个体差异。对于30例耐多药结核复治组,由于既往感染过结核菌,体内记忆型T细胞迅速被激活释放出大量与记忆性T细胞相关的细胞因子包括IL-2、IL-4等所以在用药前较初治组呈现升高趋势,可能与机体内的免疫防御机制也有一定关系。
耐药性结核病的诊治与人体所含细菌量的多少,机体免疫状态等因素导致的免疫反应强弱,体内的免疫保护功能是否得到发挥有密切的关系。本文将实验组分成培养转阴组和培养未转阴组,58例培养转阴组IL-6、TNF-α、IL-17、IL-10、IFN-γ用药周期内呈现逐渐下降的趋势;IL-2呈现逐渐升高的趋势且差异均有统计学意义(P<0.05),各项菌逐渐恢复到正常水平,IL-4用药前后差异无统计学意义(P>0.05)。提示在进行有效的治疗后患者体内的免疫细胞以及细胞因子免疫功能的恢复,IFN-γ变化随结核菌量复制成正比,进而起到免疫保护作用[9]。IL-17的逐渐减少说明体内的免疫监视以及免疫调控作用已经初步形成,配合药物治疗将体内的结核菌消灭,最终治疗成功。在培养转阴组以及培养未转阴组中,细胞释放的细胞因子表现各不相同,在培养未转阴组IFN-γ周期性变化存在差异,免疫保护功能没有完全建立,故含量随治疗周期的变化逐渐减少。TNF-α直接参与巨噬细胞抵抗结核分枝杆菌,随机体内痰液中结核杆菌的检出量增加而升高,发挥免疫保护作用,但过度升高会加重肺结核,形成免疫损害,TNF-α在培养转阴组中用药前水平较高,用药后2个月时略有下降,用药6个月与用药前下降幅度较大,可能与耐多药结核发病机制以及耐多药患者的用药机理有关。IL-4、IL-6、IL-10主要介导的是体液免疫,协助B细胞激活生成抗体,具有清除寄生虫感染的作用[10]。15例培养未转阴组中IL-17、IL-6、TNF-α、IL-4在治疗前后差异有统计学意义(P<0.05),TNF-α用药后开始升高,IL-17、IL-6、IL-4用药前较高2个月后降低,6个月后呈现升高趋势;IL-2、IL-10、IFN-γ周期性治疗过程中无显著性差异,用药后2~6个月细胞因子的变化较用药前是相反趋势的现象,提示有可能出现治疗失败,与机体内菌量是否得到控制,机体免疫功能是否恢复具有相关性。从细胞因子的基本功能的角度理解,更加提醒人们细胞因子在抗结核免疫过程中的复杂性,体液免疫以及细胞免疫都有参与结核病发生发展过程[11]。结核分枝杆菌可以引起人体细胞免疫产生IL-17[12-17]促炎因子的作用[18],大量免疫细胞因血清中存在大量的IL-17而延迟凋亡,会对人体造成非常大的危害,因为其最终引发机体发生免疫病理反应,炎性反应部位召集了大量的效应细胞,进而迅速聚集到一起,集中消灭结核分枝杆菌,但正常情况下是否能杀死体内的结核分枝杆菌可能还取决于机体免疫系统的状态以及菌量的多少,上述情况均存在个体差异[19-21]。IL-17在耐多药结核培养转阴组与初治组发展趋势较为一致,用药前以及用药后2个月、6个月数值持续下降恢复正常,治疗有效,结核菌被消灭后逐渐减少。
耐多药结核患者机体免疫细胞较紊乱,抑制性T细胞增加,且T细胞释放出大量的细胞因子参与免疫调节及免疫病理反应中。初治患者:患者临床症状较重,免疫反应性较强,所以随病情变化的IL-17及IFN-γ含量较高;复治组:记忆型T细胞释放大量细胞因子,以IL-2、IL-4变化为主含量较高;培养转阴组:IL-6、TNF-α、IL-17、IL-10、IFN-γ、IL-2各阶段呈现规律性变化,且逐渐恢复到正常水平,视为治疗有效,可持续原治疗方案,说明免疫系统逐渐恢复;培养未转阴组:用药前、用药后2个月、6个月7种细胞因子均无出现规律性变化,用药2个月、6个月较用药前呈现相反的变化趋势提示可能治疗未成功,机体内的结核菌仍未减少,免疫功能仍未彻底恢复。耐多药结核患者用药前与用药后的免疫保护功能、免疫抑制功能、免疫记忆功能发生了很大的变化,依据变化的指标对耐多药患者的治疗效果给予建议性评估。
综上所述,结果提示对于耐多药结核患者体内的辅助性T细胞以及抑制性T细胞较正常对照组有所增高并且存在统计学意义,实验又对研究数据进行了重新分组,依据T细胞相对值的变化规律了解患者体内的免疫功能状况,通过细胞因子在不同分组不同周期变化的情况可以初步推断出患者经过用药是否有效,而及时做出治疗方案的调整,同时使用免疫抑制剂治疗耐多药结核病提供指导意见。
确诊耐多药结核病后进行抗结核治疗过程中体内发生的细胞免疫以及体液免疫依据T细胞变化规律初步推测患者免疫功能状态,及时做出治疗方案的调整。依据机体内细胞因子变化的规律了解初治、复治、培养转阴患者、培养未转阴患者体内免疫反应的状况、免疫保护功能恢复情况、细胞因子周期性表达进行评估,从而协助临床医生对临床用药是否有效性的预判及治疗效果的评估参考依据,以及该病种进行基因免疫制剂治疗开拓了新的思路和方向。

