一测多评法测定6种大豆异黄酮的质量分数
李 秀, 马家辉, 顾 阳, 杨 燕, 成向荣
(江南大学 食品学院,江苏 无锡214122)
大豆异黄酮是豆类生长过程中形成的一类次生代谢产物,在大豆及其制品中含量丰富。作为豆类及其制品中重要的生物活性物质,其抗氧化等生理活性[1-6],受到营养学家广泛关注。人们从大豆中成功分离出的大豆异黄酮已经达到12种,包括3种游离型异黄酮苷元、3种异黄酮葡萄糖苷、3种异黄酮乙酰基葡萄糖苷和3种异黄酮丙二酰基葡萄糖苷[7-8]。其中,异黄酮乙酰基葡萄糖苷、丙二酰基葡萄糖苷在豆制品加工过程中较不稳定,且对照品极难制备与获取。目前美国分析化学家协会AOAC主要通过对大豆及其制品进行提取、皂化后进行HPLC测定大豆异黄酮苷元及葡萄糖苷的含量[9]。目前,国内对6种大豆异黄酮的测定主要参照《保健食品中大豆异黄酮的测定方法 高效液相色谱法》(GB/T23788-2009)[10]和《粮油检测 大豆异黄酮含量测定 高效液相色谱法》(GB/T26625-2011)[11]。这两种国标方法均是对大豆苷、大豆苷元、黄豆苷元、黄豆黄素、染料木苷、染料木素等6种大豆异黄酮进行高效液相色谱测定,需要购置多个对照品配置标准溶液,检测效率相对较低且增加检测成本[12]。
“一测多评”法 (quantitative analysis of multicomponents by single-marker, QAMS)是近年来主要应用于中药领域的多成分质量控制的研究方法,它运用成分间存在的内在函数关系,采用单个易获得的对照品对多个成分进行定量,实现多个成分(对照品没有或难以供应)的同步测定,目前已用于解决中药质量控制中缺乏对照品这一瓶颈问题[13-15]。作者以豆制品中含量丰富、对照品易得的大豆苷为参照,通过分析大豆苷、大豆苷元、黄豆苷元、黄豆黄素、染料木苷、染料木素等6种大豆异黄酮在高效液相色谱行为学上的差异,基于它们的结构共性,寻找在色谱行为学及光谱学上的内在联系,以此建立大豆异黄酮的一测多评分析方法,并运用于常见的大豆及其制品中大豆异黄酮的含量测定。
1 材料与方法
1.1 材料与试剂
大豆苷、大豆苷元、黄豆苷元、黄豆黄素、染料木苷、染料木素:江苏永健公司产品;甲醇(色谱纯)、甲酸(分析纯):国药集团产品。
1.2 仪器与设备
LC-20A高效液相色谱仪:岛津公司产品;1525高效液相色谱仪:沃特世公司产品;1100高效液相色谱仪;Inertsil ODS-SP C18(4.6 mm×250 mm,5 μm)、Ultimate AQ C18(4.6 mm ×250 mm,5 μm)、Kromasil C18(4.6 mm×250 mm,5 μm):安捷伦公司产品;UV2300双光束紫外可见分光光度计:上海天美科学仪器有限公司产品。
1.3 方法
1.3.1 样品处理 称取腐竹、豆腐干、千张、大豆和豆腐样品10~50 g,粉碎,55℃真空干燥 24 h,进一步粉碎后过100目筛,精密称取0.2 g,置于试管中,加入5 mL甲醇,密塞,超声提取30 min,用甲醇补足原质量,离心过滤,滤液备用。
1.3.2 对照品处理 精确称取大豆苷14.4 mg,大豆苷元3.0 mg,黄豆黄苷3.0 mg,黄豆黄素1.2 mg,染料木苷1.2 mg,染料木素6 mg,置于100 mL烧杯中,混合,先加少量甲醇溶解后,移入200 mL容量瓶中并用甲醇稀释至刻度,配成质量浓度分别为72、15、15、6、6、30 μg/mL 的混合对照品溶液,并等比例稀释2.5倍5次,得到6个不同质量浓度梯度的溶液,以制作混合对照品的标准曲线确定线性范围。
另精确称取大豆苷14.4 mg,大豆苷元3.0 mg,黄豆黄苷3.0 mg,黄豆黄素1.2 mg,染料木苷1.2mg,染料木素6 mg,先加少量甲醇溶解后,分别移入200 mL容量瓶中并用甲醇稀释至刻度,配成质量浓度分别为 72、15、15、6、6、30 μg/mL 的单一对照品溶液,与混合对照品一样分别按等比例稀释2.5倍5次,得到6个不同质量浓度梯度的6组单一对照品溶液,以制作6种大豆异黄酮单一对照品的标准曲线。
1.3.3 色谱条件 采用岛津LC-20A高效液相色谱仪进行大豆异黄酮的检测,色谱柱:InertsilODS-SPC18(4.6 mm×250 mm,5 μm);柱温 30℃;进样量 10 μL;双检测波长262 nm和248 nm;流量1.0 mL/min;流动相:A为体积分数0.2%甲酸水溶液,B为甲醇,并设计了3组洗脱程序:
0~60 min,B: 体积分数 55%等度洗脱;0~20 min,B:35%~55%梯度;20~35 min,B:55%等度洗脱;0~30 min,B:30%~90%梯度洗脱。
1.3.4 建立一测多评分析方法
1)线性关系考察 分别精密吸取6个质量浓度梯度的混合对照品溶液各10 μL,注入高效液相色谱仪中,按1.3.3色谱条件测定。以对照品溶液的峰面积为纵坐标,浓度为横坐标,计算标准曲线。计算6种大豆异黄酮的回归方程,确定线性范围。
2)相对校正因子、相对保留时间、相对峰面积的计算 分别精密吸取6个不同质量浓度的单一对照品溶液各10 μL,注入高效液相色谱仪中,按1.3.3色谱条件测定。对262 nm下的测定结果进行分析,按公式1计算以大豆苷为内参物,对黄豆黄苷、染料木苷、大豆苷元、黄豆黄素和染料木素的相对校正因子fk/m;按公式2计算以大豆苷为内参物的相对保留时间Tm/k。计算262 nm和248 nm下的峰面积比值,即为相对峰面积,记为A262/248[16]。

式(1)、(2)中:Wk为内参物k的质量浓度;Ak为内参物k的峰面积;Wm为待测成分m的质量浓度;Am为待测成分m的峰面积;Tk,Tm分别为待测成分和内参物的保留时间。
3)精密度试验 精密吸取同一混合对照品溶液10 μL注入高效液相色谱仪中,连续进样6次,按1.3.3色谱条件测定,记录262 nm下的色谱图,测定峰面积。计算6种大豆异黄酮各成分峰面积的RSD值。
4)稳定性试验 取同一混合对照品溶液,分别在 0,2,4,8,12,24 h 时, 精密吸取 10 μL 注入高效液相色谱仪中,按1.3.3色谱条件测定,记录262 nm下的色谱峰,测定峰面积。计算6种大豆异黄酮各成分峰面积的RSD值。
5)重复性试验 精密称取腐竹样品粉末0.2 g,共6份,按1.3.1样品溶液的处理方法制备后,精密吸取10 μL按1.3.3色谱条件进样,记录262 nm下的色谱图,测定峰面积。采用一测多评分析方法,大豆苷的含量按外标法进行测定,再结合相对校正因子,按如下公式3计算样品中另外5种大豆异黄酮的含量[17]。

式(3)中:Wk为内参物k的质量浓度;Ak为内参物k的峰面积;Wm为待测成分m的质量浓度;Am为待测成分m的峰面积。

6)加样回收率试验 精密称取适量已测定含量的样品粉末6份,分别加入一定量的大豆苷、黄
1.3.5 耐用性试验 在1.3.3色谱条件下,改用安捷伦和沃特世的高效液相色谱仪以及UltimateAQC18(4.6 mm×250 mm,5 μm),Kromasil C18(4.6 mm×250 mm,5 μm)色谱柱,进行测定,记录 262 nm 下的色谱图,测定峰面积,计算以大豆苷为内参物,对于黄豆黄苷、染料木苷、大豆苷元、黄豆黄素和染料木素的相对校正因子,考察3个不同品牌的高效液相色谱仪以及3根不同品牌的色谱柱对其相对校正因子的影响。
在1.3.3色谱条件下,改变流量(0.9,1.0,1.1,1.2 mL/min)和柱温(25, 30, 35 ℃),进行测定,记录262 nm下的色谱图,测定峰面积,计算以大豆苷为内参物,对于黄豆黄苷、染料木苷、大豆苷元、黄豆黄素和染料木素的相对校正因子,考察流速和温度对其相对校正因子的影响。
1.3.6 系统适应性试验 按照1.3.5的步骤,记录262 nm和248 nm下的色谱图,测定峰面积。并记录262 nm下6种大豆异黄酮的保留时间,然后以大豆苷为内参物,计算对黄豆黄苷、染料木苷、大豆苷元、黄豆黄素和染料木素的相对保留时间。
1.3.7 验证比对 精密吸取样品溶液、混合对照品溶液以及单一大豆苷对照品溶液各10 μL,分别注入高效液相色谱仪,按1.3.3色谱条件测定,记录色谱图,测定峰面积。分别采用外标法和一测多评法计算待测样品中的6种大豆异黄酮含量。并将常规的外标法实测含量与一测多评计算的含量采用夹角余弦值进行比较,公式如式(5),验证建立的一测多评分析方法的准确性[19]。豆黄苷、染料木苷、大豆苷元、黄豆黄素和染料木素对照品溶液,按1.3.2样品溶液的处理方法制备加标样品后,分别精密吸取10 μL注入高效液相色谱仪中,按1.3.3色谱条件测定,记录262 nm下的色谱图,测定峰面积。按如下公式计算加样回收率[18]。
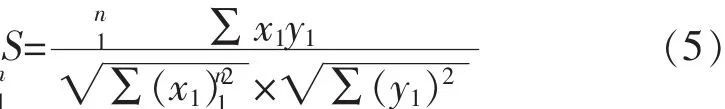
对建立的一测多评分析方法进行应用与验证时,按如下公式6计算两种方法的相对误差。

2 结果与分析
2.1 一测多评方法的建立
2.1.1 色谱条件的优化 6种大豆异黄酮的甲醇溶液在200~400 nm进行紫外波长下扫描,结果发现异黄酮分别在208、248、262 nm处出现明显吸收峰(图1)。为了减少溶剂的干扰的影响,选用262 nm作为HPLC检测波长。同时为了较好地识别待测色谱峰,选用248 nm作为辅助的检测波长。
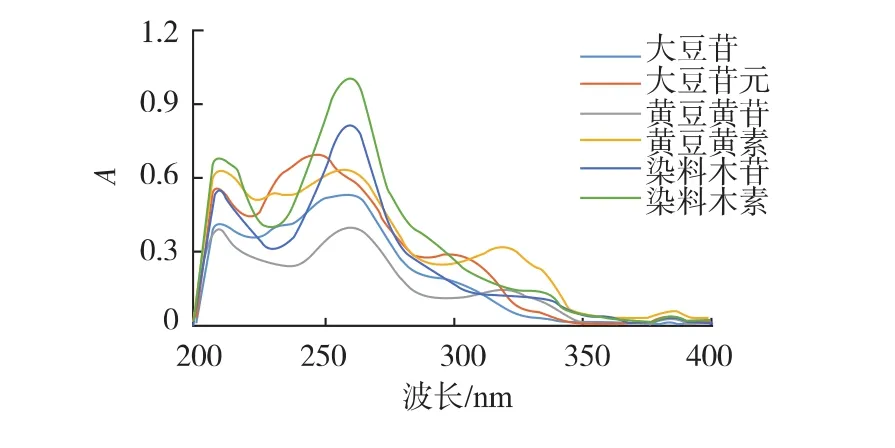
图1 6种大豆异黄酮的紫外光谱图Fig.1 Ultraviolet spectra of six soybean isoflavones
周光明等人[20]在测定绿豆芽4种大豆异黄酮含量时,液相色谱条件采用的流动相为A:体积分数0.2%甲酸水溶液,B:乙腈;洗脱程序为:0~10 min,B:5%~80%;10~16 min,B:80%;16~22 min,B:80%~5%。于寒松等人[8]在测定12种大豆异黄酮时,液相色谱条件采用的流动相为A:体积分数0.1%乙酸水溶液,B:体积分数0.1%乙酸的乙腈溶液。洗脱程序为:0~80 min,B:体积分数13%~40%。作者参考了上述的色谱条件,并设计了3组洗脱程序(见实验方法1.3.3)。考虑到大豆及其制品中存在较多的水溶性成分,可能对待测目标成分形成干扰,因此控制待测目标成分在10 min后出峰。其中洗脱程序(2)可以较好的分离所测的6个大豆异黄酮,且分析所需的总时间较短,可在35 min内同时检测6个目标大豆异黄酮,优于另外两个洗脱程序。
经优化后,确定高效液相色谱分析条件如下:色谱仪:岛津LC-20A高效液相色谱仪;色谱柱:Inertsil ODS-SP C18(4.6 mm×250 mm,5 μm);流动相:A为体积分数0.2%甲酸水溶液,B为甲醇;洗脱程序如下;流量为 1.0 mL/min;进样量 10 μL;柱温为30℃;检测波长:262 nm和248 nm。
2.1.2 线性关系 对6个梯度质量浓度的混合对照品溶液进行HPLC分析,色谱图如图2所示。以对照品溶液的质量浓度为横坐标,峰面积为纵坐标,绘制标准曲线,得到6种大豆异黄酮对照品的回归方程,见下表1。分析结果表明,大豆苷、黄豆黄苷、染料木苷、大豆苷元、黄豆黄素和染料木素在各自的线性范围内均具有良好的线性关系(R2>0.999 9)。
2.1.3 相对校正因子 按实验方法1.3.3进行大豆异黄酮对照品的混标分析,根据公式1计算以大豆苷为内参物,对黄豆黄苷、染料木苷、大豆苷元、黄豆黄素和染料木素的相对校正因子[21],结果如下表2所示。在262 nm检测波长下,相对校正因子分别为f大豆苷/黄豆黄苷=1.078 6,f大豆苷/染料木苷=1.918 5,f大豆苷/大豆苷元=1.897 2,f大豆苷/黄豆黄素=3.070 0,f大豆苷/染料木素=3.168 4,其相对标准偏差RSD分别为1.10%、1.85%、1.76%、1.40%和0.56%,RSD均<2.0%,表明实验结果平行性较好[22]。
2.1.4 精密度 对同一混合对照品溶液进行精密度试验,结果显示大豆苷、黄豆黄苷、染料木苷、大豆苷元、黄豆黄素和染料木素RSD值分别为0.90%、0.90%、0.88%、0.85%、0.87%和 1.12%, 表明本方法精密度良好。
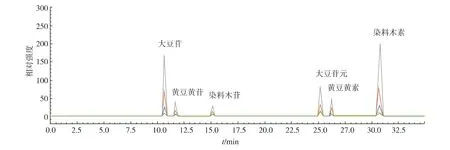
图2 6个质量浓度梯度的混合对照品色谱图Fig.2 HPLC analysis of six soybean isoflavones with different concentrations
2.1.5 稳定性 对同一混合对照品溶液进行稳定性试验,结果显示大豆苷、黄豆黄苷、染料木苷、大豆苷元、黄豆黄素和染料木素RSD值分别为1.71%、1.63%、1.81%、1.75%、1.88%和 1.08%,表明该样品在24 h内保持稳定。
2.1.6 重复性 以腐竹为待测样品进行重复性试验,采用外标法测定腐竹中大豆苷的含量,一测多评法测定其它5种大豆异黄酮的含量。结果显示大豆苷、黄豆黄苷、染料木苷、大豆苷元、黄豆黄素和染料木素 RSD值分别为 1.13%、2.05%、2.05%、2.02%、2.19%和2.23%,表明本方法重复性良好。
2.1.7 加样回收率 大豆苷、黄豆黄苷、染料木苷、大豆苷元、黄豆黄素和染料木素的加样回收率分别为 102.71% 、99.57% 、100.24% 、97.36% 、99.35% 和98.14%,其 RSD分别为 0.42%,0.38%、1.64%、1.49%、2.20%和0.52%,结果表明方法的加样回收率良好。
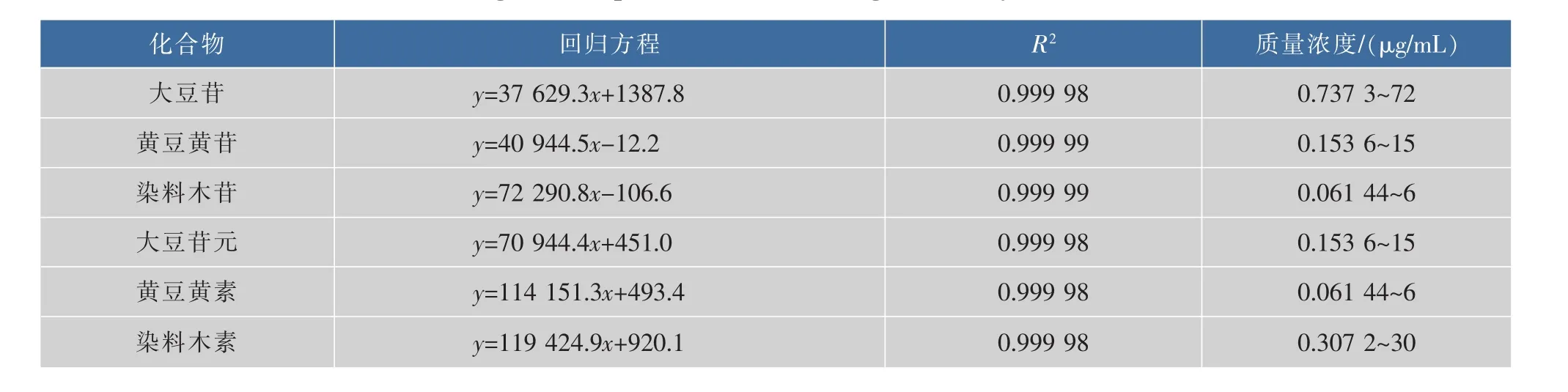
表1 6种大豆异黄酮的回归方程及线性范围(262 nm)Table 1 Regressive equations and liner range of six soybean isoflavones

表2 大豆苷对其他5种大豆异黄酮的校正因子Table 2 RCF of daidzein to 5 other soybean isoflavones
2.2 耐用性和系统适应性评价
2.2.1 不同色谱柱及高效液相色谱仪考察 分析不同品牌液相和不同色谱柱下,大豆异黄酮之间的相对校正因子,结果如表3所示。大豆苷对于其他5种大豆异黄酮的相对校正因子的平均值为f大豆苷/黄豆黄苷=1.114 1,f大豆苷/染料木苷=1.950 0,f大豆苷/大豆苷元=1.876 4,f大豆苷/黄豆黄素=3.083 7,f大豆苷/染料木素=3.257 4,其RSD值分别为 2.26%、1.83%、2.22%、2.66%、和2.77%,均小于3%,表明本方法适用范围广,可适用于不同的仪器和色谱柱,便于推广应用。
2.2.2 流量与柱温的考察 不同流量的条件下对6种大豆异黄酮进行HPLC分析,计算大豆苷对于其他5种大豆异黄酮的相对校正因子的RSD值,分别为0.06%、0.14%、0.14%、0.12%和0.25%;在不同温度的条件下HPLC分析发现,5种大豆异黄酮的相对校正因子RSD值分别为0.15%、0.06%、0.15%、0.13%和0.21%。实验结果表明,HPLC分析时的流量、柱温对6种大豆异黄酮的一测多评分析中相对校正因子的影响极小。
2.2.3 大豆异黄酮色谱峰的指认 在仅使用1个对照品时,如何指认待测样中其他5种大豆异黄酮的色谱峰是影响一测多评法高效性、准确性的关键。目前,一测多评分析过程中通常采用相对保留时间差、光谱相关色谱进行色谱峰指认[14]。作者通过计算大豆异黄酮与内参物大豆苷的相对保留时间,以及262、248 nm下色谱峰面积的比值,从而判断其他5种待测大豆异黄酮色谱峰的准确位置。
在改变仪器型号、色谱柱型号、流量、柱温等条件下,分别考察相对保留值和保留时间差在不同品牌仪器和不同品牌色谱柱中的重现性。结果发现保留时间差的波动较为明显,相对保留值的波动相对较小,采用相对保留值法进行大豆异黄酮类成分色谱峰的定位较为可行。在3个不同品牌高效液相色谱仪和3根不同品牌色谱柱的条件下,其他5种大豆异黄酮对于大豆苷的相对保留时间分别为T黄豆黄苷/大豆苷=1.10,T染料木苷/大豆苷=1.38,T大豆苷元/大豆苷=2.32,T黄豆黄素/大豆苷=2.47,T染料木素/大豆苷=2.85,如下表 4 所示。 在不同流量条件下,其相对保留时间分别为1.10、1.43、2.41、2.51和2.93。在不同温度条件下,其相对保留时间分别为 1.09、1.42、2.34、2.44 和 2.88。在检测条件变动情况下,相对保留时间的RSD均<5%,表明改变这些条件对其相对保留时间的影响不大。
另外,在双波长的检测条件下,大豆苷、黄豆黄苷、染料木苷、大豆苷元、黄豆黄素、染料木素的平均相对峰面积比值 A262/248分别为 0.95、1.20、1.42、0.76、1.08 和 1.50,如下表 5 所示。因此,可以在相对保留时间基础上,参照双波长下的峰面积比值对大豆异黄酮的色谱峰进行准确指认。

表3 不同品牌液相和不同色谱柱测得的相对校正因子Table 3 RCF of daidzein to 5 other soybean isoflavones in different HPLC instruments and columns
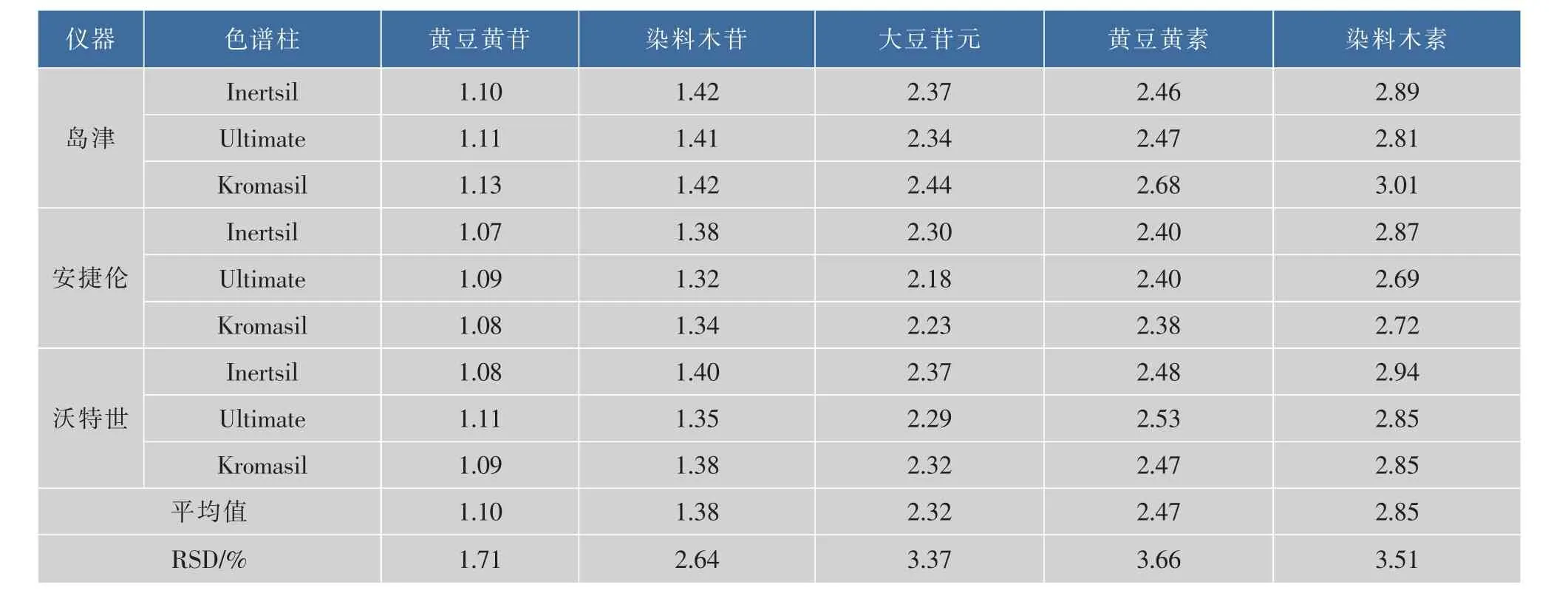
表4 不同仪器色谱柱测得的相对保留时间Table 4 Relative retention time in different instruments and columns
2.3 一测多评法准确性评价
以6份腐竹提取液为待测样品,分别采用外标法和一测多评法测定提取液中6种大豆异黄酮的含量,结果分别如表6所示。计算其他5种大豆异黄酮的一测多评计算含量与外标法实测含量的夹角余弦值,分别为0.999 98,1.000 00,0.999 99,0.999 98和0.999 99,表明2种方法测得的含量没有显著性差异,所建立的一测多评分析方法有良好的准确性。

表5 262 nm与248 nm波长下峰面积的比值Table 5 Peak area ratio of 262 nm to 248 nm
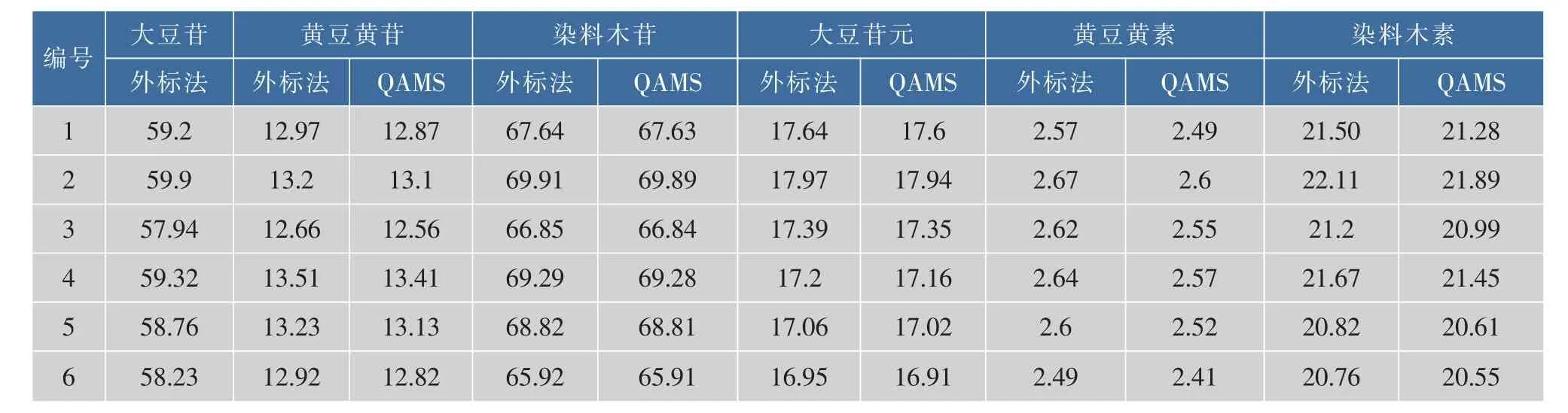
表6 外标法与一测多评法测定腐竹中6种异黄酮的质量分数Table 6 Contents of six isoflavones in yuba determined by external standard method and QAMS (μg/g)
2.4 一测多评法的再验证与应用
对腐竹、豆腐干、千张、大豆和豆腐等豆制品提取液进行HPLC分析,采用一测多评法计算6种大豆异黄酮的含量,结果见图3。此外,采用外标法计算和验证5种豆制品中大豆异黄酮的含量,按公式6计算两种测定方法下的相对误差,结果显示黄豆黄苷的测定相对误差为0.06%~1.43%,染料木苷的测定相对误差为0.57~3.65%,大豆苷元的测定相对误差为0.95%~3.72%,黄豆黄素的测定相对误差为0.85%~3.95%,染料木素的测定相对误差为0.07%~2.74%。参考周园等的研究[23],比较一测多评法与外标法的相对误差小于5%,说明建立的一测多评分析方法测定结果具有较高的准确性和可信度。
对选取的豆制品中大豆异黄酮含量测定结果表明,豆制品中大豆异黄酮以染料木苷、大豆苷为主,异黄酮苷元含量相对较低,豆腐干中大豆异黄酮的含量高于其他豆制品。研究表明,大豆异黄酮在加工过程中不同组分间易发生转化,如加热导致大豆异黄酮苷分解成苷元[8]。此外,不同气候、产地等因素,也是导致豆制品原料中大豆异黄酮含量差异的重要因素。目前,国内对豆制品中不同大豆异黄酮的定量分析不多,系统评价日常膳食中大豆异黄酮的含量,是分析居民大豆异黄酮日摄入量与健康相关性的重要数据基础,而一测多评分析技术可极大促进膳食营养素、功能因子的含量测定。

图3 一测多评法测定豆制品中大豆异黄酮的质量分数Fig.3 Contents of soybean isoflavones in bean products determined by QAMS
3 结 语
膳食中的天然功能因子,如黄酮、酚酸等,许多以系列衍生物的形式存在,具有结构共性和差异性。通过分析黄豆苷元、黄豆苷、染料木素、染料木苷、黄豆黄素、黄豆黄苷等6种大豆异黄酮在高效液相色谱行为学上的差异,基于它们的结构共性,寻找在色谱行为学及光谱学上的内在联系,研究建立了6种大豆异黄酮的一测多评方法。通过大量实验数据建立了6种大豆异黄酮间的相对校正因子(262 nm,f大豆苷/黄豆黄苷=1.114 1,f大豆苷/染料木苷=1.950 0,f大豆苷/大豆苷元=1.876 4,f大豆苷/黄豆黄素=3.083 7,f大豆苷/染料木素=3.257 4),以相对保留时间(T黄豆黄苷/大豆苷=1.10,T染料木苷/大豆苷=1.38,T大豆苷元/大豆苷=2.32,T黄豆黄素/大豆苷=2.47,T染料木素/大豆苷=2.85)和相对峰面积(A262/248分别为 0.95,1.20,1.52,0.83,1.08,1.50)对大豆异黄酮的色谱峰进行了准确指认。
对建立的一测多评方法进行了方法学验证,研究表明本方法精密度高,供试品稳定良好,结果重复性及加样回收率高,耐用性和系统适应性均表现良好,在不同型号仪器、色谱柱、流量、柱温等条件下均可进行,便于推广。对日常豆制品中异黄酮含量进行测定,结果表明一测多评法测定结果与外标法结果相对误差小,所建立的一测多评法测定结果准确,可用于大豆异黄酮的快速定量分析及相关产品的质量评价。

