葡萄籽原花青素对顺铂诱导小鼠睾丸支持细胞TM4细胞凋亡的影响
杜月梅,韩何丹,郭卓雨,高丽萍,*
(1.北京联合大学生物化学工程学院,北京 100023;2.生物活性物质与功能食品北京市重点实验室,北京 100191)
顺铂(cisdichlorodiamineplatinum (II),cDDP)是最有效的抗肿瘤药物之一[1-3],广泛应用于多种肿瘤的治疗[4],如睾丸癌、肝癌、肺癌、卵巢癌、乳腺癌、食道癌等[5-8],但由于对人体众多器官具有毒副作用[9-11],因此,限制了它在医疗方面的应用。研究表明,cDDP的不良反应主要为对睾丸损伤及肾毒性[12-13],更有甚者,许多男性使用者出现了不育的症状,cDDP诱发睾丸细胞凋亡参与cDDP对睾丸的损伤作用[14]。
葡萄籽原花青素(grape seed proanthocyanidin extract,GSPE)是从葡萄籽中分离提取出的一种天然的具有生物类黄酮活性的多酚化合物[15],具有抗炎、抗肿瘤、保护心血管系统、抗辐射、抗衰老等广泛的作用[16-17]。其中,由于其结构中含有多个酚羟基,更使得它能有效清除氧化物和自由基,表现出极好的抗氧化作用。除此之外,GSPE在抗肿瘤方面也备受社会关注[16],研究表明,GSPE可以诱导多种癌细胞凋亡[18-20]。
本课题组前期研究结果表明,GSPE对cDDP所导致的生殖毒性及肾毒性具有较好的保护作用,GSPE可显著抑制cDDP诱导TM4细胞氧化损伤作用[21-23],而对TM4细胞凋亡的研究鲜见报道,因此本研究运用cDDP造模,通过测定GSPE对cDDP所致TM4细胞凋亡及凋亡相关蛋白Bax、Bcl-2、Caspase-3表达量的影响,探究GSPE对cDDP所致TM4细胞凋亡的影响及其可能的作用机制。以期为GSPE应用于临床提供实验依据,为男性癌症患者提供有效的化疗辅助品及减少cDDP应用于临床化疗的局限性。
1 材料与方法
1.1 材料与试剂
TM4正常小鼠睾丸支持细胞,由中国协和医科大学提供。
葡萄籽原花青素提取物 天津尖峰天然产物研究开发有限公司;新生牛血清及DMEM/F12培养液 美国Gibco公司;胰蛋白酶、噻唑蓝 美国Sigma公司;兔抗Bcl-2(N19)多克隆抗体、兔抗Bax(P-19)多克隆抗体、兔抗Caspase-3(H-277)多克隆抗体 中杉金桥生物技术公司;辣根过氧化物酶标记山羊抗兔免疫球蛋白(immunoglobulin,Ig)G(H+L) 北京鼎国昌盛生物技术有限公司;BCA蛋白浓度测定试剂盒 南京碧云天生物研究所;Annexin V-FITC细胞凋亡检测试剂盒北京宝赛生物技术有限公司;高效化学发光(efficient chemiluminescence,ECL)试剂盒 美国Genview公司;其他试剂均为分析纯。
1.2 仪器与设备
FACS Calibar流式细胞仪 美国BD公司;电泳仪美国Bio-Rad公司;ImageQuant RT ECL凝胶成像系统美国通用电气公司。
1.3 方法
1.3.1 TM4细胞培养
将细胞孵育在DMEM/F12(含10%新生牛血清、1%青霉素-链霉素)的混合培养基中,并置于37 ℃,5% CO2培养箱中进行培养。当细胞融合至80%~90%时,用胰酶消化,按照1∶2的比例进行传代培养,选择对数生长期的细胞进行实验。
1.3.2 cDDP对TM4细胞生长的影响
将细胞(1×105个/mL)接种于96 孔板,每孔200 μL。待细胞生长到融合状态,弃掉培养液,每孔加入200 μL含不同终质量浓度cDDP(0(空白对照组)、0.000 75、0.001 5、0.003、0.006、0.012、0.048、0.096、0.192 mg/mL)的无血清培养基。每组设置6 个平行,培养24 h后,弃掉培养液,各孔加入200 μL终质量浓度为0.5 mg/mL噻唑蓝,继续孵育4 h后,弃废液并加入二甲基亚砜(150 μL/孔),充分混匀10 min,用酶标仪检测其吸光度(测定波长570 nm、参比波长630 nm)。以不加cDDP为空白对照,按式(1)计算细胞抑制率。依据抑制率计算cDDP对TM4细胞的半数抑制浓度(half maximal inhibitory concentration,IC50),并作为后续实验参照依据。

式中:A1为实验组上清液的吸光度;A0为空白对照组上清液的吸光度。
1.3.3 GSPE对TM4细胞生长的影响
同1.3.2节的方法,将cDDP换成不同质量浓度的GSPE(0(空白对照)、0.001、0.005、0.010、0.020、0.050、0.100、0.200、0.500、1.000、1.500、2.000 mg/mL),计算细胞存活率。
1.3.4 GSPE对cDDP诱导TM4细胞毒性的保护作用
将200 μL(1×105个/mL)TM4细胞接种至96 孔板,待细胞生长至融合状态时,设定空白对照组(加入同等体积无血清培养液);cDDP模型组(0.014 mg/mL);GSPE+cDDP实验组(加cDDP前2 h加入不同终质量浓度GSPE,使GSPE终质量浓度分别为:0.001、0.005、0.010、0.020、0.050、0.100、0.200、0.250 mg/mL;cDDP终质量浓度为0.014 mg/mL),于37 ℃、含5% CO2孵育培养箱中培养24 h,采用噻唑蓝法测定吸光度,计算GSPE对CDDP所致TM4细胞存活率变化量,每组6 个复孔。
1.3.5 TM4细胞凋亡率的检测
按照1.3.4节结果将细胞分成4 个组:TM4空白对照组(即仅使用不含牛血清的DMEM/F12培养基培养细胞);cDDP模型组(0.014 mg/mL);GSPE+cDDP实验组(0.005 mg/mL+0.014 mg/mL);GSPE对照组(0.005 mg/mL)。在37 ℃、5% CO2培养箱中培养24 h后,收集各实验组细胞,按照试剂盒的说明,经Annexin V-FITC和碘化丙啶(propidium iodide,PI)染色后,用流式细胞仪检测分析。
1.3.6 TM4细胞凋亡形态学的测定
根据1.3.1节和1.3.5节所述的方法进行细胞培养、实验分组和对细胞进行药物处理后,将其置于37 ℃、5% CO2培养箱中培养24 h,待细胞长至80%左右时将细胞进行固定,应用Hoechst染色,用显微成像系统拍摄和保存图像,比较各组细胞生长形态的差异。
1.3.7 Western blot蛋白印迹法对TM4细胞凋亡基因的测定
提取并收集各实验组细胞蛋白,采用BCA法测定蛋白含量。取总蛋白50 μg进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)和转膜。按100 V恒浓缩胶电压,120 V恒分离胶电压进行电泳。用100 V恒压、冰浴转膜1.5 h,PBST清洗后,5%脱脂奶粉室温封闭1 h,再用PBST洗3 次,加入一抗(1∶1 000)4 ℃孵育过夜,PBST洗3 次后加入二抗(1∶10 000)室温孵育2 h,再用PBST洗3 次,ECL应用液显影,拍照,以β-actin(1∶500)为内参,用凝胶图像分析软件扫描,测定蛋白条带的灰度。按式(2)计算蛋白相对表达量。

1.4 数据统计分析
实验所得数据采用SPSS 17.0软件进行统计分析,数据以±s表示,分别测定cDDP、GSPE对TM4细胞的IC50,并应用单因素方差分析进行多组间比较(检验水平α=0.01),两两比较采用Dunnett-t检验,剂量依赖效应分析采用重复测量方差分析,P<0.01表示差异极显著。
2 结果与分析
2.1 cDDP对TM4细胞生长的抑制作用

图 1 cDDP对TM4细胞的毒性作用Fig. 1 Cytotoxic effect of cDDP on TM4 cells
用不同质量浓度的cDDP处理TM4细胞24 h,如图1所示,随着cDDP终质量浓度的增大,对TM4细胞的抑制率逐渐升高,各质量浓度cDDP对TM4细胞抑制率与空白对照组相比,差异均有统计学意义(P<0.01)。cDDP对TM4细胞IC50为(0.014 0±0.000 3)mg/mL,因此选择0.014 mg/mL质量浓度的cDDP用于后续实验。
2.2 GSPE对TM4细胞生长的影响

图 2 GSPE对TM4细胞存活率的影响Fig. 2 Effect of GSPE on survival rate of TM4 cells
如图2所示,随GSPE终质量浓度的升高,TM4细胞存活率逐渐增高,在GSPE终质量浓度为0.010 mg/mL时,TM4细胞存活率达到最高,此后随GSPE终质量浓度增加,TM4细胞存活率逐渐降低。当GSPE终质量浓度高于0.500 mg/mL时,TM4细胞存活率显著低于空白对照组,即高质量浓度GSPE对TM4细胞生长具抑制作用。不同终质量浓度GSPE对TM4细胞存活率与空白对照组(GSPE终质量浓度为0 mg/mL)相比,存在极显著差异(P<0.01)。由此数据计算得到GSPE单独作用24 h对TM4细胞的IC50为(0.956 0±0.001 2)mg/mL。
2.3 GSPE对cDDP诱导TM4细胞毒性的保护作用
用终质量浓度为0.014 mg/mL的cDDP建立TM4细胞损伤模型,用不同终质量浓度的GSPE提前24 h处理TM4细胞。结果如图3所示,与cDDP模型组对比,cDDP+GSPE组细胞存活率极显著提高(P<0.01),但随着GSPE质量浓度的升高,细胞存活率先升高后降低。这表明cDDP对TM4细胞有明显的抑制作用,而在一定质量浓度范围内,GSPE对cDDP所致细胞损伤具有明显的保护作用,0.005 mg/mL的GSPE保护效果最佳。

图 3 GSPE对cDDP诱导TM4细胞毒性的保护作用Fig. 3 Protective effect of GSPE against cDDP-induced cytotoxicity on TM4 cells
2.4 各组TM4细胞凋亡率变化


图 4 各组TM4细胞凋亡率的变化Fig. 4 Changes in TM4 cell apoptosis rate in each group
组别 早期凋亡率/% 中晚期凋亡率/% 死亡率/%

表 1 GSPE对cDDP诱导TM4细胞凋亡率的影响Table 1 Effect of GSPE on cisplatin-induced apoptosis of TM4 cells
由图4和表1可知,cDDP可造成TM4细胞各时期凋亡率及死亡率升高,与空白对照组相比较具有极显著性差异;若细胞先经GSPE提前作用2 h,再由cDDP诱导作用24 h,则此时TM4细胞凋亡率增高的程度明显降低,表明终质量浓度为0.005 mg/mL的GSPE对0.014 mg/mL的cDDP所诱导TM4细胞凋亡具有很好的拮抗作用,对TM4细胞起到保护作用,提示GSPE可能参与调控cDDP诱导的TM4细胞的凋亡途径。
2.5 各组TM4细胞凋亡形态变化
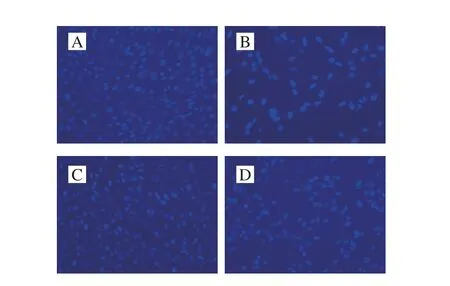
图 5 GSPE对cDDP诱导TM4细胞凋亡Hoechst染色形态变化(×100)Fig. 5 Effect of GSPE on cDDP-induced morphological changes of TM4 cells evaluated by Hoechst staining (× 100)
由图5可知,空白对照组细胞呈疏散状,发出均匀荧光,荧光亮度较浅,呈浅蓝色;cDDP模型组多数细胞变圆、与临近细胞相分离,大量细胞已脱壁,贴壁细胞数目明显减少,细胞核出现致密浓染的颗粒状高亮荧光物,荧光强度与正常细胞相比较明显增强,凋亡细胞明显增多;GSPE对照组细胞贴壁紧密,细胞呈均匀浅蓝色荧光,其染色形态与空白对照组相似,无明显变化;GSPE+cDDP实验组细胞脱壁现象较cDDP模型组明显减少,细胞多数贴壁生长,胞体变圆现象远少于cDDP模型组,与cDDP模型组相比较细胞核出现致密浓染的颗粒状荧光明显减少。结果表明,终质量浓度为0.005 mg/mL的GSPE对0.014 mg/mL的cDDP所诱导TM4细胞凋亡形态学改变具有很好的拮抗作用。
2.6 各组TM4细胞凋亡相关蛋白表达的变化

图 6 GSPE对cDDP所致TM4细胞各蛋白表达量的影响Fig. 6 Effect of GSPE on apoptosis-related protein expression in cDDP-induced TM4 cells

图 7 GSPE对cDDP诱导的TM4细胞内Bcl-2相对表达量的影响Fig. 7 Effect of GSPE on cDDP-induced relative expression of Bcl-2 in TM4 cells
如图6、7所示,终质量浓度为0.014 mg/mL的cDDP作用于TM4细胞24 h后,细胞内Bcl-2相对表达量(28.91±1.07)%与空白对照组(52.30±3.14)%相比显著降低(P<0.01);若细胞先经GSPE提前作用2 h,再由cDDP诱导作用24 h,则此时细胞内Bcl-2相对表达量((38.43±1.12)%)与cDDP模型组相比极显著升高(P<0.01);0.005 mg/mL的GSPE单独作用于TM4细胞,其细胞内Bcl-2相对表达量(54.92±2.81)%与正常TM4细胞内Bcl-2相对表达量不存在显著性差异。
如图6、8所示,终质量浓度为0.014 mg/mL的cDDP作用于TM4细胞24 h后,细胞内Bax相对表达量(73.82±4.53)%与空白对照组(10.73±0.26)%相比极显著增高(P<0.01);若细胞先经GSPE提前作用2 h,再由cDDP诱导作用24 h,则此时细胞内Bax相对表达量(36.44±3.13)%与cDDP模型组相比极显著降低(P<0.01);0.005 mg/mL的GSPE单独作用于TM4细胞,其细胞内Bax相对表达量((9.75±1.42)%)与正常TM4细胞内Bax相对表达量不存在显著性差异。

图 8 GSPE对cDDP诱导的TM4细胞内Bax相对表达量的影响Fig. 8 Effect of GSPE on cDDP-induced relative expression of Bax in TM4 cells

图 9 GSPE对cDDP诱导的TM4细胞内Pro-caspase 3相对表达量的影响Fig. 9 Effect of GSPE on cDDP-induced relative expression of pro-caspase 3 in TM4 cells
如图6、9所示,终质量浓度为0.014 mg/mL的cDDP作用于TM4细胞24 h后,细胞内Pro-caspase 3相对表达量(31.13±0.94)%与空白对照组(70.21±2.82)%相比极显著降低(P<0.01);若细胞先经GSPE提前作用2 h,再由cDDP诱导作用24 h,则此时细胞内Pro-caspase 3相对表达量(40.36±2.43)%与cDDP模型组相比极显著升高(P<0.01);0.005 mg/mL的GSPE单独作用于TM4细胞,其细胞内Pro-caspase 3相对表达量((74.93±3.25)%)与正常TM4细胞内Bax相对表达量不存在显著性差异。
如图6、10所示,终质量浓度为0.014 mg/mL的cDDP作用于TM4细胞24 h后,细胞内Caspase-3相对表达量(27.35±1.54)%与空白对照组(13.76±0.71)%相比极显著增高(P<0.01);若细胞先经GSPE提前作用2 h,再由cDDP诱导作用24 h,则此时细胞内Caspase-3相对表达量(15.64±0.86)%与cDDP模型组相比极显著降低(P<0.01);0.005 mg/mL的GSPE单独作用于TM4细胞,其细胞内Caspase-3相对表达量((14.37±0.33)%)与正常TM4细胞内Caspase-3相对表达量不存在显著性差异。

图 10 GSPE对cDDP诱导的TM4细胞内Caspase-3蛋白相对表达量的影响Fig. 10 Effect of GSPE on cDDP-induced relative expression of caspase-3 protein in TM4 cells

表 2 GSPE对cDDP诱导TM4细胞凋亡相关蛋白表达的影响Table 2 Effects of GSPE on the expression of apoptosis-related proteins in TM4 cells induced by cDDP
表2为GSPE对cDDP诱导的TM4细胞各蛋白表达变化情况,实验结果表明,GSPE(0.005 mg/mL)可有效拮抗cDDP(0.014 mg/mL)诱导TM4细胞细胞凋亡,显著增强Bcl-2、Pro-caspase 3表达,极显著抑制Bax、Caspase-3表达(P<0.01);0.005 mg/mL GSPE单独作用于TM4细胞,其细胞内各基因表达量与正常TM4细胞内基因表达量均不存在显著性差异。
3 讨 论
本研究结果显示,当GSPE终质量浓度浓度为0.005 mg/mL时,对cDDP诱导的TM4细胞毒性有明显的抑制作用,而其他研究结果表明,cDDP可能通过氧化应激的形式对睾丸支持细胞造成损伤[24]。当睾丸支持细胞出现基因缺陷时,精子无法正常生成[25],从而造成男性不育的症状。cDDP所造成的细胞毒性最终可以引起细胞凋亡和胀亡[22]。本研究结果也显示,cDDP可显著促进TM4细胞的凋亡。
细胞凋亡是由多基因调控和多个分子参与的复杂有序的过程,细胞是否发生凋亡与某些凋亡相关基因的表达密切相关。cDDP可通过引起细胞氧化损伤,诱发细胞毒性,启动线粒体途径和死亡受体途径而引起细胞凋亡[26]。在线粒体凋亡途径中,Bcl-2和Caspase家族发挥着重要的调控作用。Bcl-2家族是对Caspases激活进行调控的一类重要蛋白因子,根据功能分为两类:一类是抑制细胞凋亡的蛋白,如Bcl-XL、Bcl-2;另一类是促进细胞凋亡的蛋白,如Bax等。Bcl-2属原癌基因,编码26×103的线粒体膜蛋白,是最重要的凋亡抑制基因[27]。Bax与Bcl-2蛋白相对表达量的比值是调节细胞凋亡的关键[28],其比值增加将会促进细胞的凋亡。研究发现,cDDP是先诱导Bax分子激活,再使线粒体膜通透性增加,线粒体释放细胞色素c、激活Caspase 9,从而启动线粒体介导的凋亡[29]。在诱导凋亡作用下,Bax构象发生改变,疏水部分暴露,使其从胞浆转移至线粒体,Bax寡聚化在线粒体外膜上形成小孔,使细胞色素c释放,后者激活Caspases,从而诱发细胞凋亡。而Bcl-2可通过阻止Bax从胞浆到线粒体转移而拮抗Bax的功能抑制细胞凋亡[30]。有研究显示,Bcl-2表达量增多时可显著抑制cDDP诱导的细胞凋亡。Caspases是近年来发现的一组存在于胞质溶胶中结构上相关的半胱氨酸蛋白酶,是p38MAPK实现诱导凋亡的重要细胞因子[31],其中活化型Caspase-3是caspase家族参与诱导细胞凋亡的Caspase级链反应最终效应子,是各种凋亡刺激因子激活Caspase家族中的关键蛋白酶[32]。cDDP诱发细胞凋亡致使Caspase-3活性增强[33]。通常情况下,Caspase-3处于抑制状态,即以没有活性的酶原形式Pro-caspase 3存在于胞浆中,而当细胞遭受损伤时,Caspase-3则会被激活而导致细胞发生凋亡,此时酶原状态Pro-caspase 3的量则减少。
GSPE是具有生物类黄酮活性的一大类多酚化合物,是国际公认的最能有效清除体内自由基的天然多酚类物质,由不同数量的黄烷-3-醇单元(即由(表)儿茶素、表棓儿茶素或表儿茶素没食子酸酯)缩合而成。微核实验(实验小鼠每日摄入2 000 mg/(kgmb·d)GSPE)和Ames实验(实验菌株中GSPE含量为500 μg/平板)结果显示,GSPE无致畸和致突变性[34-35]。除此之外,GSPE对多种癌细胞都有不同程度的抑制作用,例如,GSPE不仅可以抑肺癌、乳腺癌、前列腺癌、口腔上皮癌和慢性骨髓白血病等多种类型肿瘤细胞生长,还可以诱导肿瘤细胞凋亡。而且,GSPE还具有抗正常细胞凋亡的作用,主要应用于细胞过度凋亡导致的细胞减少性疾病,如心肌缺血再灌注损伤、神经退行性疾病阿尔茨海默病等。本实验室前期已研究证明GSPE可通过调节机体抗氧化系统拮抗cDDP对TM4细胞的氧化损伤作用,本研究则从细胞凋亡角度进一步探究GSPE对cDDP所致TM4细胞毒性作用的影响,研究结果显示GSPE可明显抑制cDDP诱发的小鼠睾丸支持细胞凋亡,同时cDDP单独用药后,TM4细胞内Bcl-2相对表达量以及处于酶原状态Pro-caspase 3的相对表达量显著降低,而Bax和处于激活状态的Caspase-3相对表达量明显增加,提示Bcl-2、Bax、Caspase-3等基因参与cDDP诱导TM4细胞凋亡,细胞凋亡在cDDP诱导TM4细胞毒性过程中起重要作用。GSPE拮抗因cDDP诱导的细胞凋亡其确切的分子机制目前仍不明确,其中一个可能的解释即为GSPE对凋亡相关基因表达的影响。本研究结果显示GSPE可明显降低Bax以及Caspase-3的蛋白表达量,增加Bcl-2和Pro-caspase 3的蛋白表达量,阻抑cDDP诱导TM4细胞的凋亡。
综上所述,GSPE提前作用TM4细胞后,对cDDP诱导的细胞毒性损伤有保护作用,其机制可能通过上调Bcl-2蛋白表达、下调Bax及Caspase-3的蛋白表达,从而发挥抗细胞凋亡作用而实现的。

