斑马鱼miR-196a-1基因敲除品系的构建
曾 婷,付贵芳,谢缤灵,杜 涵,谢华平,3*,印遇龙,3,4
(1.动物肠道功能调控湖南省重点实验室, 长沙 410081; 2.湖南师范大学生命科学学院, 动物营养与人体健康实验室, 长沙 410081; 3.淡水鱼类发育生物学国家重点实验室, 长沙 410081; 4.中国科学院亚热带农业生态研究所, 中国科学院亚热带农业生态过程重点实验室, 长沙 410125)
斑马鱼(Daniorerio),俗称“zebrafish”,属硬骨鱼类,原产印度和孟加拉,为一种性情温和、杂食性的热带淡水鱼[1,2]。斑马鱼饲养成本低、繁殖力强、易大规模饲养,3个月可性成熟、胚胎易得、便于观察,且斑马鱼和人类基因有高达87%的同源性,这些优点使斑马鱼成为研究人体疾病和发育机理的理想模式生物[3,4]。
miRNA是一类内生的、长度为19~23个碱基的非编码RNA。一个miRNA可以调节多个基因[5],也可以通过几个miRNA的组合来精细调控某个基因的表达[6]。miRNA存在多种形式,其被RNA聚合酶II转录为有帽子结构的和多聚腺苷酸尾巴(AAAAA)的初级转录本(pri-miRNA),该转录本可以是蛋白质编码的,也可以是非蛋白质编码的。初级转录物在核糖核酸酶Drosha和辅助因子Pasha的共同作用下切割产生约70个碱基的茎环前体miRNA(pre-miRNA),再被细胞质核糖核酸酶Dicer切割生成成熟的miRNA和反义miRNA(miRNA*)[7]。成熟的miRNA被整合到RNA诱导的沉默复合物(RNA-induced silencing complex,RISC)中,该复合物通过与miRNA的碱基配对识别靶mRNA,最常见的是抑制靶mRNA的翻译或使其翻译不稳定[8]。
miRNA最初被发现是在线虫中参与lin-4的发育,而在哺乳动物中miRNA参与造血谱系分化和同源框基因调控[9,10]。随后Muy等[11]研究发现microRNA表达水平的紊乱与肿瘤的发生、发展密切相关。Zhang等[12]的报道表明miR-196a在宫颈癌细胞中靶向调控netrin4基因,通过靶向同源基因团来调节哺乳动物的发育[13,14];miR-196a在胃癌的预后过程中表达上升[15];还有研究表明,miR-196a在食管鳞癌细胞中表达显著上调,同时,在食管鳞癌患者唾液中miR-196a的表达比正常人高27倍,因此,miR-196a可能作为潜在的食管鳞状细胞癌诊断标志[16]。在非洲爪蟾中,miR-196a的剂量不同会导致特定的眼部发育异常[17]。通过生物信息学分析比对发现miR-196a-1基因在各个物种中十分保守,说明miR-196a-1基因在调控生物体的发育、肿瘤发生和发展中起着非常重要的作用。
CRISPR/Cas9基因编辑技术是近年来火热的基因编辑技术。CRISPR/Cas9基因编辑技术由两部分组成,CRISPR结构骨架序列和Cas9蛋白。CRISPR结构骨架序列由前导序列、Cas基因、CRISPR基因座共同组成,具有招募Cas蛋白作用[18]。Cas9蛋白具有能特异性切割DNA双链的作用。CRISPR基因座经过转录加工后,得到小片段的CRISPR RNA即crRNA,而crRNA与反式激活的crRNA即tracrRNA能形成一种嵌合RNA,该嵌合RNA与Cas9蛋白形成复合物,从而切断基因组DNA[19,20]。后来科学家进一步改造,将crRNA和tracrRNA改造成一个向导RNA(sequence-specific guide RNA,sgRNA)[21]。目的基因靶位置序列的3’端有原间隔序列相邻基序PAM(protospacer adjacent motifs),为5’-NGG-3’序列,这是Cas9蛋白的识别位点。最后,通过改变sgRNA序列,体外合成sgRNA,Cas9蛋白可以靶向切割目的基因,从而达到基因敲除的目的[22,23]。
目前,miRNA调控生物发育、肿瘤发生和发展机制越来越受到人们的关注,但是,许多miRNA的功能仍然未知。为了研究miR-196a-1基因在斑马鱼肠道发育过程中的作用,本文利用CRISPR/Cas9基因编辑技术构建斑马鱼miR-196a-1基因敲除品系,为探究miR-196a-1在肠道发育中的作用奠定了基础。
1 材料与方法
1.1 试验材料
1.1.1 试验动物
本文用于试验的TU品系斑马鱼来自本实验室养殖。水温28 ℃,pH值在6.5~7.5,14 h光照/10 h黑暗交替循环。1对斑马鱼1周产1次卵,1次产卵约200个胚胎,胚胎在恒温28.5 ℃的E3水中培养,胚胎2 d后破膜,第5天开始喂食草履虫至2周左右,之后转移至养殖系统架上喂食丰年虫,养殖系统上的斑马鱼1天喂食2次,早晚各1次。本文试验一般在斑马鱼胚胎发育至1细胞期时进行显微注射。
1.1.2 主要试剂
引物由擎科生物合成,PCR高保真酶购自擎科生物,DNA marker购自TAKARA公司,琼脂糖购自BBI公司,PCR产物纯化试剂盒购自生工生物,体外转录试剂盒购自Thermo Fisher Scientific公司,RNA纯化试剂盒购自Qiagen公司,Cas9蛋白购自Thermo Fisher Scientific公司。
1.2 试验方法
1.2.1 sgRNA靶位点设计
负反转构造的存在说明研究区构造演化经历了由早期挤压应力到晚期拉张应力的转换。早期挤压形成的北西向构造带在晚期拉张应力作用下使研究区具备了良好的油气成藏条件。
首先在Ensembl网站上(http://www.ensembl.org/index.html)获取目标基因的完整序列,各个转录本以及内外显子等信息。然后找出所有紧邻5’-NGG-3’(PAM)的候选靶序列,靶序列一般大小为18~20 bp。sgRNA引物序列F基本结构:靶序列前加保护碱基(tg)和T7启动子(TAATACGACTCACTATA)或Sp6启动子(ATTTAGGTGACACTATA),靶序列后加sgRNA骨架序列上游序列(GTTTTAGAGGCTAGAA ATAGG),sgRNA引物序列R:AAGCACCGACTCGGTGCCACT,根据miR-196a-1基因靶位点通过Primer3.0设计基因组正反检测引物G196a-1-F和G196a-1-R(表1)。

表1 本文涉及到的引物和模板序列Tab.1 Primers and template sequences involved in this study
1.2.2 sgRNA的合成
使用通用模板(见表1),以sgRNA1-F/sgRNA-R或sgRNA2-F/sgRNA-R为引物,在退火温度为60 ℃,延伸时间为10 s的条件下,用高保真酶进行PCR扩增,获得携带Sp6启动子的miR-196a-1基因靶位点序列1以及T7启动子的miR-196a-1基因靶位点序列2的sgRNA模板序列;PCR产物进行琼脂糖凝胶电泳并切胶回收,以回收的PCR产物作为模板,用Sp6(或T7)体外转录试剂盒合成sgRNA,转录产物用RNA纯化试剂盒进行纯化回收,琼脂糖凝胶电泳及测定浓度后-80 ℃保存。
1.2.3 显微注射以及靶位点有效性检测
收集15 min内产的斑马鱼受精卵,待发育至1细胞期时排列在注射板上,将miR-196a-1基因靶位点的sgRNA1(30 ng/μL)、sgRNA2(35 ng/μL)和Cas9蛋白(150~300 ng/μL)按1∶1∶0.7比例混匀;用定量显微注射系统将混合溶液(约1 nL)共注射到斑马鱼受精卵中,注射后放置到28.5 ℃的恒温箱中;受精卵培养至36 h时,分别收集野生型和部分注射后胚胎进行有效性鉴定,剩余胚胎继续培养至成鱼。
1.2.4 可稳定遗传突变体的筛选
将注射后的胚胎培养至2个月左右发育为幼鱼,对幼鱼逐条剪尾进行基因型鉴定。由于两个靶位点之间相距132 bp,如果两个靶位点都有效,就会造成较大片段的缺失。用基因组检测引物对基因组进行PCR扩增,随后进行琼脂糖凝胶电泳,若PCR产物会同时出现野生型目的条带以及比野生型目的条带小100 bp左右的条带,则这些幼鱼为携带突变的F0代鱼;将F0代幼鱼继续饲养1个月左右至成鱼,与野生型进行杂交,用同样的基因型鉴定方法筛选出可稳定遗传的鱼,这些鱼为F1代突变体。基因型鉴定后,根据琼脂糖凝胶电泳结果,将F1代突变体中比野生型目的条带小的条带进行切胶回收,并送公司测序,根据测序结果分析突变位点和突变的碱基数。
2 结果与分析
2.1 miR-196a-1基因生物保守性分析
首先在NCBI网站上(https://www.ncbi.nlm.nih.gov)查找miR-196a-1基因在各个物种中的序列,并将序列下载,利用blast比对各个物种的miR-196a-1基因序列,并找出保守序列。在miRBase网站上(https://www.mirbase.org)查找种子序列,与各个物种的miR-196a-1基因序列比对,发现各个物种的miR-196a-1基因的种子序列高度保守(见图1)。
2.2 miR-196a-1基因靶位点确定
按1.2.1所述的方法在miR-196a-1基因序列上选择基因敲除位点(见图2),靶位点序列前加保护碱基和启动子序列,靶位点序列后加sgRNA骨架上游序列,将此作为正向引物sgRNA1-F和sgRNA2-F。sgRNA骨架下游序列作为反向引物sgRNA-R。

图1 各个物种间miR-196a-1基因生物保守性分析Fig.1 Bioconservative analysis of miR-196a-1 gene among species加粗部分为保守序列区,序列标红处为种子序列。miR-196a-1种子序列区高度保守The bold part showed the conserved sequence region, and the red part of the sequence is the seed sequence. The miR-196a-1 seed sequence is highly conserved

图2 miR-196a-1基因靶位点示意图Fig.2 The design diagram of miR-196a-1 gene targeting site以上序列是miR-196a-1基因序列的一部分,大写加粗部分为外显子,小写未加粗部分为内含子;下划线为直线的表示靶位点序列,下划线为双直线的表示为PAM序列;下划线为波浪线的则是检测引物Above is partial sequence of the miR-196a-1 gene. The capitalized with bold sequences are exons, the lower case with bold parts are introns;The sequence with single underline indicated the target site1 and target site2 sequence, respectively;The doubled underlines means PAM sequence. Underlined by wavy lines are primers for genotyping
2.3 miR-196a-1基因注射有效性检测与分析
为了确认靶位点有效,本文按方法1.2.3中所述将注射后胚胎培养至36 hpf (hours post fertilization),随机挑选5管,每管2颗胚胎,提取基因组DNA进行PCR扩增(见图3)。结果显示,3号和4号泳道除了一条210 bp的野生型条带外,下方有一条较弱的小带,证明选择的两个靶位点都有效,达到基因敲除效果。
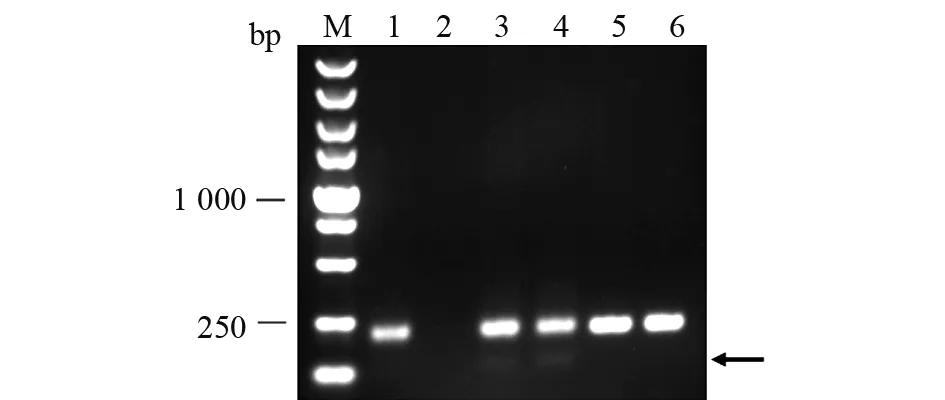
图3 胚胎注射有效性分析Fig.3 Analysis of effectiveness of embryo injection胚胎注射有效性分析PCR产物凝胶电泳图。M:DNA标准;1~5:注射胚胎基因组DNA进行PCR扩增的产物;6:野生型对照。3和4泳道除了有一条明亮的210 bp的野生型条带外,下方有一条较弱的小带(黑色箭头指示), 这说明两个靶位点都有效Gel electrophoresis of PCR products for embryo injection effectiveness analysis. M:DNA marker;1~5:PCR amplification products of genomic DNA with embryo injection;6:Wild type control group. In addition to a bright 210 bp wild-type band in lanes 3 and 4, there is a weaker band (indicated by a black arrow) below, indicating that both target sites are valid
2.4 F0代突变体筛选
将注射有效的剩余胚胎养至成鱼,对成鱼逐条剪尾提取基因组DNA进行PCR检测分析(见图4)。结果显示第8号泳道除了一条210 bp的野生型条带外,下方有一条较弱的小带。

图4 F0代两个月幼鱼筛选Fig.4 F0 generation two months juvenile screeningM:DNA标准;1~9:两个月幼鱼剪尾提取基因组DNA进行PCR扩增的产物;10:野生型对照。第8号泳道除了有一条明亮的210 bp的野生型条带外,下方有一条较弱的小带(黑色箭头指示)M:DNA marker;1~9:PCR amplified products using two months juvenile genomic DNA injected with miR-196 guide RNAs;10:Wild type control. In addition to a bright 210 bp wildtype band, lane 8 has a weaker band below (Indicated by the black arrow)
2.5 稳定遗传突变体的筛选
本试验将筛选到的第8号F0代突变体与野生型斑马鱼杂交,得到F1代鱼,收集5管F1代胚胎,每管2颗,提取基因组DNA做PCR扩增并凝胶鉴定,结果如图5a所示,发现除了210 bp的野生型条带外,下方有一条100 bp左右的条带,说明第8号F0代突变体可稳定遗传。将该100 bp左右的条带进行切胶回收并送公司测序,峰图显示两个靶位点都出现缺失,结果如图5b所示。测序序列在NCBI blast 数据库中进行比对,发现突变体的两个靶位点之间缺失了103 bp碱基,证明两个靶位点都有效,并造成大片段的缺失,结果如图5c所示。将剩余的F1代胚胎养成2个月的幼鱼,再逐条剪尾提取基因组DNA进行PCR检测鉴定,结果如图5d所示,获得可稳定遗传的F1代鱼。
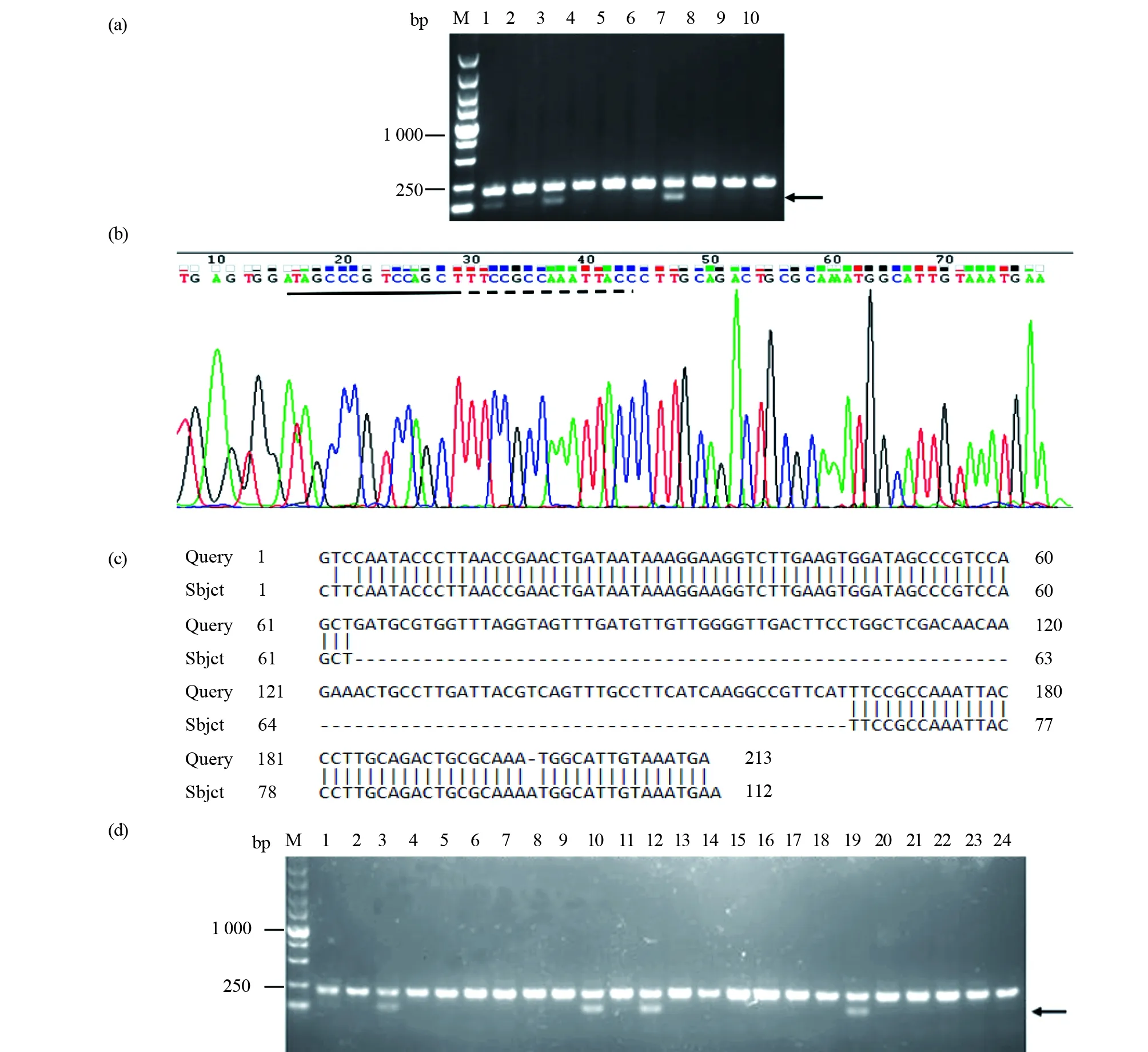
图5 F1代突变体筛选Fig.5 F1 generation mutant screening(a)F1代胚胎PCR产物凝胶电泳图。M:DNA标准;1~9:注射胚胎sgRNA后,提取基因组DNA,进行PCR扩增的产物;10:野生型对照。第1、3、7号泳道除了有一条明亮的210 bp的野生型条带外,下方有一条较弱的小带(黑色箭头指示)。证明F0代突变体筛选的8号鱼可产生能稳定遗传的突变后代;(b)F1代胚胎PCR产物测序峰图。将基因敲除条带的PCR产物送公司测序,峰值图中:“----”代表第一号靶位点序列,基因敲除后,第一号靶位点缺失了7个碱基。“”代表第二号靶位点序列,第二号靶位点缺失了8个碱基;(c)测序序列比对结果图。发现第一号靶位点和第二号靶位点之间缺失103 bp,包括第一号靶位点缺失了7个碱基,第二号靶位点缺失了8个碱基以及第一号与第二号靶位点中间的碱基;(d)F1代突变体成鱼PCR产物凝胶电泳图。M:DNA标准;1~23泳道:注射胚胎基因组DNA进行PCR扩增的产物;24泳道:野生型对照。第1、3、10、12、19号泳道除了有一条明亮的210 bp的野生型条带外,下方有一条较弱的小带(黑色箭头指示)(a)Gel electrophoresis of PCR products using F1 embryos as genomic DNA. M:DNA marker;1~9:PCR products using genomic DNA injected with sgRNA;10:Wild type control. In addition to a bright 210 bp wild-type band,there was a weaker band below in lanes 1, 3, and 7 (indicated by the black arrow). The fish No.8 selected by the F0 mutant can produce mutant offspring that can be stably inherited;(b) The F1 generation mutant embryo PCR product sequencing peak map, the small band of PCR product was purified and sent to the company for sequencing, “----”indicated the first target site sequence,7 bases missing from target site 1;“”marked the second target site sequence,7 bases missing at target 2;(c)Mutant sequence was compared with the control in the NCBI blast datebase,103 bp was missing between the first and second target sites;(d)Gel electrophoresis of PCR products of F1 adult mutant fish. M:DNA marker;1~23:PCR amplified product of genomic DNA with embryo injection;24:Wildtype control. Inaddition to a bright 210 bp wildtype band, there was a weaker band below in lanes 1, 3, 10, 12, 19 (indicated by the black arrow)
3 讨论
CRISPR/Cas9基因编辑技术面世之前,一般采用锌指核酸酶技术(Zinc-finger nucleases,ZFN)和基因打靶技术(transcription activator-like effector nucleases,TALEN)进行基因编辑,但ZFN和TALEN基因打靶技术存在很大的局限性。ZFN基因打靶技术操作过程十分复杂,并且一次不能对多个靶位点进行切割,打靶效率不高。在构建动物模型的过程中,需要多次构建表达载体,构建载体过程繁琐,试验周期太长[24-26]。CRISPR/Cas9基因编辑技术相比前两种技术设计简单、高效,大大缩短了试验周期,一经面世,就被广泛应用。本文用斑马鱼作为模式动物,使用CRISPR/Cas9基因编辑技术敲除miR-196a-1基因,斑马鱼作为模式动物的优势结合CRISPR/Cas9基因编辑技术的简单操作,采用Cloning free技术,不需要进行载体的构建,只需以寡聚核苷酸作为模板进行PCR,将PCR产物纯化回收后直接作为合成sgRNA的模板,简化了基因敲除的过程,大大提高了试验效率,降低了试验过程中潜在的风险。本文选用了两个靶位点,采取了注射一对sgRNA的方式,如果两个靶位点都有效,可以造成大片段的缺失,对斑马鱼易回复突变的特点进行补偿作用,敲除结果也可在琼脂糖凝胶电泳中直观地观察到,无需单个检测。但CRISPR/Cas9基因编辑技术有易脱靶的局限性,这就需要对目的基因的敲除蛋白结构域和靶位点的选择有更高的要求。
因为显微注射后的F0代胚胎为嵌合体,其突变不一定能够遗传到下一代,因此不直接对F0代突变体测序。筛选到的F0代突变体只进行PCR扩增鉴定,将鉴定有突变的个体与野生型斑马鱼杂交产生F1代,提取F1代胚胎基因组DNA做PCR扩增,琼脂糖凝胶电泳验证,随后送公司进行Sanger测序,确定敲除位点和数量。
F1代突变体能够稳定遗传,将F1代杂合突变体自交,经基因型鉴定,出现25%的纯合子,与预期结果相符合。将F1代miR-196a-1基因杂合突变体成鱼自交,观察F2代miR-196a-1基因纯合突变胚胎,其外表发育正常,未出现明显表型(图6),这说明缺失后不影响整体胚胎发育,导致miR-196a-1突变后斑马鱼胚胎整体未出现明显缺陷,但是该基因是否引起细微结构异常尚不清楚,需要进一步研究。该基因可能还有其他的miRNAs起着代偿作用,共同降解靶基因。在后续的研究中,应在miR-196a-1基因敲除模型上进一步敲除其它相关的miRNAs,观察这些基因在调控斑马鱼肠道发育中的功能。本研究第一次成功构建了miR-196a-1基因敲除斑马鱼模型,为后续的miR-196a-1基因功能研究提供了良好的研究基础。
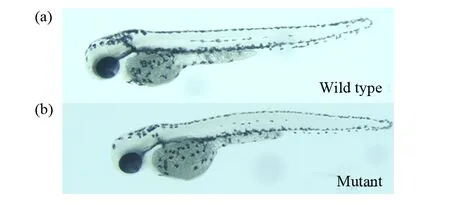
图6 miR-196a-1基因纯合突变体表型 (50 ×)Fig.6 Phenotype of miR-196a-1 null mutant (50 ×)(a)野生型对照组;(b)miR-196a-1基因纯合突变体。结果显示miR-196a-1基因纯合突变体与野生型相比,外表没有明显变化(a)Wild-type control group;(b)Homozygous mutant of the miR-196a-1 gene. The results showed that the miR-196a-1 homozygous mutant had no obvious difference compared to the wild type

