β-二氢青蒿素-大黄素复合物对人胃癌细胞株SGC-7901增殖的影响
辛 悦,杨万山,金光洙,孙 抒*,赵俊军
(1.大连市中心医院 病理科,辽宁 大连116000;2.延边大学医学院 病理学与法医学教研室,吉林 延吉133002;3.延边大学药学院 药物化学教研室,吉林 延吉133002)
从天然药用资源中寻找高效低毒的化合物作为新一代的化疗药物已备受瞩目。二氢青蒿素和大黄素的抗肿瘤作用日益受到关注,对其抗肿瘤作用机制的研究也广泛开展[1-4]。大量研究表明二氢青蒿素和大黄素对肿瘤细胞均可起到抑制其增殖,诱导其凋亡[5,6];抑制肿瘤新生血管的形成;抑制肿瘤细胞侵袭和转移的作用[7]。本实验使用的复合物是通过合成开发的两个抗肿瘤活性单体--二氢青蒿素和大黄素通过酯键结合的新型抗肿瘤候选化合物-β-二氢青蒿素-大黄素复合物。为了检测该药物是否具有二氢青蒿素和大黄素一样的抗肿瘤作用,我们设计了以下实验。目前关于β-二氢青蒿素-大黄素复合物抗肿瘤作用尚未见报道。
1 材料与方法
1.1 细胞株与药物
人胃癌细胞SGC-7901购买于北京华美生科生物技术有限公司,由本实验室体外培养、传代。β-二氢青蒿素-大黄素复合物由延边大学药学院金光洙博士合成提供,先用吐温80和0.3%的纤维素钠溶解,并将其混匀,于-4℃保存备用。再根据需要,用PBS稀释成实验所需浓度。
1.2 主要试剂及仪器
MTT(Biomol公司);苏木素染液(Solarbio公司);单克隆抗体(CyclinD1,Ki-67)、Annexin-V/PI试剂盒、(美国Becton Dikinson公司);光学显微镜、荧光显微镜(日本OLYMPUS);流式细胞仪(美国BD公司);全波长酶联免疫检测仪(TECAN公司产品,型号infiniteM200PRO)。
1.3 方法
1.3.1MTT比色法
将浓度为6×104个/ml的胃癌SGC-7901细胞悬液接种于96孔培养板中,实验孔每孔加入180 μl的细胞悬液后,放入培养箱过夜。次日观察贴壁后,每个实验孔加入20 μl的药物,药物终浓度分别为2.5 μg/ml、5 μg/ml、10 μg/ml、20 μg/ml,而对照组每孔则加入20 μl的药物溶剂作为阴性对照。分别培养24 h、48 h、72 h后,加入20 μl的 MTT溶液(其浓度为5 mg/ml),培养4 h后,取出,避光,每孔加入150 μl的二甲基亚砜(Dimethyl sulfoxide,DMSO),放在震荡仪上振荡,最后酶联免疫检测仪检测在波长为492 nm处的吸光度(Optical density,OD)值。
为了保证实验的准确性,重复实验3次。利用公式计算出细胞的增殖抑制率。计算公式如下:肿瘤细胞增殖抑制率(%)=(1-加药组OD值/对照组OD值)×100%。
1.3.2倒置相差显微镜观察
从37℃、5%CO2细胞培养箱中取出人胃癌SGC-7901细胞,在显微镜下选出处于对数生长期的细胞,分别加入终浓度为2.5 μg/ml、5 μg/ml、7.5 μg/ml的β-二氢青蒿素-大黄素复合物和等量的药物溶剂作为加药组和对照组,再放入37℃、5%CO2细胞培养箱中培养48 h,在倒置相差显微镜下分别观察并拍照记录。
1.3.3AO/EB染色
实验组和对照组,分别加入终浓度为2.5 μg/ml、5 μg/ml、7.5 μg/ml的β-二氢青蒿素-大黄素复合物和等量的药物溶剂,将加完药的6孔板重新再放入37℃、5%CO2细胞培养箱中培养48 h后,取相同体积的溴化乙锭和吖啶橙(浓度各为100 μg/ml),混匀制成AO/EB荧光染色混合液,荧光显微镜下观察细胞并拍照。
1.3.4免疫细胞化学染色
将处于对数生长期的人胃癌SGC-7901细胞吹打制成浓度为6×104个/ml的细胞悬液,设定实验组和对照组,分别加入终浓度为2.5 μg/ml、5 μg/ml、7.5 μg/ml的β-二氢青蒿素-大黄素复合物和等量的药物溶剂,放入37℃、5%CO2细胞培养箱中培养48 h,依据SABC免疫组织化学染色试剂盒步骤进行染色,操作步骤根据实际情况略加修正。Ki-67、CyclinD1单抗工作液(按1∶100的比例用抗体稀释液稀释)。结果的判断:以每张爬片见棕黄色颗粒为阳性,以无色或淡染为阴性判断。Ki-67、CyclinD1主要在细胞核表达。在40×10高倍镜下观察,并随机选取5个视野,分别记录阳性细胞和细胞总数。利用公式:阳性表达率(%)=阳性细胞数/总细胞数×100%,计算阳性表达率。
1.3.5流式细胞仪检测
选取处于对数生长期的人胃癌SGC-7901细胞株→经过消化,吹打,离心,制成6×104个/ml细胞悬液→将细胞悬液移至培养瓶中,放入37℃、5%CO2细胞培养箱中培养,待贴壁后,分别加入终浓度为2.5 μg/ml、5 μg/ml、7.5 μg/ml的β-二氢青蒿素-大黄素复合物作为加药组,加入等量药物溶剂的作为对照组,上机检测及分析结果:采用Mod Fit 3.0软件,对细胞周期分布情况、样品单参数DNA含量进行分析,并得出凋亡细胞的百分比含量和细胞周期的分布情况。
1.3.6统计学处理
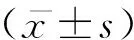
2 结果
2.1 β-二氢青蒿素-大黄素复合物对人胃癌SGC-7901细胞的抑制增殖作用
MTT的结果显示出β-二氢青蒿素-大黄素复合物对人胃癌SGC-7901细胞具有明显抑制增殖作用外(见表1),随着β-二氢青蒿素-大黄素复合物作用时间的延长,人胃癌SGC-7901细胞的增殖抑制率也明显升高,其差异具有明显的统计学意义(P<0.05),说明其具有时间依赖性;而随着β-二氢青蒿素-大黄素复合物浓度的升高,人胃癌SGC-7901细胞的生长抑制率也显著升高,差异具有统计学意义(P<0.05),说明其具有浓度依赖性。当β-二氢青蒿素-大黄素复合物分别作用24 h、48 h、72 h时,SGC-7901细胞的IC50分别为7.4 μg/ml、4.6 μg/ml、2.4 μg/ml。
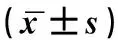
表1 β-二氢青蒿素-大黄素复合物对人胃癌SGC-7901细胞株抑制增殖作用
注:相同浓度不同时间,同前一组比较▲P<0.05;相同时间不同浓度同前一组比较*P<0.05
对β-二氢青蒿素-大黄素复合物处理48 h后的人胃癌SGC-7901细胞进行流式细胞仪检测分析,发现其细胞周期分布发生了显著的变化(见表2)。对照组G0/G1期细胞占40.51±1.67%,G2/M期细胞占24.53±1.84%,S期细胞占34.34±2.03%;实验组2.5 μg/ml的G0/G1期细胞占58.93±1.39%,较对照组升高,G2/M期占16.74±1.49%,S期细胞占27.44±0.77%,均较对照组减少。同样,实验组5 μg/ml和实验组7.5 μg/ml两组G0/G1期百分率升高,G2/M期和S期均减少(见表2),且差异具有统计学意义(P<0.05)。由数据可以看出,β-二氢青蒿素-大黄素复合物干扰了人胃癌SGC-7901细胞周期的分布,将细胞阻滞在G1期,抑制细胞的增殖,诱导其凋亡。
细胞发生凋亡时,其细胞核内的DNA发生断裂,处于降解的过程,所以含量比G0/G1期的二倍体细胞低,体现在荧光直方图上,就会在G0/G1期峰前出现特征性的亚二倍体峰(Apoptotic Peak,AP峰,又称凋亡峰,图1)。本实验对照组细胞凋亡率为1.06±0.08%,3组实验组细胞凋亡率分别为5.43±0.16%、8.44±0.17%、28.16±0.28%。可见其凋亡率随药物浓度的升高而增加,呈浓度梯度趋势(表2),差异具有统计学意义(P<0.05)。

图1 流式细胞仪分析细胞周期及凋亡率结果

表2 β-二氢青蒿素-大黄素复合物对SGC-7901细胞周期的影响
注:*与对照组相比,▲与低浓度组相比,†与中浓度组相比,P<0.05
2.2 β-二氢青蒿素-大黄素复合物对人胃癌SGC-7901细胞的诱导凋亡作用
倒置相差显微镜观察对照组细胞贴壁良好,形态多为梭形或者多角形,伸展、透光性好,分布均匀,生长旺盛;实验组分别加入2.5 μg/ml、5 μg/ml、7.5 μg/ml的β-二氢青蒿素-大黄素复合物,作用48 h后,细胞外形皱缩,圆化,体积变小,虽细胞膜完整,但可见发泡现象,增殖受到不同程度的抑制。
AO/EB染色,48 h后经荧光显微镜观察,对照组细胞呈现为形态结构正常的绿色均匀荧光(图3-2A);实验组细胞随着浓度的逐渐增高,可见发出绿色荧光的正常细胞数量逐渐减少,发出黄绿色荧光的早期凋亡细胞和发出橙红色荧光的晚期凋亡细胞数量逐渐增多,偶尔可见发出红色荧光的坏死细胞(图2B、图2C、图2D)。

图2 AO/EB荧光染色实验观察细胞形态(×400倍)
2.3 β-二氢青蒿素-大黄素复合物对胃癌细胞株抑制增殖作用相关基因蛋白表达的影响
利用免疫细胞化学染色的方法检测了48 h后β-二氢青蒿素-大黄素复合物对人胃癌SGC-7901细胞中的细胞增殖核抗原Ki-67和细胞周期蛋白CyclinD1的表达的影响。Ki-67和CyclinD1均在细胞核表达,经实验发现,两种蛋白的对照组细胞胞核均呈深棕色,细胞状态良好,且胞核形状规则;而实验组细胞变小变圆、胞核固缩,与邻近细胞分离,随着药物浓度逐渐增高,细胞数量减少,棕色颗粒数量也随之减少,棕黄色染色越淡。利用计算公式得出蛋白阳性表达率,其差异具有统计学意义(P<0.05)(图3)。

图3 免疫细胞化学染色实验后Ki-67、CyclinD1蛋白阳性表达率的变化
3 讨论
青蒿素(Artemisinin),是从菊科植物黄花蒿的叶和花蕾中提取出的一种具有过氧化基团结构的倍半萜内酯化合物,是由我国最先开发并得到国际认可的抗疟中草药。值得骄傲的不仅在于青蒿素被誉为是“治疟神药”,拯救了数百万计的生命,还在于其发现者屠呦呦教授因此被授予了2015年诺贝尔生理或医学奖的殊荣。
青蒿素中的主要活性成分为二氢青蒿素(Dihydroartemisinin,DHA)又名为双氢青蒿素。分子式为C15H24O5,分子量为284。DHA是目前所了解的青蒿素类化合物中抗肿瘤作用上佳的一类成分[8]。另一经典的抗肿瘤中草药为大黄素(emodin)。大黄素,化学名1,3,8-三羟基-6-甲基蒽醌(1,3,8-trihydroxy-6-methylanthra-quinone),又称朱砂莲甲素,分子式为:C15H10O5,属蒽醌类衍生物,是从植物Polygonum Cuspidatum中提取的,具有广泛的生物学活性及药理作用[9,10],这两种经典中草药-二氢青蒿素和大黄素,他们的抗肿瘤作用日益受到关注,对其抗肿瘤作用机制的研究也广泛开展[11-14]。本实验所用的复合物是将二氢青蒿素和大黄素两种抗肿瘤活性单体通过酯键结合形成的复合物,我们的实验通过MTT比色法检测到β-二氢青蒿素-大黄素复合物对人胃癌SGC-7901细胞有抗增殖作用;又通过多项传统的和现代的染色技术,从形态学上观察到了受β-二氢青蒿素-大黄素复合物影响的SGC-7901细胞发生的变化;利用流式细胞仪对药物作用前后细胞的周期及凋亡率做了半定量的检测,发现β-二氢青蒿素-大黄素复合物干扰了人胃癌SGC-7901细胞周期的分布,将细胞阻滞在G1期,抑制细胞的增殖,诱导其凋亡。免疫细胞化学实验发现,与对照组相比,β-二氢青蒿素-大黄素复合物作用的人胃癌SGC-7901细胞的实验组中,细胞增殖核抗原Ki-67和细胞周期蛋白CyclinD1的表达明显降低,说明β-二氢青蒿素-大黄素复合物抑制了细胞的增殖,并且抑制增殖的原因可能与周期分布异常有关。可见,β-二氢青蒿素-大黄素复合物是一种极具开发价值的新型抗胃癌药物。

