术前中性粒细胞和淋巴细胞比值对肾上腺皮质癌的预后评估研究
宣强,沈洲,陶陶,林垚,胡学春,穆祥宇,夏开国
[中国科学技术大学附属第一医院(安徽省立医院)泌尿外科,合肥 230001]
肾上腺皮质癌(ACC)是发生于肾上腺皮质的恶性肿瘤,其发病率极低,为(0.7~2)/1 000 000,近年来有升高趋势[1-2],恶性程度高,五年生存率较低(16%~40%)[3]。肾上腺皮质癌诊断目前依据影像学检查及术后病理检查确诊,其治疗首先选择手术切除,对于部分伴有远处转移者,若患者身体状况好,也可考虑做减瘤手术,延长患者生存周期[4]。由于肾上腺皮质癌预后较差,寻找有效的预后评估因子十分必要。相关文献报道肿瘤细胞的增殖、侵袭受到炎症的影响,临床常用的炎性指标为中性粒细胞与淋巴细胞比值(NLR)[5],目前已在胰腺癌、前列腺癌等多种恶性肿瘤中有过应用报道[6-9]。本文通过回顾性分析了我院22 例肾上腺皮质癌患者的临床资料,探讨术前NLR 对ACC 预后评估的价值。
1 资料与方法
1.1 临床资料 回顾性分析2009 年5 月—2019 年10 月在我院就诊的肾上腺皮质癌患者的临床资料。
1.2 纳入与排除标准 纳入标准:①行肾上腺皮质癌切除术者;②术后病理诊断为肾上腺皮质癌。排除标准:①合并心力衰竭、肝功能不全等严重疾病者;②术前行化疗、放疗者;③具有自身免疫疾病、血液病史者。收集患者的年龄、体质指数(BMI)、肿瘤最大直径、中性粒细胞值、淋巴细胞值、白蛋白、血红蛋白相关数据,通过电话随访,咨询并记录每一位患者生存时间、转移及预后情况。
1.3 实验室数据收集及计算 通过中国科学技术大学附属第一医院检验科信息系统,统计患者术前中性粒细胞计数、淋巴细胞计数、血红蛋白值以及白蛋白值、血糖值等。其中,血常规通过全自动血液分析仪测定。血生化通过全自动生化分析仪测定。NLR 为中性粒细胞数与淋巴细胞数的比值,利用术前血常规数据,计算出NLR 值。
1.4 评价标准及定义 患者总生存时间(OS)定义为患者确诊为肾上腺皮质癌至死亡时间或最后随访时间;患者复发或转移的诊断标准是:患者复诊过程中有明确的影像学检查证明患者原位有新发肿瘤或有淋巴结肿大,或其他远处转移。患者无进展生存期(PFS)指的是行根治性切除术后,从确诊为肾上腺皮质癌至患者相关影像学检查确定患者有转移灶的时间。
1.5 统计学处理 采用SPSS 20.0 软件进行统计学分析。文中OS 和PFS 采用中位数和四分位数表示,其余计量资料采用表示;根据受试者工作曲线(ROC)分析确定患者年龄、肿瘤最大径、BMI、血清白蛋白、血红蛋白、NLR 的最佳临界值,以约登指数(Youden index)最大值(敏感度+特异度-1)所对应的为最佳临界值,即cut off 值,利用χ2检验和Fisher 精确计算法单因素分析每种影响因素与患者预后影响,对于P <0.05 者,采用Cox 回归模型进行多因素分析,P <0.05 为差异有统计学意义,并采用Kaplan-Meier 法进行生存分析,绘制生存曲线,组间生存率采用Log-rank 检验。
2 结果
2.1 患者的基线资料 22 例患者中男性7 例,女性15 例;肿瘤位于左侧者16 例,右侧者6 例;患者年龄(56.41 ±12.83)岁;BMI 值为(21.93 ±3.57)kg/m2;肿瘤直径大小为(10.70 ±3.59)cm;OS 为26(11.25,50.75)月;PFS 为18(3.75,39.00)月。
2.2 NLR 最佳临界点 以患者是否发生转移为分类变量,ROC 曲线提示最佳临界值为2.479,最大约登指数为0.547,特异性为77.8%,敏感性为76.9%,曲线下面积为0.795,如图1 所示。本文以NLR 为2.479 为临界值将患者分为两组,其中NLR>2.479 为高NLR 组,共12 例;NLR≤2.479 为低NLR 组,共10 例,比较两组患者年龄、BMI、肿瘤最大直径、白蛋白、血红蛋白、血糖等临床数据,本组发现高NLR 组的平均年龄、血糖水平高于低NLR 组,而白蛋白水平低于低NLR 组,差异有统计学意义(P <0.05),如表1 所示;比较两组患者的平均总生存时间和无进展生存时间,本组发现高NLR 组显著低于低NLR 组,差异有统计学意义(P <0.05)。高NLR 组的PFS 为6(2.25,18.00)个月,OS 为18.5(7.50,29.75) 个月,而低NLR 组PFS 为31.5(19.25,74.25)个月,OS 为42(25.75,74.25)个月。
2.3 影响ACC 的PFS 及OS 的单因素及多因素分析 如表2 所示,经单因素分析发现NLR 高低与患者的PFS 及OS 相关,而肿瘤最大径与患者的OS 相关,BMI 水平与患者的PFS 相关。再应用Cox 比例风险回归模型进行多因素回归分析,结果显示NLR为影响患者PFS 和OS 的独立危险因素。NLR 偏高者发生转移的概率高(HR=7.402,95%CI:1.662~32.963,P=0.009),且死亡风险大(HR=13.713,95%CI:1.287~146.093,P=0.030)。再用Kaplan-Meier 法绘制生存曲线,发现NLR 越高,ACC 患者越容易发生转移,PFS 及OS 越短。见图2。
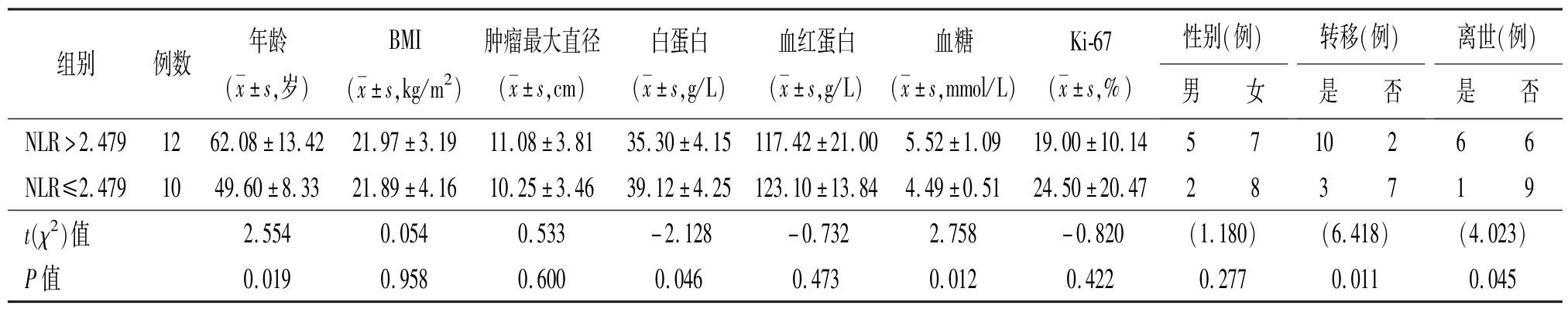
表1 22 例肾上腺皮质癌患者临床资料与NLR 的相关性

表2 影响肾上腺皮质癌患者总生存时间/无进展生存时间的单因素分析
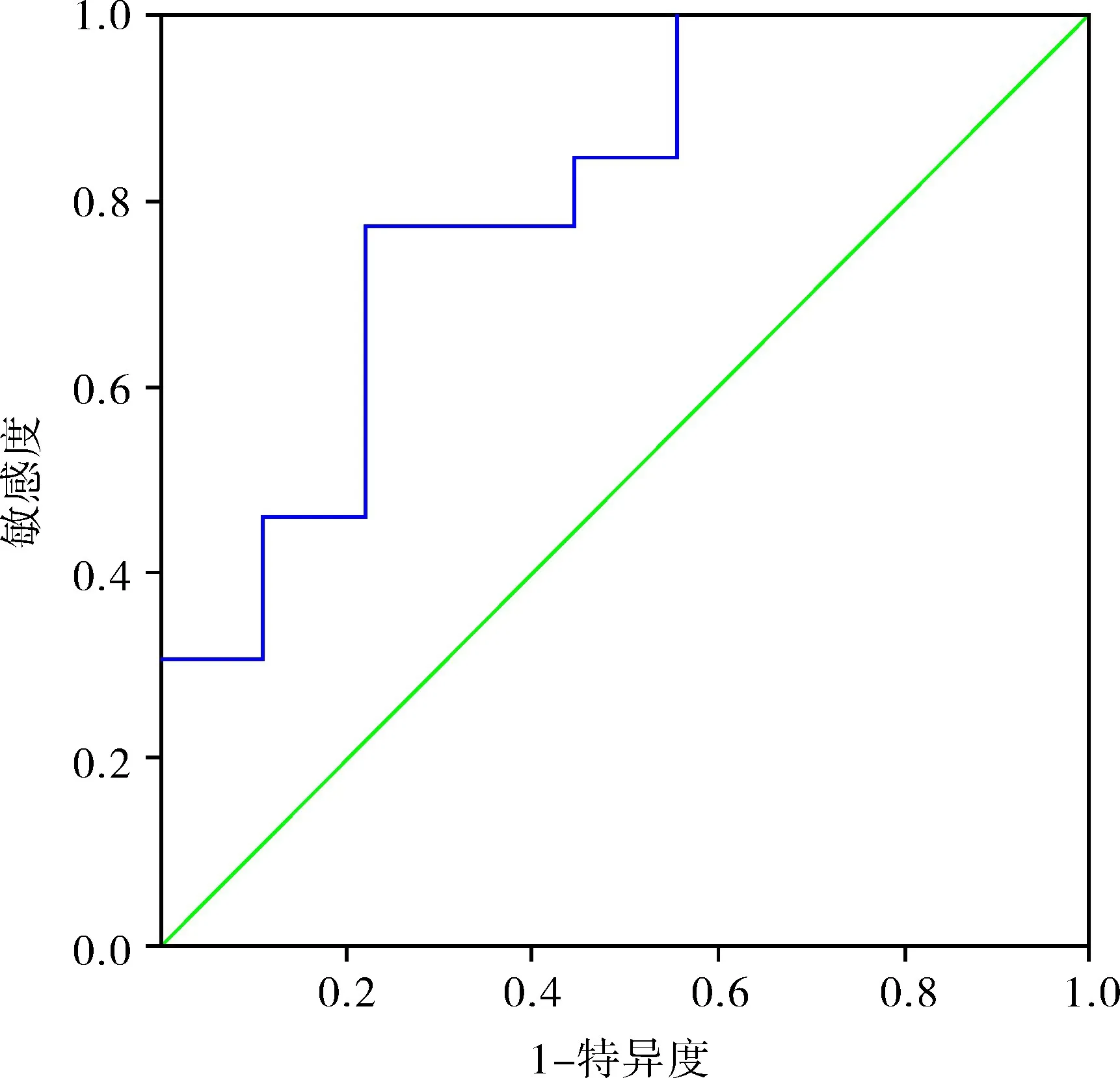
图1 NLR 以肾上腺皮质癌是否转移为分类变量形成的ROC 曲线
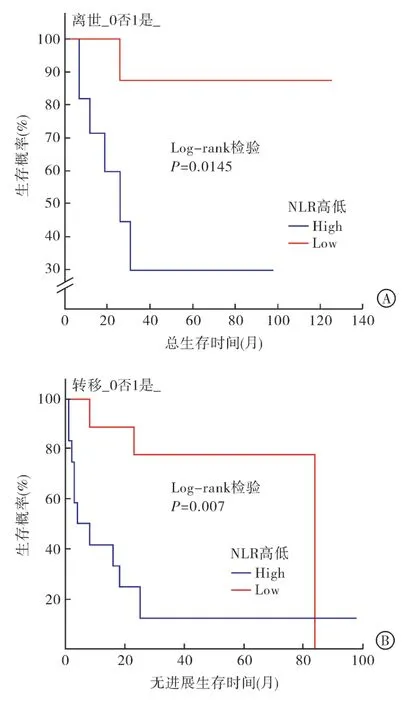
图2 NLR 高低对患者总生存时间(图A)和无进展生存时间(图B)的影响
3 讨论
肾上腺皮质癌早期并无典型症状,大部分患者发现时已是中晚期,约25%伴有远处转移[10],部分患者表现为Cushing 综合征,出现满月脸,水牛背,向心型肥胖,血液检查发现血中皮质醇浓度异常增高[11];部分患者出现腰痛不适,多为肿瘤破裂出血引起。晚期肾上腺皮质癌患者通常侵犯周围组织,并通过血管、淋巴管等途径进行远处转移,常伴有肺部转移,肝脏转移等[12]。晚期肾上腺皮质癌患者乏力、纳差,体质消瘦,常伴有贫血、恶病质[13]。
肾上腺皮质癌的治疗目前仍以手术切除为主,优先选择腹腔镜切除,但对于一些肿瘤较大,与周围组织黏连严重者,仍以开放切除为主[14]。对于一些伴有远处转移灶,周围组织粘连较轻者,也可选择行减瘤手术,术后再行化疗,可进一步提高患者的生存时间[15]。关于肾上腺皮质癌的预后,由于其发病率较低,目前相关文献报道较少。李少华等[16]认为影响肾上腺皮质癌预后的独立危险因素为皮质醇高分泌和低钾血症,其文章中报道患者平均生存时间为49.2 个月,1 年生存率为70.0%,中位无瘤生存时间为36 个月,1 年无瘤生存率为55.6%。而张明峰等[17]报道影响肾上腺皮质癌的预后的独立危险因素为术前低蛋白血症、女性患者、年龄>45 岁及肿瘤分期晚,其文章中报道ACC 患者平均生存时间为29 个月,1 年、3 年及5 年生存率分别为71%、47%及42.7%。通过对本院22 例肾上腺皮质癌患者影响预后因素的研究,发现NLR 对于肾上腺皮质癌患者预后有一定的评估作用。
血中性粒细胞可以分泌肿瘤坏死因子、白细胞介素等细胞因子,促进肿瘤侵袭、转移,而淋巴细胞分泌的淋巴因子具有抗肿瘤作用,故血液中中性粒细胞计数越多,肿瘤进展越快,预后越差;而淋巴细胞计数越多,肿瘤进展变慢,生存时间延长。NLR为中性粒细胞计数与淋巴细胞计数的比值,其比值的大小,在一定程度上预示了患者的生存时间。高翔等[18]认为NLR≥2.6 对非肌层浸润性膀胱癌预后不利;桑尊孟[19]认为NLR≥2.731 不利于前列腺癌患者的预后;而周冠文[20]认为NLR≥2.19 对于肾癌患者的预后不利。
本文根据ROC 曲线分析,确定NLR 临界值为2.479,NLR >2.479 有12 例,≤2.479 有10 例,两组患者的性别、平均肿瘤最大径、BMI 值、Hb、ki-67表达量差异无统计学意义(P >0.05),而高NLR 组的平均年龄、血糖水平高于低NLR 组,白蛋白水平低于低NLR 组,差异有统计学意义(P <0.05),这在一定程度上说明高龄、高葡萄糖、低蛋白可能与人体炎症的发生和发展相关。本组发现高NLR 组患者的总生存时间为18.5(7.50,29.75)个月,无进展生存时间为6(2.25,18.00)个月,低NLR 组患者的总生存时间为42(25.75,74.25)个月,无进展生存时间为31.5(19.25,74.25)个月,两组患者差异有统计学意义(P <0.05)。本研究发现NLR >2.479为肾上腺皮质癌患者预后的独立危险因素。
综上所述,NLR 作为相关肿瘤的预后影响因素已经被报道,但是NLR 与肾上腺皮质癌的相关报道极少,本文对我院22 例肾上腺皮质癌患者的临床资料进行分析,得出NLR >2.479 者总生存时间和PFS 均明显减少。本研究显示高NLR 与肾上腺皮质癌预后不良相关,NLR 可能成为肾上腺皮质癌患者预后的评估指标,也可能为该疾病的免疫治疗提供新思路。

