猪蓝耳病活疫苗中猪瘟外源病毒检测
袁建琴 高斌战 宋宝敏 孔艳彪 张 卓 周小霞
1.山西农业大学生命科学学院,山西太谷 030801;2.山西省兽用生物制品试验推广中心,山西太谷 030800
猪蓝耳病,又称猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PPRS),是由猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)感染引起的[1-4]。该病是一种接触性传染病,具有发病率和死亡率高以及发病急等特点,同时也能够引起免疫抑制从而引发猪多种其他疾病[1]。PRRS 能够造成怀孕母猪繁殖方面的障碍,如流产、木乃伊胎、死胎以及弱仔等,病猪出现严重的呼吸困难和呼吸急促[2,5-10]。为了防控该疾病,目前主要的手段是依赖于疫苗[11-13]。但在我国猪用疫苗中,外源病毒污染情况经常发生,这将直接影响到疫苗的安全性。间接免疫荧光法(indirect immunofluorescence assay,IFA)是先用一抗与待检测的样品反应,用PBS 洗去未与样品结合的一抗,再用二抗与样品和一抗的复合物反应,再洗去未结合的二抗,然后在荧光倒置显微镜下观察染色结果;在荧光显微镜下,发光的位置表示了待测物质存在的部位;发光的强度表示了待测物质含量的多少;不同颜色的发光可以表示不同的待测物质[14]。这种方法价格低廉,操作简单[15]。PK-15 细胞是猪肾细胞,其细胞系对猪瘟病毒(classical swine fever virus,CSFV) 等一些猪源病毒都特别敏感。CSFV 在疫苗中的污染被认为是PPRS 疫苗污染的途径之一,去除疫苗毒种中CSFV 的污染是生产合格疫苗的前提。本试验通过IFA 检测PRRS 活疫苗的安全性,有助于对疫苗中污染CSFV 等外源病毒污染危害的控制。
1 材料与方法
1.1 病 毒
未被CSFV 污染的PRRSV(已被相应的特异性抗血清中和)、CSFV、猪圆环病毒2 型(porcine circo virus 2 type,PCV-2),均由山西隆克尔生物制药有限公司提供。
1.2 细 胞
PK-15 细胞由山西隆克尔生物制药有限公司提供。
1.3 疫 苗
试验使用2 批PRRS 活疫苗,批次分别为201901001、201901002,由山西隆克尔生物制药有限公司生产。
1.4 主要试剂
MEM 培养液,购自北京北方同正生物技术发展有限公司;PBS 磷酸缓冲液(pH 值为7.2),购自北京博奥拓达(Biotopped)科技有限公司;新生牛血清,由济南劲牛生物材料有限公司生产;CSFV 间接免疫荧光染色检测试剂盒,购自中国兽医药品监察所;特异性抗血清,由山西隆克尔生物制药有限公司提供。
1.5 主要仪器
超净工作台(型号为BCM-1000A),由江苏苏净集团有限公司生产;二氧化碳培养箱(型号为HF90),购自上海力申科学仪器有限公司;研究级倒置显微镜(型号为OLYMPUS IX73),购自成贯仪器(上海)有限公司;生物安全柜(型号为BSC-1300ⅡA2),由苏州安泰空气技术有限公司生产。
1.6 方 法
1)PK-15 细胞的传代与培养。准备好传代所需要的所有器材,打开超净工作台中的紫外灯,在试验前先照射30 min;从二氧化碳培养箱中取出1 瓶生长良好的PK-15 细胞培养瓶(培养面积75 cm2),用装有75%乙醇的喷壶给手和培养瓶进行消毒;点燃酒精灯,倒掉原培养液,此过程及以下的各个步骤均要在酒精灯附近进行。
用PBS 液洗涤细胞培养瓶,洗掉细胞代谢废物,倒掉PBS,重复2 次;加入1 mL 0.25%胰蛋白酶液(含EDTA),沿瓶壁缓缓转动,使其充分接触长有细胞的细胞培养瓶瓶壁;将培养瓶放入培养箱中,消化大约3 min,使细胞消化分离开来;将细胞培养瓶从细胞培养箱中取出来,然后倒掉胰酶,加入MEM 约10 mL,用带洗耳球的移液管反复吹打(约30 次),将培养瓶壁上的细胞吹打下来,并将溶液中的细胞吹打开来;吹打完毕后,在培养瓶中留3 mL 细胞液,然后用MEM 加到约40 mL,再次吹打细胞和MEM 的混合液,使其混匀;将一部分液体倒入平板槽内,用排枪取槽内的混合液,以每孔100 μL 加入96 孔细胞培养板内,将铺好细胞的培养板盖好、封口,并做好标记;将含有剩余培养液的细胞培养瓶和铺好的96 孔细胞培养板放到37 ℃、5% CO2培养箱中培养,待3 d 后用于下一步的试验。
2)接种。将随机选择的8 瓶(每批次4 瓶,2 个批次共8 瓶样苗)待检测的PRRS 疫苗从冰箱中取出,解冻、复苏,在灭菌后的生物安全柜内用含3%新生牛血清的MEM 培养液在EP 管内进行适当稀释,然后在小型振荡器上震荡混匀。每个EP 管用相应的特异性抗血清中和。
将稀释后待检测的样品加入已长成良好单层的PK-15 细胞的96 孔细胞培养板(接毒前在倒置显微镜下先拍照并保存)对应的孔内,每瓶疫苗设置4 个复孔,每孔100 μL 液体;同时设置阳性对照(CSFV)和阴性对照(未被CSFV 污染的PRRSV)。注意与96 孔细胞培养板上先前标志的序号相对应,之后封口。将接种后的PK-15 细胞培养板放入37 ℃、5% CO2培养箱内培养,培养3 d 后用于免疫荧光检测。
3)免疫检测。使用CSFV 间接免疫荧光染色检测试剂盒时,先要检查内容物组分、保质期,用记号笔在盒子上标记开启时间等信息;将试剂盒中的PBS 以1∶10 的工作浓度进行稀释;取CSFV 间接免疫荧光染色检测试剂盒中的一抗(CSFV 特异性抗体)于EP 管中,用PBS 以1∶300 的工作浓度进行稀释;取CSFV 间接免疫荧光染色检测试剂盒中的二抗(FITC 标记的兔抗猪IgG)于EP 管中,用PBS 以1∶500 的工作浓度进行稀释;将稀释后的一抗和二抗在振荡器上充分搅拌均匀,避免反复冻融,4 ℃保存,尽快使用,二抗应在避光条件下使用。
取单层的待检细胞,阴性对照和阳性对照在倒置显微镜下拍照并保存,后甩掉96 孔细胞培养板维持液,用PBS 洗涤2 次(每次洗涤时,每孔加入200 μL PBS,室温条件下孵育5 min,要严格控制孵育的时间,不可随便增加或减少,然后弃去PBS);固定,每孔加入100 μL 80%冷丙酮溶液,4 ℃固定30 min,然后弃去丙酮,自然晾干;加一抗,用PBS洗涤细胞面1 次,然后每孔加入用PBS 适当稀释后的CSFV 特异性抗体50 μL,37 ℃湿盒作用1 h;洗涤,甩掉里面的液体,每孔加入200 μL PBS。室温下孵育5 min,弃去PBS,洗涤细胞面2 次;加二抗,每孔加入50 μL 用PBS 稀释后的FITC 标记的兔抗猪IgG,37 ℃湿盒作用1 h;洗涤,甩掉里面的液体,每孔加入200 μL PBS。室温下孵育5 min,甩掉PBS,洗涤2 次;观察,在倒置显微镜下用蓝色激发光(波长490 nm)观察;采集照片,并进行分析。
4)特异性试验检测。将PCV-2 稀释,加入到相应的96 孔细胞培养板内,培养3 d 后进行IFA 检测。
5)重复性试验。为了验证此检测方法的稳定性和重复性,保证结果的可靠性,再次培养PK-15 细胞,进行1.6 方法中1)、2)、3)、4)所述的相关操作与检测。在不同时间(分别在3 周内进行试验)、相同试验条件下共重复3 次,所用的一抗和二抗是相同批次。
2 结果与分析
2.1 接毒前PK-15 细胞的形态观察
PK-15 细胞铺板培养3 d 后,在倒置显微镜下观察细胞的形态(图1)。由图1可见,细胞生长良好,细胞大小基本均一,形成致密单层,呈现较好的贴壁生长状态,可用于下一步试验。

图1 正常的PK-15 细胞(40×)
2.2 接种病毒后荧光染色前观察
接种病毒3 d 后,在荧光染色之前用在倒置显微镜下观察细胞的形态,接种用抗血清中和后的确定未被CSFV 污染的PRRSV 的阴性对照组PK-15细胞呈现出如图2所示的形态。接种CSFV 的阳性对照组PK-15 细胞呈现出如图3所示的形态。从图中可以看出,阳性对照和阴性对照的细胞形态都没有发生明显变化,说明CSFV 不会使PK-15 细胞产生明显的病变。

图2 荧光染色前的阴性对照(40×)
图3 荧光染色前的阳性对照(40×)
2.3 荧光染色后倒置显微镜下观察
在形态学观察后进行荧光染色,在倒置荧光显微镜下观察,根据视野下观察到的黄绿色荧光的有无进行判定。在倒置荧光显微镜下,阳性对照的细胞孔内观察到明显的黄绿色荧光(图4),阴性对照的细胞孔内没有观察到黄绿色荧光(图5),说明试验成功。待检样品的细胞孔内均未出现特异性黄绿色荧光(图5),则2 批PRRS 疫苗都判为CSFV 样品检测阴性。
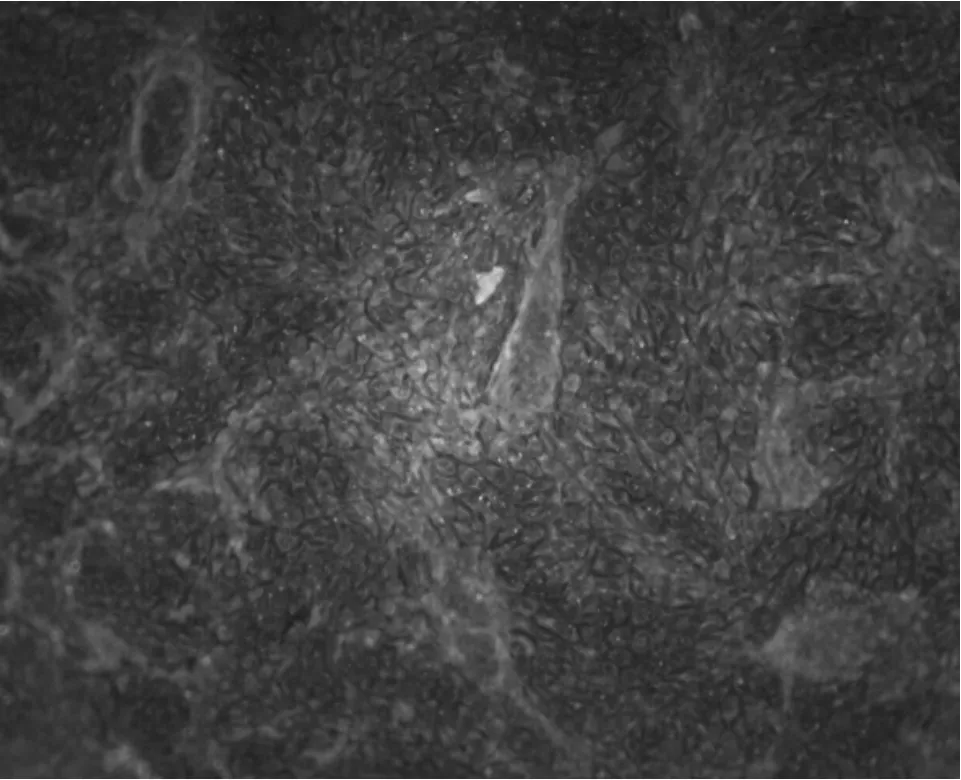
图4 荧光染色后的阳性对照(20×)

图5 荧光染色后的阴性对照(20×)
2.4 特异性试验
PCV-2 接种的PK-15 细胞均未出现特异性黄绿色荧光(图5),判为阴性,说明试剂盒特异性强,仅用于CSFV 的检测。
2.5 重复性试验
通过3 次重复的操作,最终的检测结果一致(见图1~图5),说明本试验方法可重复、稳定和可靠。
3 讨 论
疫苗污染是许多疾病在猪群中传播的重要途径之一,养猪场通过使用污染了的活疫苗可能使阴性猪变为阳性猪,会给养猪场带来严重的经济损失,所以保证使用疫苗的安全性极其重要。运用免疫荧光技术检测病毒抗原已经有20 多年[16],本试验运用IFA 检测CSFV,与实验室其他检测方法相比,具有灵敏度高、直观、经济、特异、快速、简单和可重复等优点,是对CSFV 进行检测的良好方法[14]。而且,此方法在一般的实验室均可进行,在荧光倒置显微镜下观察检测结果,更容易对结果进行判读,因而被广泛应用[14-15]。通常,用IFA 来检测病毒抗原涉及很多影响因素,如抗体浓度、不同来源的血清、孵育时间、孵育温度和固定剂的选择等[17],都可能会导致不同的试验结果。在本研究中,PRRSV 对温度和酸碱度都很敏感,很容易受到它们的影响[17]。因此在试验时,必须设置严格的阳性对照、阴性对照以及特异性试验,并在适宜的试验条件下进行,从而保证试验结果的准确、可靠和特异性。
一般来说,试验的成功与原材料的选择密不可分。PK-15 细胞对CSFV、PRRSV、PCV-2 都很敏感,是用来检测和培养猪源性病毒的良好材料。在本研究中,培养的PK-15 细胞生长状态良好,细胞边缘清晰干净,胞体透明(图1),为试验的成功打下了良好的基础。
在形态学观察时,研究发现阳性对照和阴性对照的PK-15 细胞形态没有发生明显变化,说明CSFV 不会使PK-15 细胞产生明显的病变(如图2和图3所示)。形态学观察和IFA 比较,形态学观察灵敏度低,在病毒含量很少时,不易于观察,所以本研究采用IFA 来进一步检测CSFV。
此外,IFA 检测细胞是胞浆着色,而核不着色。在免疫检测过程中,如果有CSFV 抗原存在,就会和相应的一抗、被标记的二抗形成三者的复合物,细胞孔就会出现特异性胞浆内黄绿色荧光。本研究中,阳性对照孔细胞出现黄绿色荧光(图4),阴性对照孔细胞和接种待检疫苗的细胞孔均未出现特异性胞浆内黄绿色荧光,则都判为阴性(图5),说明被检测PRRS 疫苗均未被CSFV 污染。
本研究建立重复性试验的目的是为了保证试验结果的准确性和可靠性。一个具有说服力的检测方法一定具有可重复性,在不同的时间、不同的地点、相同的试验条件下都可以进行,最终得出相同的结果。本研究中,通过3 次重复的操作,在不同时间(分别在3 周内进行试验)、相同试验条件下最终的检测结果一致,说明本检测方法可重复、稳定和可靠。综上所述,本研究建立的IFA 检测PRRS 活疫苗中CSFV 的方法获得了理想结果,阳性对照和阴性对照对比明显,所有待检2 批PRRS 活疫苗均没有被CSFV 污染。
猪饮水不足损失大
首先,饮水不足会导致猪的肠道发病率增高。农村广大农户家庭养猪,多数采用传统的水料一次性供给的饲喂方式,往往不管天气条件、不分饲料种类,均不给饮水。猪由于饮水不足口渴后,特别是炎热的夏季常出现喝脏水等现象,这种现象直接导致猪患多种肠道疾病。据统计,肠道疾病是近几年来猪的多发性疾病,一般占猪发病总数的76%左右,而在这些肠道疾病中,有不少就是由于猪缺水喝脏水引起的。
其次,饮水不足会导致猪消化率降低,饲养成本提高。目前,农村大多采用圈养猪的饲养方式,每天只饲喂2~3 次水混料,水分供应极为不足。特别是育肥猪,饲养户对育肥猪每天补饲大量的热能饲料,而这些热能饲料需要吸收大量的水分后才能被猪体消化吸收、输送。饲养户每天只饲喂2~3次后就把猪圈在狭小圈舍内,使猪形成肠燥热,肠蠕动减缓,营养吸收不全,日食量逐渐减少,消化率降低,生长发育受阻等。经有关部门对20 户养猪户饲养的100 头猪的抽样调查表明,在饲喂1 h 后,口渴急需饮水的猪就有98 头,占抽查总数的98%。同时,又以肥壮,喂精料、杂糠、米糠的猪口渴程度深,饮水量较大。

