88例骨髓增殖性疾病患者的临床资料分析
肖 超,陶 英,宋陆茜,赵佑山,吴凌云,常春康
(上海交通大学附属第六人民医院血液科,上海 200233)
骨髓增殖性疾病 (myeloproliferative neoplasm,MPN)是一系或多系分化相对成熟的骨髓细胞不断克隆性增殖所导致的一组肿瘤性疾病。原发性骨髓纤维化(primary myelofibrosis,PMF)、真性红细胞增多症(polycythemia vera,PV)和原发性血小板增多症(essential thrombocythemia,ET)是费城染色体阴性MPN 的主要病种[1],这3 种疾病患者都可能发生白血病转化和血栓出血事件,但其临床表现及预后各不相同。2016 版WHO 髓系肿瘤和急性白血病诊断标准[2](以下简称2016 版WHO 诊断标准)将PMF明确区分为原发性骨髓纤维化前期(prefibrotic primary myelofibrosis,pre-PMF)和明显的PMF(overt-PMF),而两者的临床症状和预后均存在明显不同。
迄今为止,只有少数关于MPN 的流行病学研究,因而本研究调查了我院近期连续诊断的88例MPN 患者(主要是PV、ET、PMF),对其疾病参数进行了初步的分析研究,比较pre-PMF 与ET、pre-PMF 与overt-PMF 患者的诊断标准及临床参数,从而明确pre-PMF 诊断的临床价值和重要性,以期为临床治疗选择提供参考。
资料与方法
一、资料
选取2015 年1 月到2018 年1 月我科连续诊断的88例MPN 病例(参考2016 版WHO 诊断标准),收集这些病例的疾病相关数据进行分析研究,包括年龄、性别、诊断分型、白细胞计数、血红蛋白水平、血小板计数、乳酸脱氢酶(lactic aciddehydrogenase,LDH)水平、脾肿大情况、骨髓巨核细胞数和Gomori 银染色、相关基因 (JAK2 V617F、CALR、MPL)突变等。本研究获得我院伦理委员会批准,所有患者均签署知情同意书。
二、方法
血红蛋白含量、血小板计数、白细胞计数均由我院血液病实验室医师抽取患者外周静脉血后,经sysmex xs-800i 血细胞分析仪检测获得数据。每例患者常规进行腹部超声检查,由我院超声科医师经日立超声诊断仪(凸阵探头,3.5 MHz)测得脾肿大数值。骨髓巨核细胞数和Gomori 银染色由我院血液病实验室医师将取得的骨髓活组织经Bouin 液固定,用乙醇脱水,Hemapun865 剂包埋,随后切片并染色,使用OLYMPUS CX41 显微镜进行病理检查所得。基因突变检测由我院血液科医师行骨髓穿刺抽取少量骨髓液(部分骨髓干抽的患者使用外周血代替),经患者知情同意,送往“金域医学检验中心”(第三方医学检测机构),通过片段分析和测序分别检测CALR、JAK2 V617F、MPL 的突变情况。
三、统计学处理
数据应用SPSS 17.0 软件进行统计学分析,P<0.05 时认为有统计学意义。
结果
一、各疾病分型患者的临床特点(见表1)
88例MPN 患者中男性46例 (52%),女性42例(48%);中位年龄为61岁(20~88岁),32例(36%)为老年患者(≥65岁);22例(25%)有脾肿大(1例已行脾切术)。检出JAK2 V617F 突变者有51例(58%),检出CALR 突变5例(6%),检出MPL突变2例(2%),三阴性30例(34%)。使用2016 版WHO 诊断标准进行分类,PV 有20例,ET 有23例,PMF 共45例,其中pre-PMF 为23例 (占PMF 的51%),overt-PMF 为22例(49%)。观察分析PV、ET、pre-PMF、overt-PMF 患者的临床特点,发现存在脾肿大例数、白细胞计数增多(>11×109/L)、血红蛋白含量降低(<100 g/L)、血小板计数降低(<100×109/L)的患者百分比以及LDH 水平、骨髓纤维化程度、骨髓巨核细胞数等都存在组间差异(P<0.05)(见表1)。
二、基因突变情况及各基因组的临床特点
观察PV、ET、pre-PMF、overt-PMF 组间的JAK2 V617F、CALR、MPL 基因突变情况,发现CALR 突变率在4 组间的差异有统计学意义 (P=0.027)(见表1),overt-PMF 组的CALR 突变率高达18%(4/22),其余基因突变率在各组间的差异则无统计学意义。按基因突变情况分组,比较分析各基因组患者的临床特点,发现CALR 突变患者的中位年龄较小,而其发生血小板计数降低、中重度骨髓纤维化的百分比高于其他基因组(见表2)。
三、pre-PMF 与overt-PMF、ET 患者临床症状及预后比较
pre-PMF 患者相比overt-PMF 患者的临床症状轻,两者的白细胞增多、血红蛋白含量降低、血小板计数降低的百分比分别为61%比77%(P=0.235)、22%比50%(P=0.048)、4%比27%(P=0.034),pre-PMF 平均LDH 水平较低 (P=0.037)。虽然overt-PMF 组患者的中位年龄略高于pre-PMF 组,overt-PMF 组中老年患者百分比及脾肿大百分比也有略高于pre-PMF 组的趋势(50%比30%,55%比26%),但差异尚无统计学意义(P 均>0.05)(见表3)。
pre-PMF 患者与ET 患者的临床表现相似,发病中位年龄接近,老年患者所占百分比也大致相同,2 组间的平均LDH 水平以及血红蛋白含量降低、血小板计数降低的百分比差异均无统计学意义(见表3),仅出现脾肿大的百分比和白细胞计数增多的百分比不同,分别是26%比4%(P=0.043)和61%比17%(P=0.007)。然而,对pre-PMF 和ET 患者进行随访发现,ET 患者的生存时间长于pre-PMF 患者(见图1),差异有统计学意义(P=0.038)。

表1 88例患者的临床特点[n(%),中位数(范围)]
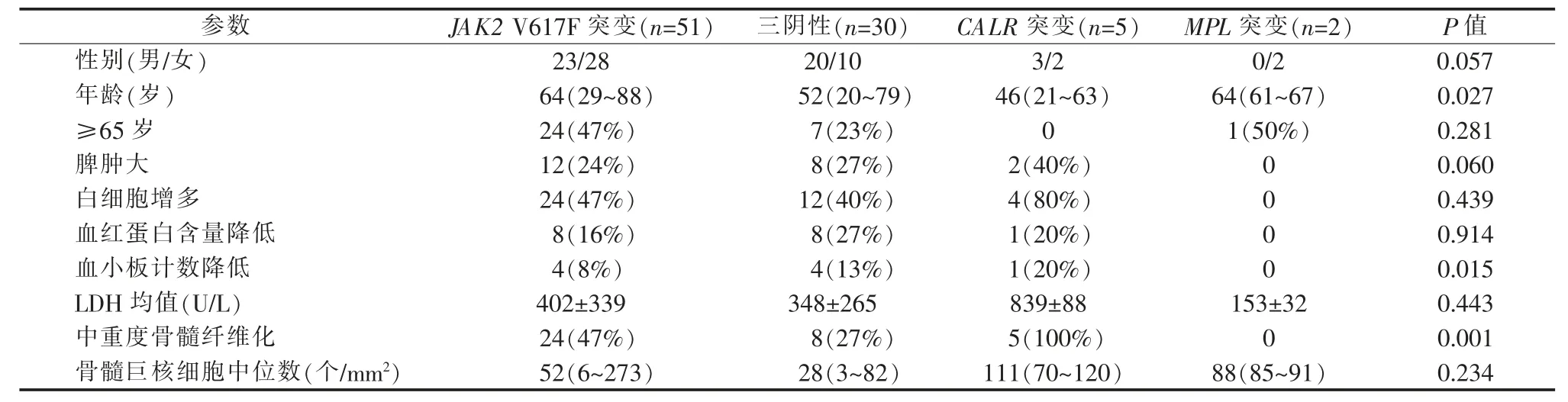
表2 各基因分组患者的临床特点[n(%),中位数(范围)]

表3 pre-PMF 与overt-PMF、ET 患者的临床特点比较[n(%),中位数(范围)]

图1 ET 患者与pre-PMF 患者的生存曲线
将本研究的88例MPN 患者参考2008 版WHO诊断标准[3]进行判断,有24例符合ET 诊断,而其中有1例,若参考2016 版WHO 诊断标准[2]则可诊断为pre-PMF。分析该例患者,患者为39岁女性,无脾肿大,血常规检查示白细胞计数8.4×109/L,血红蛋白78 g/L,血小板计数684×109/L,中性粒细胞计数6.38×109/L;LDH 水平192 U/L;基因突变检测到三阴性;骨髓巨核系增生,未见粒系、红系增生,网硬蛋白Gomori 银染色1 度,生存时间为70个月。因为患者没有满足2008 版WHO 的PMF 诊断标准(未达到2 项次要标准),故被诊断为ET,但其符合2016 版WHO 的pre-PMF 诊断标准(至少1 项次要标准),从生存时间仅为70个月来看,该例患者更符合pre-PMF 诊断。
四、PMF 中发生JAK2 突变患者者与三阴性患者比较
分别比较pre-PMF 组及overt-PMF 组中JAK2 V617F 突变阳性和三阴性患者的临床资料(见表4)。在pre-PMF 组中,三阴性患者与JAK2 V617F 突变者相比,发病中位年龄较小(50岁比65岁,P=0.03),脾肿大百分比较高(46%比0,P=0.017),但两者间其他临床特点(包括性别、白细胞增多、血红蛋白含量降低、血小板计数降低、LDH 均值)差异无统计学意义,提示三阴性pre-PMF 患者的发病年龄较早,且脾肿大症状较明显。在overt-PMF 组中,三阴性患者与JAK2 突变患者相比,临床特点差异均无统计学意义。
讨论
MPN 是由造血干细胞克隆增殖引起的一组异质性疾病,主要的驱动突变基因包括JAK2 V617F、CALR、MPL 基因,其中,PV、ET、PMF(2016 版WHO分类标准分为pre-PMF 和overt-PMF),这些不同疾病分型患者的临床表现及预后各不相同,临床治疗方法也不尽相同。
一、PV、ET、PMF 患者的基因突变与预后
PV 患者的中位生存期约为14 年,而ET 患者的中位生存期约为20 年;PV 患者20 年内的白血病转化率<10%,ET 患者则<5%。在95%的PV 患者中可发现JAK2 V617F 突变,而在不到60%的ET和PMF 患者中可检测到JAK2 V617F 突变[4]。本研究发现,PV、ET、pre-PMF 和overt-PMF 患者的JAK2 V617F 突变率分别 为75%(15/20)、61%(14/23)、43%(10/23)、55%(12/22)。有研究 显示,ET 中的JAK2、CALR、MPL 突变是相互排斥的,其阳性率分别为55%、25%、3%,而约有17%的患者为三阴性[5]。本研究发现,ET 患者中JAK2、CALR、MPL 基因突变及三阴性的比例分别为61%(14/23)、4%(1/23)、9%(2/23)、26%(6/23)。有文献提示,驱动基因的突变状态并未显示对ET 患者生存有影响,但JAK2、MPL 突变与动脉血栓形成高风险有关,而MPL 突变具有较高的纤维化进展风险[5]。本研究中仅发现2例MPL 突变者,均诊断为ET,其骨髓纤维化不明显,Gomori 银染色皆为1 度,尚未发生血栓事件。在之后的治疗过程中,需严密监测患者纤维化的进展情况及血栓预防治疗。

表4 PMF 中JAK2 突变患者与三阴性患者的临床特点比较[n(%),中位数(范围)]
PMF 以造血干细胞衍生的克隆性骨髓增生、细胞因子表达异常、骨髓纤维化、贫血、脾肿大、髓外造血、全身性症状、恶病质、白血病进展和生存期短为特征。国外研究显示,PMF 患者的中位年龄为66岁,男性占61%,38%的PMF 患者血红蛋白<100 g/L,18%的患者血小板计数<100×109/L,13%的患者白细胞计数>25×109/L,24%的患者需要红细胞输注,21%出现脾脏肿大,29%的患者有全身症状,31%的患者有异常核型;其JAK2 基因突变率为61%,MPL 基因突变率为8%,IDH1/IDH2 突变率为4%;低危和高危患者的5 年白血病转化率分别为6%和21%[6]。日本一项研究显示,PMF 诊断的中位年龄为66岁,中位生存期为47个月,3 年总生存率为59%;感染和急性白血病转化是其最常见的死亡原因[7]。本研究发现,PMF(将pre-PMF 与overt-PMF 合并) 的JAK2 突变者占49%(22/45),CALR突变者占9%(4/45),无MPL 突变者;男性占56%(25/45),白细胞计数增多(>11×109/L)、血红蛋白含量降低(<100 g/L)、血小板计数降低(<100×109/L)的百分比分别为69%(31/45)、36%(16/45)、16%(7/45),与国外研究结果相近。
二、pre-PMF 与overt-PMF 的区别
在2016 WHO 诊断标准公布之前,pre-PMF 未被医学界普遍认为是MPN 的一个独特亚群,也未被拿来与overt-PMF 对比分析。直到2017 年,有学者强调了将两者区分为2个单独亚型的重要性。Grisslinger 等[8]的研究表明,pre-PMF 代表overt-PMF的一个前驱阶段,在临床、血液学和分子表型方面,pre-PMF 相对于overt-PMF,其患者有较长的总体生存期以及无白血病和无纤维化存活期;但与其他研究报道一致,pre-PMF 患者的总生存期明显短于ET。pre-PMF 患者相对更年轻,而overt-PMF 患者血液学异常更明显(贫血、白细胞减少、血小板减少、原始细胞计数高),症状更多,脾脏明显肿大,高危分子突变发生频率更高。因此,2016 版WHO 诊断标准将PMF 明确区分为pre-PMF 和overt-PMF,具有很大的预后评估意义。本研究同样发现,pre-PMF患者比晚期PMF 患者的临床症状轻,两者的白细胞增多、血红蛋白含量降低、血小板计数降低的百分比分别为61%和77%、22%和50%、4%和27%,而晚期PMF 的发病中位年龄高于pre-PMF (65岁比61岁),且老年患者的百分比和发生脾肿大的百分比也高于pre-PMF (50.0%比30.4%,54.5%比26.1%)。这些恰好提示了两者预后间的差异,也支持将两者区分的必要性。
有学者发现,相比于overt-PMF,pre-PMF 队列中女性患者比例占优势,提示男性患者快速进展到overt-PMF 的可能性更大[8]。本研究也发现MPN 的某些疾病亚型具有性别优势,PV 中男性占百分比较多(70.0%),而ET 中女性占百分比较多(69.6%),这种现象可能与样本量小导致的性别偏倚有关,也可能与男性雄激素的促红细胞生长功能有关,或许提示性别与疾病间的某种其他联系,需日后扩大样本量进一步研究。
在pre-PMF 中,三阴性患者比JAK2 V617F 突变者的发病中位年龄小,发生脾肿大的例数多,可能提示三阴性患者的症状重、预后差。但在overt-PMF 中,三阴性患者与JAK2 突变患者相比,差异无统计学意义,可能提示三阴性对overt-PMF 的预后影响不大。
三、pre-PMF 与ET 的区别
虽然,pre-PMF 患者与ET 患者的临床表现极为相似,且存在相同的分子标志及基因突变,但pre-PMF 的预后差,死亡率及白血病转化率也相对较高,因而,借助形态学上的不同,仔细区分pre-PMF与ET 具有明确的预后意义[9]。有文献显示,ET 的骨髓组织病理学标志是,具有成熟细胞质和多分叶状核的巨形巨核细胞的特征性增生及成簇聚集[10];而pre-PMF 和overt-PMF 的骨髓组织病理学特点主要是非典型的巨形未成熟巨核细胞伴云状未成熟核,这在ET 和PV 中很难看到。这种异常的原发性巨核细胞粒细胞化生是巨核细胞和粒细胞异常增生的一种双重性肿瘤性增殖,是pre-PMF 的早期特征。骨髓的纤维化是绝大多数PMF 患者的显著特征,但不是ET 的特征,其在pre-PMF 的自然病程中都将或多或少地快速进展。
根据2016 版WHO 的pre-PMF 诊断标准,诊断pre-PMF 至少需要满足贫血、白细胞增多、乳酸脱氢酶升高和脾肿大这4个标准之一。有研究评估了170例pre-PMF 患者这4个标准出现的相对频率,并与225例ET 患者进行比较,发现超过91%的pre-PMF 病例显示出4 种标准中的一种或多种特征,而只有48%的ET 患者有此现象[11]。该研究应用Cox 回归模型分析次要标准对总体存活的影响,发现只有白细胞增多是pre-PMF 和ET 存活率的重要影响因子。pre-PMF 中的分子特征也显示了存活差异,CALR 突变的存活优于JAK2 突变,但在ET中未发现这种差异。该研究比较了pre-PMF 与ET患者的不同结局及相关分子遗传数据,强调了这是2 种不同的疾病概念,而不是相同疾病的连续状态。因此,细致的组织形态学诊断结合次要临床标准,可以区分pre-PMF 与ET。本研究中有1例患者根据2008 版WHO 诊断标准被诊断为ET,而根据2016 版WHO 诊断标准则可诊断为pre-PMF。由于pre-PMF 与ET 间的预后存在差异,因而2016 版WHO 诊断标准对区分pre-PMF 与ET 极为重要,对临床治疗的选择将有极大帮助。
四、基因检测对骨髓纤维化靶向治疗的指导意义
MPN 患者绝大部分最终都会发生骨髓的纤维化,这是一种进展性疾病,而其不断恶化的消耗性症状(包括盗汗、体重减轻、发热)严重影响了患者的生活质量和预后[12-13],超过80%的骨髓纤维化患者可出现脾脏肿大[14]。JAK-STAT 通路失调是骨髓纤维化疾病的特点[12-15],JAK 信号通路可激活STAT的转录因子,从而控制免疫和造血细胞的分化、生长、增殖及存活[16]。超过90%的骨髓纤维化患者存在JAK2 V617F、CALR 或MPL 基因突变,继而导致JAK 信号失调,最终导致造血细胞恶性增殖及炎性因子过度释放[17-18]。JAK 通路抑制剂可以结合JAK1 和JAK2 激酶,调节细胞增殖并减轻脾脏肿大,且这种抑制作用与JAK2 V617F 突变存在与否无关[19]。三阴性患者目前还没有明确的靶基因,而采用二代测序探索这些患者的其他基因情况(如SETBP1、SRSF2、ASXL1、TET2、EZH2、IDH1/IDH2 等),或许能找到潜在的靶基因,并提供更好的治疗办法。
总之,MPN 是一组异质性克隆性血液系统疾病,PV 和ET 患者的中位生存期长于PMF 患者,而PMF 中的pre-PMF 患者与overt-PMF 患者呈现出不同的临床表现及预后,因此区分以上这些疾病对临床治疗策略的选择相当重要,尤其是pre-PMF 与ET、overt-PMF 的鉴别诊断。虽然,pre-PMF患者与ET 患者的临床表现极为相似,但pre-PMF患者出现一种或多种2016 版WHO 诊断标准提及的表现频率高于ET,且pre-PMF 形态学具有特征性的原发性巨核细胞粒细胞化生改变,因此,通过组织形态学诊断结合次要临床标准,可以准确区分pre-PMF 与ET。虽然JAK 通路抑制剂能改善PMF 患者的脾肿大和生活质量,但如果行二代测序找到三阴性患者的潜在靶基因,或许可以找到更好的治疗办法。

