偏振成像的乳腺癌病理切片检测方法
田博文,黄丹飞*,钟艾琦,王雄才,孙雪峰,张玉爽,赵丽颖,王 震,宋 东
(1.长春理工大学光电工程学院,长春 130022;2.吉林大学白求恩第一医院,长春 130022)
运用偏振光学成像技术对生物组织进行表征,有着快速、低损伤、高分辨率的并能提供比非偏振光学方法更丰富的组织结构信息的优点[1]。生物组织可以类比作一个具有多种复杂偏振作用的光学元件,其对入射光偏振态的作用全部都包括在表征生物组织特性的Mueller矩阵中,依据前人的研究,目前所认可的包括二向色性、相位延迟、散射退偏、起偏特性、方位角变化等[2]。为了获得这些反映组织微观结构的特征参数,就要运用Mueller矩阵分解的方法从Mueller矩阵16个阵元中分离提取出只体现本征属性的成像参数[3]。利用Mueller矩阵分解参数对组织进行表征,对于确定病变组织区域的恶性生长边缘以进行精确的手术切除或在活检过程中进行快速辅助诊断有着很好的发展空间[4]。21世纪初,Chung等[5]运用Mueller矩阵分解参数对口腔癌变组织进行检测,发现相关参数能够区分癌变与非癌变组织。Pierangelo等[6]总结了对肠癌组织的Mueller矩阵分解参数,发现其相位延迟参数和散射退偏参数可以区分癌变和非癌变组织。此后,Pierangelo等[7]再次提出Mueller矩阵分解参数可以辅助诊断不同阶段的宫颈上皮瘤组织。但国外针对乳腺癌的这方面研究甚少,中国则几乎没有。
近年来乳腺癌一直位居于女性恶性肿瘤的第一位,其发病率在女性中约占10.4%[8]。随着乳腺癌治疗理念和方法的变化,乳腺癌的快速病理诊断已经成为临床病理检测的重要应用点[9]。病理切片的显微观测仍然是病理评估的“金标准”,由于光学显微镜只能对经染色处理过的切片观测才能判断癌变组织和正常组织的区别,所以病变部位需要取样冰冻后染色制成切片,病理切片的染色制作一定程度上会增加病理检测时长。如果检测结果阳性,还需重新送检,大大延长检测时长。因此,临床上亟需一种快速、客观、准确的病理切片评判方法,来区分癌变与非癌变组织。
利用偏振光成像快速非染色检测并能准确表征生物组织微观结构差异的优点,提出了一种基于偏振成像的乳腺癌病理切片检测的方法。首先设计并搭建了测量组织背向散射光Mueller矩阵的自动化成像系统。随后对未染色的乳腺癌组织病理切片分别进行Mueller矩阵成像,最后对所得到的样本Mueller矩阵图像进行分解计算,提取出具有清晰物理意义且反映组织样本微观结构的特征参数图像,来区分癌变非癌变组织。以期为偏振光在乳腺癌的快速病理诊断提供了一种新的思路。
1 实验
1.1 实验系统
主动偏振成像系统才能获取待测样本Mueller矩阵,所以需要对已知光波进行不同偏振态的调制后入射到待测样本,相应的对于每种偏振态的入射光也都要按照不同偏振态进行检偏。偏振光的调制方法目前有两种类型,相位延迟调制和机械转动调制[10]。相位延迟调制是通过改变偏振器件的相位延迟量来对光波进行调制,最为典型的为液晶可变相位延迟器(liquid crystal variable retarder,LCVR),但其容易受到温度等外界环境因素的影响,导致测量时间不能过长,且每次使用前都需要进行标定。考虑到这些因素,采用机械转动调制中的双旋转波片法(double rotating retarders,DDR)[11],由PLC驱动电控旋转台带动两个1/4波片以恒定的角速度旋转特定角度来实现对光波偏振态的调制,该成像系统示意如图1所示。该系统由中心波长为630 nm的LED阵列光源(LIU630A,美国ThorLabs),光阑,毛玻璃屏L1,线偏振片P1和P2(LPVISC100-MP2-SM1,美国ThorLabs),电控旋转台W1和W2(MAS102,北光世纪),1/4波片Q1和Q2(胶合零级波片,武汉优光科技),成像透镜L2和CMOS相机,以及PLC控制系统和计算机组成。其中,PLC控制系统包括两个二相混合式驱动器(SJ-2H504DM,常州双杰)和一个PLC控制板(FX2N-14MT,国产三菱)。
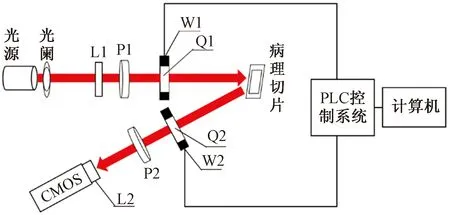
图1 成像系统示意图Fig.1 Imaging system diagram
1.2 实验设计
实验选取的样本为未染色的乳腺癌组织切片,厚度为4 μm。LED阵列光源出射的光经过光阑,并经由毛玻璃屏匀光后,进入到由线偏振片P1和架设在电控旋转台W1上的1/4波片Q1构成的起偏器(polarization state generator,PSG)。先经由PSG调制的偏振光照射到待测组织切片,再通过待测组织的散射进入到由P2和架设在W2上的Q2所构成的检偏器(polarization state analysis,PSA)。成像时,固定P1和P2,透振方向为水平方向,Q1和Q2的快轴方向与其保持一致,计算机与PLC控制系统建立通讯来驱动电控旋转台W1、W2带动Q1、Q2每次以1∶5的角度从0°开始以6°和30°的步长旋转30次,CMOS相机记录每次旋转获得的光强变换图像并传输到电脑中,然后根据光强傅里叶系数求得样本Mueller矩阵的各个元素,最后运用Mueller矩阵分解对所得的Mueller矩阵进行计算得出能够代表样本微观结构的参数图像,单次实验成像时间为分钟。
1.3 实验原理
1.3.1 Mueller矩阵
Stokes矢量是一种简单的描述光波偏振态的数学表达形式,为一个包含四个参数的列向量,用[S0S1S2S3]T表示。Stokes矢量通常和Mueller矩阵一起表示表征光的偏振态和物质的偏振特性[12]。Mueller矩阵为一个4×4的矩阵,用M表示,Stokes矢量与Mueller矩阵之间的关系为Sout=MSin,其中Sin和Sout分别表示系统入射光和出射光的Stokes矢量[13]。在图1的成像系统中入射光为Sin=[1,0,0,0]T,经过PSG调制后从待测组织(Mueller矩阵为MTissues)出射进入PSA,那么最后测得的出射光强表示为
Sout=MPSAMTissuesMPSGSin
(1)
MPSG=MP1MP2
(2)
MPSA=MP2MQ2
(3)
式中:MP和MQ分别为理想偏振片和波片的Mueller矩阵。为了进一步理解,可以把偏振器和检偏器看作一个整体,则可以令A=MPSA,G=MPSGSin则式(1)可表示为
Sout=AMTissuesG
(4)
实验中CMOS相机所探测到的为样本组织经过散射后的光强Iout为Sout的第一个分量,则根据矩阵的运算关系,Iout大小与A的第一行元素有关。令ai为A的第一行元素,gj为G的所有元素,在经过展开合并后,可得:

(5)
根据双波片的快轴旋转角度α比,可以求出矩阵u:

(6)
再由傅里叶变化可得:

(7)
由式(7)可知,Iout的傅里叶系数与待测组织Mueller矩阵MTissues中各元素Mij成函数关系,利用傅里叶变换后的变换系数an、bn,通过计算可求得待测组织的Mueller矩阵:

(8)
1.3.2 Mueller矩阵分解
Mueller矩阵分解是通过对样本的Mueller矩阵进行计算从而提取出具有明确物理意义的成像参数的方法,Lu-Chipman Mueller矩阵分解方法[13](mueller matrix decomposition,MMD)是目前最为广泛应用的分解方法。该方法将样本的Mueller矩阵分解成三个子矩阵相乘的形式,如式(9)所示,分别对应样本的二向色性、相位延迟和散射退偏。
M=MΔMRMD
(9)
下面给出了相关参数的表达式,其详细的推导过程可参考文献[14],首先对式(8)所得待测组织的Mueller矩阵进行归一化得:

(10)
二向色性:

(11)
散射退偏:

(12)
线性相位延迟:
δ=cos-1({[MR(2,2)+MR(3,3)]2+
[MR(3,2)-MR(2,3)]2}1/2-1)
(13)
2 结果
2.1 Mueller矩阵
根据组织病理学可将乳腺癌分为原位癌和浸润癌两个大类。有关研究表明,在电镜下乳腺癌细胞形态学特征为细胞具有高度的异型性,且细胞质内可见张力原纤维丝[15]。偏振成像有着对亚波长微观结构变化十分敏感的特点,所以对这种异型性则会表征出偏振特性差异[16]。在病理切片上选择了由吉林大学白求恩第一医院乳腺外科所提供的未染色乳腺原位癌对照切片和未染色浸润性乳腺癌乳头状瘤对照切片进行Mueller矩阵成像实验。
如图2所示为乳腺原位癌的Mueller矩阵成像结果。其中,图2(a)为实验所使用的乳腺原位癌对照,对照部分(圆形区域)为正常组织。图2(b)为切片的强度图像,由于CMOS相机前置镜头使其成放大的镜像,对照部分变为了左侧部分。图2(c)是强度伪彩色图像。图2(d)是乳腺原位癌对照切片Mueller矩阵,其每个阵元均用m00做归一化处理。
如图3所示为浸润性乳腺癌和乳头状瘤Mueller矩阵成像。图3(a)为浸润性乳腺癌和乳头状瘤切片,上方红色方框区域为乳头状瘤组织,下方黄色方框区域为浸润性乳腺癌组织,剩余部分为正常组织;图3(b)为切片的强度图像;图3(c)是强度伪彩色图像。图3(d)为浸润性乳腺癌和乳头状瘤切片Mueller矩阵,其每个阵元均用m00做归一化处理。

图2 乳腺原位癌Mueller矩阵成像Fig.2 Mueller matrix imaging of breast carcinoma in situ

图3 浸润性乳腺癌和乳头状瘤Mueller矩阵成像Fig.3 Mueller matrix imaging of invasive breast cancer and papilloma
通过实验结果可以看出,未染色病理切片的强度图像癌变组织和正常组织并没有明显区别。与之相比较,图2(d)和图3(d)Mueller矩阵中对角线上阵元m11、m22、m33正常和癌变组织有明显区别,癌变部分呈现出较高的强度值,这是因为癌变组织和正常组织的微观结构的差异被表征出不同的偏振特性。但是具体的偏振特性需要通过Mueller分解的方法来得出。
2.2 Mueller矩阵分解
利用Mueller矩阵分解对上面所得到的病理切片的Mueller矩阵进行分解,可以得到Mueller矩阵的分解参数(散射退偏Δ,线性相位延迟δ,二向色性D),图4所示,为乳腺原位癌对照切片的Mueller矩阵分解结果。图4(a)为散射退偏Δ,正常区域Δ要高于癌变区域,均在0.4以上,这表明在癌变过程中组织细胞形态的改变导致组织散射退偏能力下降;图4(b)为线性相位延迟δ,癌变区域的δ高于正常区域均在0.35以上,这说明癌变区域比正常区域有更强的双折射效应,这是由于癌变过程中组织纤维化造成的;图4(c)为二向色性D,癌变区域和正常区域的值都趋近于0,无法区分癌变和非癌变区域。

图4 乳腺原位癌切片Mueller矩阵分解结果Fig.4 MMD results of breast cancer in situ section
图5为浸润性乳腺癌和乳头状瘤切片 Mueller矩阵分解结果。图5(a)为散射退偏Δ,癌变区域[图3(b)中红色方框乳头状瘤区域和黄色方框浸润性乳腺癌区域]呈现出较低的Δ,接近于0.2左右,正常区域Δ均在0.5以上。同样表明病变过程中组织细胞形态的改变导致组织散射退偏能力下降;图5(b)为线性相位延迟δ,癌变区域δ明显高于正常组织区域。此外,乳头状瘤区域相比浸润性乳腺癌区域呈现出更高的强度,达到0.6以上。表明了乳头状瘤区域相比侵润性乳腺癌区域有着更强的双折射效应。图5(c)为二向色性D,癌变区域和正常区域的值都趋近于0,无法区分癌变和非癌变区域。

图5 浸润性乳腺癌和乳头状瘤切片Mueller矩阵分解结果Fig.5 MMD results of invasive breast cancer and papilloma sections
3 结论
(1)运用双旋转波片法(DDR),设计并搭建了一套乳腺癌病理切片的Mueller矩阵自动成像系统,系统整体由PLC控制。
(2)以乳腺原位癌对照切片和浸润性乳腺癌乳头状瘤对照切片为实验对象进行Mueller矩阵成像,实验结果表明,该系统能够正确对病理切片进行成像,癌变组织和非癌变组织有明显的偏振特性差异,单次成像时间为2 min。
(3)对上述两类切片的Mueller矩阵图像进行分解,得到Mueller矩阵分解参数图像。实验结果表明,乳腺原位癌组织相比正常组织散射退偏能力较低,而双折射能力较强;浸润性乳腺癌和乳头状瘤组织有相同的特性,此外乳头状瘤组织比浸润性乳腺癌组织有着更强的双折射能力;相比于强度成像散射退偏参数Δ和线性相位延迟参数δ能够区分癌变区域和正常区域。为乳腺癌的病理切片快速有效检测提出了新的参考方法。