miRNA-132通过靶向PDCD4在多发性骨髓瘤细胞黏附介导的耐药性中的作用
周佳妮 马泳泳


[摘要] 目的 探讨miR-132对程序性死亡4基因(PDCD4)的靶向作用,及其在多发性骨髓瘤细胞黏附介导的耐药性中的作用。 方法 利用荧光素酶报告基因分析miR-132对PDCD4的靶向调控关系。对人骨髓瘤细胞株U266进行miR模拟物和抑制物转染,之后比较地塞米松(Dex)、多柔比星(Dox)、硼替佐米(Bort)处理下U266细胞的药物敏感性。Transwell法检测U266细胞的迁移能力。MTT法和CCK-8法检测细胞增殖活性。 结果 Dex和Dox干预后细胞的抑制率显著上升(P < 0.05),而Bort干预后细胞的抑制率无显著变化(P > 0.05)。荧光素酶报告基因分析结果证实PDCD4是miR-132的靶基因。上调miR-132可以抑制PDCD4基因和和蛋白的表达(P < 0.05)。miR-132上调后U266细胞的迁移距离显著增加(P < 0.05)。miR-132上调后U266细胞的黏附率和增殖活性显著增加(P < 0.05)。 结论 miR-132可以靶向PDCD4调控多发性骨髓瘤细胞黏附介导的耐药性。
[关键词] miR-132;程序性死亡4基因;多发性骨髓瘤;耐药性;细胞黏附
[中图分类号] R741 [文献标识码] A [文章编号] 1673-7210(2020)05(b)-0004-05
The role of miRNA-132 in multiple myeloma cell adhesion mediated drug resistance by targeting PDCD4
ZHOU Jia′ni1 MA Yongyong2
1.Department of Hematology, Ningbo Medical Center Li Huili Hospital, Zhejiang Province, Ningbo 315000, China; 2.Department of Hematology, the First Affiliated Hospital of Wenzhou Medical University, Zhejiang Province, Wenzhou 325000, China
[Abstract] Objective To explore the targeting effect of miR-132 on programmed death 4 gene (PDCD4) and its role in the adhesion mediated drug resistance of multiple myeloma cells. Methods Luciferase reporter gene was used to analyze the targeting regulation of miR-132 on PDCD4. Human myeloma cell line U266 was transfected with miR mimic and inhibitor, and then the drug sensitivity of U266 cells treated with Dexamethasone (Dex), Doxorubicin (Dox) and Bortezomib (Bort) was compared. Transwell method was used to detect the migration ability of U266 cells. MTT and CCK-8 methods were used to detect cell proliferation. Results After Dex and Dox intervention, the inhibition rate of cells increased significantly (P < 0.05), while the inhibition rate of Bort did not change significantly (P > 0.05). Luciferase reporter gene analysis confirmed that PDCD4 was the target gene of miR-132. Up regulation of miR-132 could inhibit the expression of PDCD4 gene and protein (P < 0.05). The migration distance of U266 cells increased (P < 0.05). After miR-132 was up-regulated, the adhesion rate and proliferation activity of U266 cells increased (P < 0.05). Conclusion miR-132 can target PDCD4 to regulate multiple myeloma cell adhesion mediated drug resistance.
[Key words] miR-132; Programmed death 4 gene; Multiple myeloma; Drug resistance; Cell adhesion
多發性骨髓瘤(multiple myeloma,MM)属于恶性浆细胞病[1-4]。MicroRNAs(miR)为非编码小RNA,可参与调控肿瘤的发生,侵袭及转移,耐药等行为[5-7]。miR-132在MM中鲜有报道。程序性死亡4基因(programmed cell death 4,PDCD4)属于抑癌基因,其低表达水平下降可促进肿瘤细胞的增殖、侵袭和转移。既往研究证实,通过调节PI3K/AKT信号通路可调控PDCD4基因参与人子宫内膜癌的发生发展过程[8-9]。本研究验证了miR-132与PDCD4靶向调控的关系,以及对U266细胞生长及耐药的影响,具体报道如下:
1 材料与方法
1.1 细胞
人骨髓瘤细胞株U266购自上海江林生物科技有限公司,培养于完全培养基(RPMI1640基础培养基中添加10%胎牛血清同时添加双抗,青霉素100 U/mL,链霉素0.1 mg/mL),培养条件为37℃,5%CO2。
1.2 实验方法
1.2.1 药物抑制试验 U266细胞先转染miR-132抑制剂(终浓度为100 nmol/L),之后使用地塞米松(Dexamethasone,Dex)50 nmol/L,多柔比星(Doxorubicin,Dox)100 nmol/L,硼替佐米(Bortezomib,Bort)5 nmol/L处理U266细胞,培养48 h后检测细胞活性,并计算抑制率,抑制率=(OD未处理孔-OD加药孔)/OD未处理孔×100%。
1.2.2 miR模拟物和抑制物转染 将U266细胞转移至6孔板中,加入含2.5 μL模拟物的100 μL培养基,静置5 min,加入转染试剂Lipofectmine2000(Invitrogen公司,批号:33658),静置20 min,每孔加入800 μL无血清培养基,模拟物的终浓度为50 nmol/L,抑制物的终浓度为100 nmol/L。细胞分组:转染模拟物的细胞为模拟物组,转染抑制物的细胞为抑制物组,未做任何处理的细胞为未处理组,采用PBS作参照的细胞为PBS组。
1.2.3 RT-PCR检测 用Trizol试剂盒(美国Invitrogen公司,批号:15596026)提取细胞总RNA。逆转录后进行RT-PCR检测。每个样本重复3次。反应条件:95℃预变性30 s,95℃变性5 s,54℃退火15 s,72℃延伸10 s,收集荧光,共40个循环。
1.2.4 荧光素酶报告基因分析 PDCD4的WT或MUT 3′-UTR质粒由科雷生物科技有限公司提供。将质粒克隆至pGL3 Basic载体中,将50 nmol/L miR-132模拟物与10 μg PDCD4转染U266细胞[10]。用双荧光素酶报告基因检测试剂盒(上海沪震实业有限公司,批号:11402HZ60)测定荧光素酶活性。
1.2.5 细胞迁移能力检测 使用Transwell侵袭小室(美国Costar公司,批号:3422)检测U266细胞的迁移能力。检测步骤严格按照试剂盒说明书进行。
1.2.6 细胞黏附实验 培养U266细胞悬液接种于96孔板中,培养12 h,加入MTT(美国Sigma公司,M1218)在培养箱中培养4 h,加入DMSO 200 μL,震荡10 min。黏附率=A黏附细胞/A总细胞×100%。
1.2.7 细胞活性检测 使用MTT法和CCK-8检测细胞活性。MTT和CCK-8试剂盒均购于美国Sigma公司,批号分别为M1218和T6522,操作步骤严格按照试剂盒说明书进行。
1.2.8 Western blot检测 收集细胞蛋白样品,进行SDS-PAGE电泳,随后进行转膜、封闭、一抗孵育、二抗孵育。使用Image QuantTMLAS4000成像系统(美国GE公司)显色。本研究以GAPDH作为内参。
1.3 统计学方法
采用SPSS 20.0统计学软件进行数据分析,计量资料数据用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD检验;以P < 0.05为差异有统计学意义。
2 结果
2.1 U266细胞转染模拟物和抑制剂后miR-132的表达
转染模拟物后U266细胞中miR-132的表达显著升高(图1A、B)。转染模拟物的U266细胞中miR-132的表达显著升高,而转染抑制剂的U266细胞中miR-132的表达显著降低(P < 0.05)(图1C)。
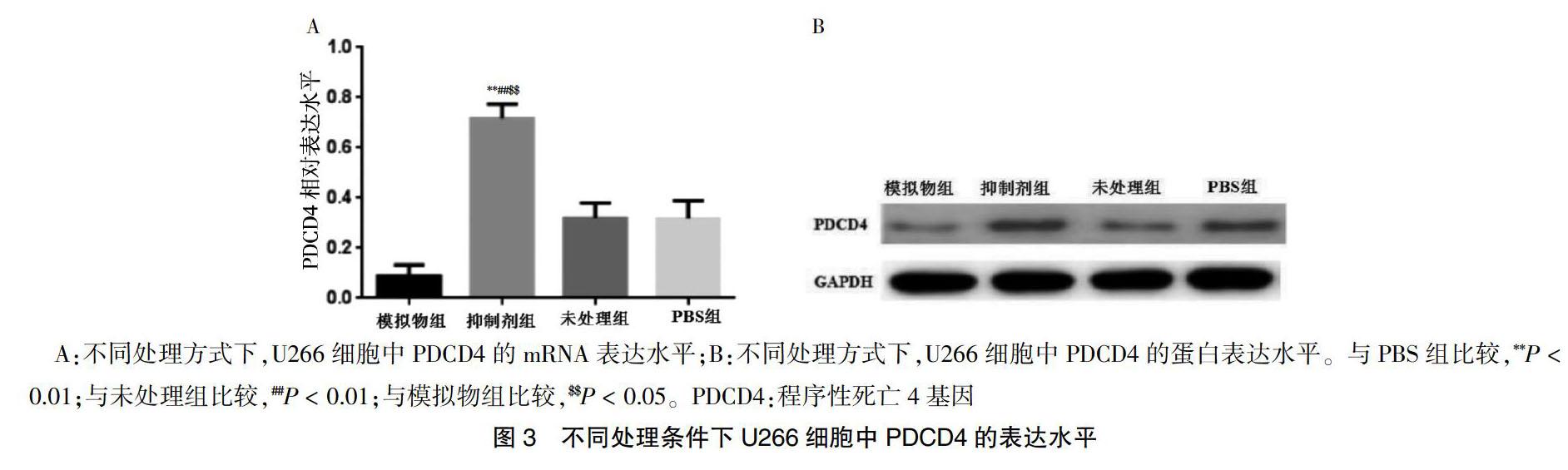
A、B:U266细胞转染模拟物和抑制剂后miR-132的表达(400×);C:四组miR-132的相对表达水平比较。与PBS组比较,**P < 0.01;与未处理组比较,##P < 0.01;与模拟物组比较,$$P < 0.05
2.2 miR-132表达水平对U266细胞药物敏感性的影响
在未处理的U266细胞中,Dex的抑制率为(14.28±0.25)%,Dox的抑制率为(31.05±1.03)%,Bort的抑制率为(28.16±1.04)%;在加入抑制剂的U266细胞中,Dex的抑制率为(36.24±2.06)%,Dox的抑制率为(42.36±3.16)%,Bort的抑制率为(30.12±1.25)%。与未处理条件下各种药物的抑制率比较,加入抑制剂的细胞中Dex和Dox的抑制率显著上升,差异有统计学意义(P < 0.05),而Bort的抑制率无显著变化(P﹥0.05)。
2.3 miR-132对PDCD4的靶向作用
Target Scan(www.targetscan.org)预测结果显示,PDCD4是miR-132的靶基因。PDCD4 3′UTR包含miR-132的保守結合区(图2A)。miR-132模拟物与包含WT-PDCD4的荧光素酶载体共转染后,降低了U266细胞的活性,荧光素酶活性分别下降66.02%和73.06%(P < 0.05)(图2B)。miR-132模拟物可以下调PDCD4基因和蛋白的表达(P < 0.05)(图2C、D)。
2.4 miR-132对PDCD4表达的影响
抑制miR-132的表达可显著上调PDCD4的mRNA水平(P < 0.05)(图3A)。抑制miR-132的表达可显著上调PDCD4的蛋白水平(图3B)。
2.5 不同处理条件下U266细胞的迁移能力和黏附率比较
miR-132上调后U266细胞的迁移距离显著增加,抑制miR-132表达可降低U266的迁移距离(P < 0.05)(图4A、B)。miR-132上调后U266细胞的黏附率显著增加,反之下降(P < 0.05)(图4C、D)。
2.6 不同处理条件下U266细胞的增殖活性
与未处理组U266细胞的增殖活性比较,miR-132上调后U266细胞的增殖活性显著增加,当miR-132的表达受到抑制时,U266的增殖活性降低(P < 0.05)。见图5~6。
3 讨论
在MM的发生发展过程中,多种miRNA表达异常[11-14]。miR-132与多种疾病的发生发展相关,在多种疾病中出现异常变化[15-16],例如Diao等[17]发现miR-132可通过调控其靶基因scn1a和scn2a的表达参与记忆的过程。有研究表明[18-19],miR与肿瘤耐药相关。Dex、Dox、Bort是治疗MM的常用药物。本研究发现,miR-132表达下调可提高U266对Dex和Dox的耐药率,而对Bort的耐药率无影响。
PDCD4为抑癌基因,其表达量降低提示肿瘤患者的不良预后,因此PDCD4可成为治疗肿瘤的新靶点[10]。有研究证实[20],miR-132可能通过抑制PDCD4的表达参与肿瘤生长和转移的过程。本研究提示,PDCD4是miR-132的靶基因。抑制miR-132的表达可显著上调PDCD4的mRNA水平和蛋白水平,以此提示miR-132可通过调节靶基因PDCD4的表达进而参与到肿瘤细胞的发生发展过程。本研究中使用化学合成的miR-132的模拟物和抑制物转染U266细胞,结果显示,未转染或转染抑制剂的U266细胞显示出较强的迁移能力,且细胞的黏附能力降低,以此提示抑制miR-132的表达可降低U266细胞的运动能力,骨髓瘤细胞中miR-132对PDCD4有调控作用,说明这可能与PDCD4的参与有关。
综上,miR-132在MM的进展中起到重要作用,本研究发现miR-132的下调可抑制骨髓瘤细胞的迁移能力和黏附能力。PDCD4是miR-132的靶点。miR-132可能是治疗MM的靶点。
[参考文献]
[1] 苑冬阳,廖爱军.老年多发性骨髓瘤治疗研究进展[J].中华实用诊断与治疗杂志,2019,33(4):403-405.
[2] 尹雪娇,孙春艳,胡豫.骨髓微环境在多发性骨髓瘤发病机制中的作用[J].国际输血及血液学杂志,2017,40(3):232-235.
[3] 刘佳慧,邱录贵,安刚.肿瘤相关髓系细胞在多发性骨髓瘤免疫微环境形成中的作用[J].白血病·淋巴瘤,2018, 27(11):690-693.
[4] Manni S,Carrino M,Semenzato G,et al. Old and young actors playing novel roles in the drama of multiple myeloma bone marrow microenvironment dependent drug resistance [J]. Int J Mol Sci,2018,19(5):E1512.
[5] Zhu J,Zhang X,Gao W,et al. lncRNA/circRNA/miRNA/mRNA/ceRNA network in lumbar intervertebral disc degeneration [J]. Mol Med Rep,2019,20(4):2574-2584.
[6] Conte M,Dell'Aversana C,Sgueglia G,et al. HDAC2-dependent miRNA signature in acute myeloid leukemia [J]. FEBS Lett,2019,593(18):3160-3174.
[7] 嚴笑,欧阳桂芳,徐凯红,等.多发性骨髓瘤患者血清miRNA-181a水平与病理特征的关系[J].中国现代医生,2019,34(22):9-12.
[8] Qiu X,Wei Y,Liu C,et al. Hyperandrogen enhances apoptosis of human ovarian granulosa cells via up-regulation and demethylation of PDCD4 [J]. Gynecol Endocrinol,2019, 6(12):1-5.
[9] Wang X,Li Y,Wan L,et al. Downregulation of PDCD4 induced by progesterone is mediated by the PI3K/AKT signaling pathway in human endometrial cancer cells [J]. Oncol Rep,2019,42(2):134-142.
[10] Dupont S. Luciferase Reporter Assays to Determine YAP/TAZ Activity in Mammalian Cells [J]. Methods Mol Biol,2019,18(93):19-30.
[11] Avivi I,Cohen YC,Suska A,et al. Hematogenous extramedullary relapse in multiple myeloma-a multicenter retrospective study in 127 patients [J]. Am J Hematol,2019,94(10):1132-1140.

