桦褐孔菌醇提物抑制胃癌发生发展的作用及分子机制研究
王蔚 周忠光 杨婧 刘旭 田明 乔羽 仲丽丽
[摘要] 目的 研究樺褐孔菌醇提物(IO醇提物)对胃癌BGC-823裸鼠移植瘤的抑制作用,推测其作用机制与PI3K/AKT通路相关性。 方法 48只裸鼠使用异位移植瘤造模法建立胃癌模型,造模后按照随机数字法分为IO醇提物高剂量组(3 mg/g)、中剂量组(1 mg/g)、低剂量组(0.75 mg/g),阴性对照组(羧甲基纤维素钠灌胃),模型组(不灌药物),阳性对照组(卡培他滨灌胃,0.5 mg/g),每组各8只。灌胃14 d,处死小鼠,剥离肿瘤组织,称重计算抑瘤率;光镜和电镜下观察药物干预后肿瘤组织形态变化;免疫组织化学法检测相关蛋白4E-BP1、p27kip1、Bcl-2、Bax、caspase-3的表达;逆转录-聚合酶链式反应法(RT-PCR)检测磷酸酶基因(PTEN)、磷脂酰肌醇-3-羟激酶(PI3K)、蛋白激酶(AKT)、雷帕霉素靶蛋白(mTOR)表达;蛋白免疫印迹法(Western blot)测定PI3K、p-AKT蛋白表达。 结果 与阴性对照组、模型组比较,各IO醇提物组肿瘤重量降低(P < 0.05),生长受到抑制(P < 0.05);各IO醇提物组的肿瘤坏死、凋亡、细胞器破坏明显;与阴性对照组、模型组比较,各IO醇提物组Bcl-2细胞平均光密度值降低,4E-BP1、p27kip1、Bax、caspase-3细胞平均光密度值升高(P < 0.05);RT-PCR检测结果示,PTEN在各IO醇提物组表达均高于阴性对照组、模型组,低于阳性对照组(P < 0.05),mTOR、PI3K和AKT表达低于阴性对照组、模型组,高于阳性对照组(P < 0.05)。Western blot检测结果示,各IO醇提物组PI3K、p-AKT蛋白表达低于阴性对照组、模型组,高于阳性对照组(P < 0.05)。 结论 IO醇提物具有较为明显的胃癌抑制作用,其机制可能与PI3K/AKT通路及其上下游因子有关。
[关键词] PI3K/AKT通路;胃癌;桦褐孔菌;分子机制
[中图分类号] R285.5 [文献标识码] A [文章编号] 1673-7210(2020)05(b)-0008-06
Study on the inhibitory effect of Alcohol extract of Inonotus Obliquus on the development and progression of gastric cancer and its molecular mechanism
WANG Wei1 ZHOU Zhongguang2▲ YANG Jing1 LIU Xu3 TIAN Ming3 QIAO Yu4 ZHONG Lili5
1.Teaching and Research Department of Pathology, Basic Medical College, Heilongjiang University of Chinese Medicine, Heilongjiang Province, Harbin 150040, China; 2.Teaching and Research Department of Histoembryology, Basic Medical College, Heilongjiang University of Chinese Medicine, Heilongjiang Province, Harbin 150040, China; 3.Experiment and Training Center, Heilongjiang University of Chinese Medicine, Heilongjiang Province, Harbin 150040, China; 4.Teaching and Research Department of Shanghan, Basic Medical College, Heilongjiang University of Chinese Medicine, Heilongjiang Province, Harbin 150040, China; 5.Department of Pathology, the First Clinical Medical College, Heilongjiang University of Chinese Medicine, Heilongjiang Province, Harbin 150040, China
[Abstract] Objective To investigate the inhibitory effect of Alcohol extract of Inonotus Obliquus (Alcohol extract of IO) on transplanted tumor of gastric cancer BGC-823 in nude mice, and speculate the relationship between the mechanism and PI3K/AKT pathway. Methods Forty-eight nude mice were used to establish gastric cancer models by heterotopic transplantation. After modeling, they were randomly divided into Alcohol extract of IO high-dose group (3 mg/g), middle-dose group (1 mg/g) and low-dose group (0.75 mg/g), negative control group (hydroxymethyl cellulose sodium lavage), model group (no drug), positive control group (Capecitabine lavage, 0.5 mg/g). according to the random number table method, with 8 mice in each group. Mice were sacrificed after 14 days of intragastric administration, tumor tissues were stripped and tumor inhibition rate was calculated by weighing. The morphological changes of tumor tissues after drug intervention were observed under light microscope and electron microscope. The expressions of 4E-BP1, p27kip1, Bcl-2, Bax and caspase-3 were detected by immunohistochemistry. The expressions of Phosphatase gene (PTEN), phosphatidylinositol-3-hydroxykinase (PI3K), protein kinase (AKT), and target of rapamycin (mTOR) were detected by reverse transcription-polymerase chain reaction (RT-PCR). The protein expressions of PI3K and p-AKT were detected by Western blot. Results Compared with the negative control group and model group, the weight of tumor were reduced in Alcohol extract of IO group (P < 0.05), the growth in each Alcohol extract of IO groups was inhibited (P < 0.05). In the each Alcohol extract of IO groups, tumor necrosis, apoptosis and organelle destruction were more obvious (P < 0.05). Compared with the negative control group and model group, the average optical density of Bcl-2 in each Alcohol extract of IO groups was decreased, the average optical density of 4E-Bp1, p27kip1, Bax and caspase-3 was increased (P < 0.05). RT-PCR detect results showed that, the expression of PTEN in each Alcohol extract of IO groups was higher than that in the negative control group and model group, and was lower than that in the positive control group (P < 0.05); the expressions of mTOR, PI3K and AKT in the each Alcohol extract of IO groups were higher than those in the positive control group, and were lower than those in the negative control group and model group (P < 0.05). Western blot detect results showed that, the expressions of PI3K and p-AKT protein in each Alcohol extract of IO groups were lower than those in negative control group and model group, and were higher those that in the positive control group (P < 0.05). Conclusion Alcohol extract of IO has obvious inhibitory effect on gastric cancer, and its mechanism may be related to PI3K/AKT pathway and its upstream and downstream factors.
[Key words] PI3K/AKT pathway; Gastric cancer; Inonotus Obliquus; Molecular mechanism
胃癌是癌症死亡的第二大原因,它发病隐匿,致癌因素常见,我国是胃癌的高发区,每年新发的胃癌约占全球新发胃癌的50%[1]。胃癌术后5年生存率低于25%,这严重影响社会劳动力和生产活动,给患者的家庭带来了危害[2]。胃癌的常规治疗方法是手术加化疗,近年来对于胃癌根治术有所改进[3],但发展更大的是药物治疗方面,特别是中草药的使用,改善了患者术后的生存情况,减弱了化疗药物的毒副作用,提高患者生存年限和生命质量。中草药可以从整体改善机体状态,提高免疫力,某些中草药的提取物对肿瘤本身也具有攻击能力[4]。桦褐孔菌醇提物就是这样一类在桦褐孔菌(Inonotus Obliquus,IO)中提取的混合物,主要包括桦褐孔菌醇等[5]。课题组的前期工作证明了其对多种消化系统肿瘤的抑制作用,现进一步探究其对胃癌抑制作用的机制。胃癌的发生与很多信号通路有关,其中PI3K/AKT信号通路的地位不可替代,它与细胞的增殖、凋亡、转移等都密切相关[6]。本研究推测桦褐孔菌醇提物抗胃癌作用也与此通路相关,磷脂酰肌醇-3-羟激酶(PI3K)、蛋白激酶(AKT)、雷帕霉素靶蛋白(mTOR)及其下游的分子均有可能成为其效应分子。
1 对象与方法
1.1 实验动物
裸鼠购于北京维通利华实验动物技术有限公司,许可证号SCXK(京)2016-0006,雄性,体重17~22 g。在无特定病原体条件下(SPF级)饲养。实验动物来自具有实验动物生产许可证的机构,撰写的文章中动物实验内容与实际使用情况相符,符合伦理委员会要求,并在其监督下进行。
1.2 主要仪器与试剂
人系BGC-823胃癌细胞(中国科学院上海细胞生物研究所);桦褐孔菌醇提物(由黑龙江中医药大学药学院提供,纯度>90%);胎牛血清、RPMI-1640、胰酶、山羊血清、抗体(6 mL,北京中杉金桥生物公司);Western blot试剂(碧云天生物技术有限公司,P0013);RT-PCR试剂盒[宝日医生物技术(北京)有限公司,DRR037]。CO2培养箱(日本SANYO公司);酶标分析仪(南京德铁实验设备有限公司);紫外分光光度计(日本岛津,UV-2401);荧光定量(美国ABI,PCR7500);PageRulerTM Prestained Protein Ladder(美国Thermo公司,26616)。
1.3 实验分组与处理
选取雄性裸鼠,4~6周龄,体重20 g左右,在SPF级动物房内72 h适应性饲养。采用异位移植瘤造模法造模,取对数生长期的胃癌BGC-823细胞培养至需要数量,消化后调整细胞密度为2×106个/mL,接种于小鼠腋下,接种量为0.2 mL细胞悬液。7 d后小鼠腋下出现直径>1 cm的皮下结节为建模成功,按随机数字表法分为6组,每组8只裸鼠。各IO醇提物组采用羧甲基纤维素钠(CMC)作为溶剂,IO醇提物高剂量组(3 mg/g),IO醇提物中剂量组(1 mg/g),IO醇提物低剂量组(0.75 mg/g);阳性对照组使用卡培他滨,按体表面积折算后,剂量为0.5 mg/g;阴性对照组给予CMC溶剂。各药物组和对照组每只小鼠0.3 mL灌胃,1次/d,连续灌胃14 d。
1.4 观察指标及检测方法
1.4.1 IO醇提物对BGC-238荷瘤小鼠抑瘤率测定 停药次日处死动物,取肿瘤称重,计算肿瘤重量抑制率[肿瘤重量抑制率=(W对照组-W实验组)/W对照组×100%]。
1.4.2 光镜及电镜下观察肿瘤形态 苏木精-伊红(HE)染色:切取组织块厚度为0.2~0.3 cm,用4%甲醛固定,脱水、透明,切片,烤片,HE染色。电镜观察切取组织块大小为0.2 cm×0.5 cm×1.0 cm,预固定使用2%~3%戊二醛固定液,蒸馏水冲洗后1%锇酸固定,0.1 mol/L磷酸钠缓冲液浸洗,乙醇梯度脱水,浸透,环氧树脂包埋,醋酸铀染色,观察细胞及细胞器的形态变化。
1.4.3 免疫组化法检测相关蛋白表达 石蜡切片脱水后,去除内源性过氧化氢酶,抗原修复后加入一抗,室温孵育1 h,磷酸盐缓冲溶液(PBS)冲洗后加二抗,室温孵育5~10 min,去除PBS液,加DAB液显色,苏木精复染,自来水返蓝。酶标仪检测4E-BP1、p27kip1、Bcl-2、Bax、caspase-3蛋白平均光密度值。
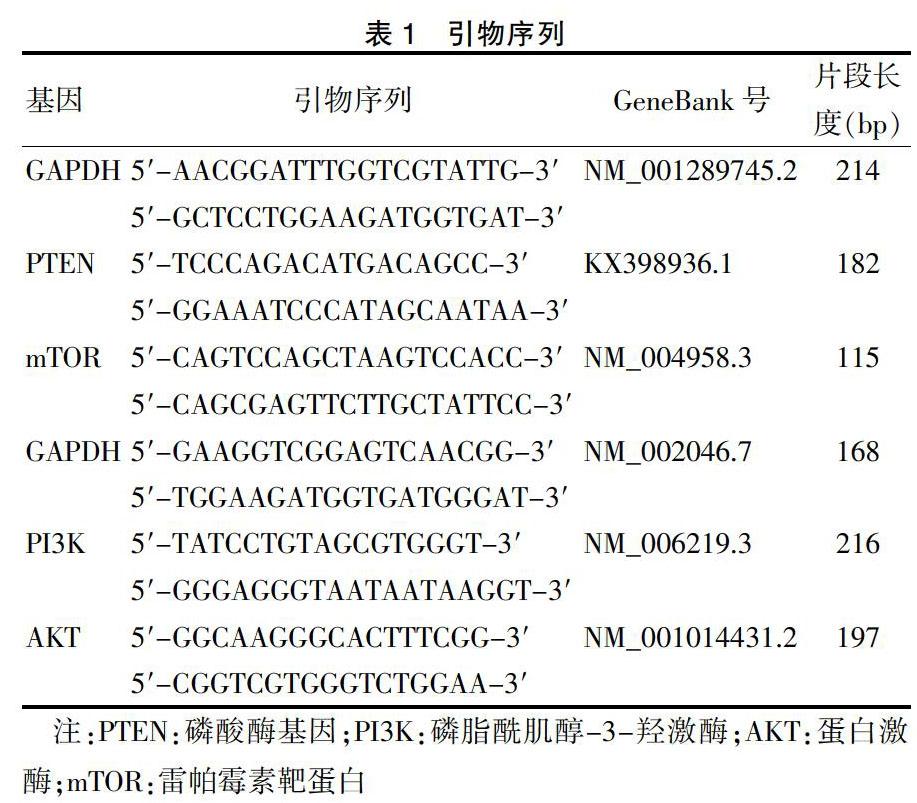
1.4.4 RT-PCR检测相关mRNA表达 据NCBI GeneBank上的基因序列设计一对引物,扩增的片段长度为100~300 bp。采集组织样用于提取总RNA,于酶标仪280 nm处进行检测吸光度。两步法PCR扩增标准程序:预变性95℃ 30 s;95℃ 5 s,60℃ 34 s,40個循环。凝胶电泳,凝胶成像显影。测定PTEN、PI3K、AKT、mTOR的mRNA表达量。
1.4.5 Western blot检测PI3K、p-AKT蛋白表达 不同组织经裂解液裂解,提取总蛋白,BCA法测定总蛋白浓度。SDS-PAGE(聚丙烯酰胺凝胶)电泳分离蛋白,PVDF膜转膜,TBST缓冲液洗涤2次,5%脱脂牛奶封闭,一抗(1∶1000)4℃冰箱过夜,二抗(1∶1000)室温下孵育1 h免疫杂交。滤干,将显影底物A和B等体积混合至滴注于PVDF膜上,约1 min后凝胶图像处理系统分析目标带的光密度值。
1.5 统计学方法
使用SPSS 22.0软件对数据进行统计学分析,连续性变量采用Kolmogorov-Smirnov进行正态性检验,符合正态分布的数据采用均数±标准差(x±s)表示,不同组间小鼠瘤重的比较采用单因素方差分析,组间两两比较采用LSD检验。以P < 0.05为差异有统计学意义。
2 结果
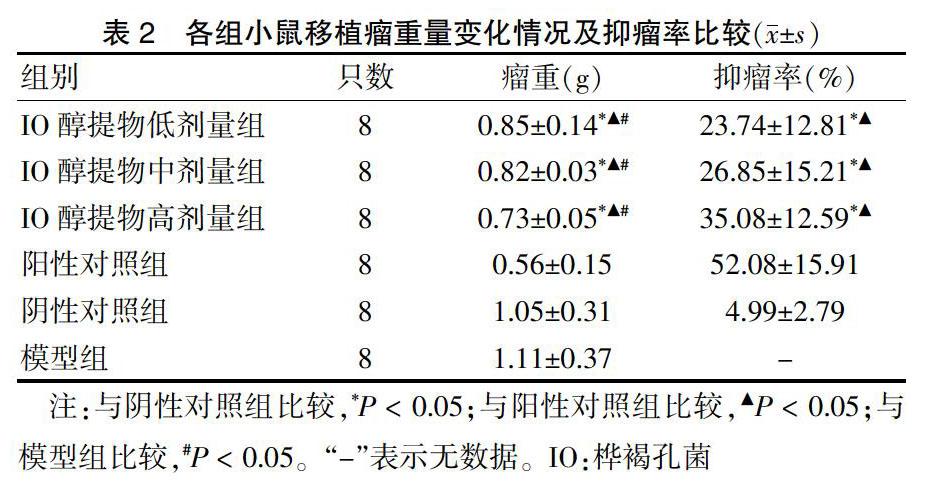
2.1 IO醇提物对荷瘤小鼠肿瘤重量的影响
给药后,与阴性对照组及模型组比较,各IO醇提物组的肿瘤重量均减轻(P < 0.05),但较阳性对照组的瘤重增高,抑瘤率降低(P < 0.05),高剂量组抑瘤作用明显。见表2。
2.2 移植瘤形态变化情况
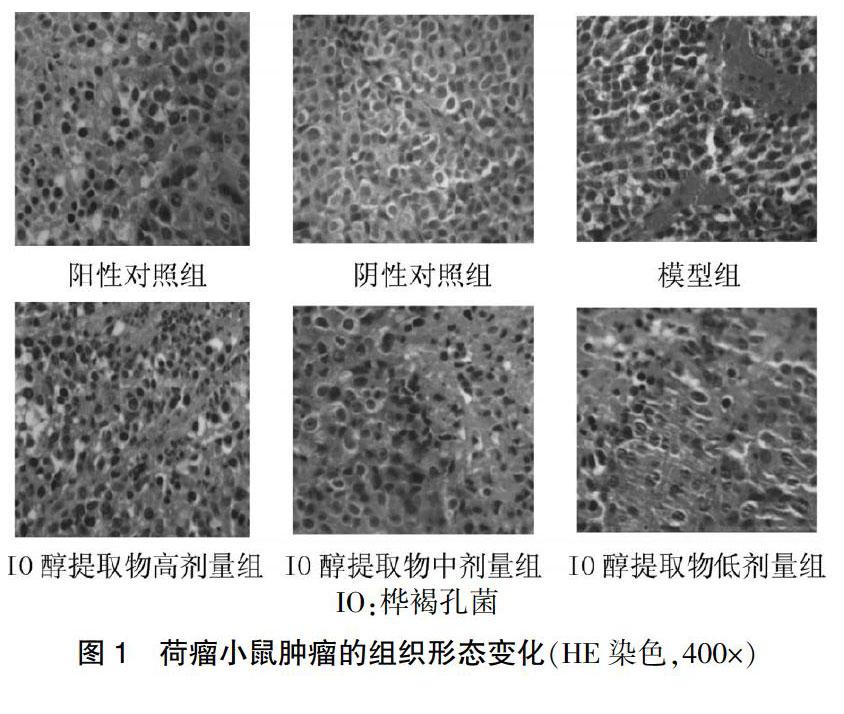
2.2.1 组织结构改变 药物干预后胃癌BGC-823荷瘤小鼠的肿瘤变化明显。HE切片IO醇提物高、中、低剂量组均见肿瘤细胞凝固性坏死,细胞质深染,其中IO醇提物高剂量组坏死细胞较多,与阳性对照组相似,较阴性对照组和模型组血管及肿瘤细胞数量减少。见图1。
2.2.2 超微结构改变 各IO醇提物组可见较多坏死、凋亡、焦亡细胞,细胞碎片多,细胞器肿胀,线粒体嵴减少,肿瘤细胞核裂解成块或固缩;IO醇提物低剂量组细胞残存较多,IO醇提物高剂量组空白区域多见。阳性对照组凋亡、焦亡细胞,细胞器改变明显,细胞质见空泡。阴性对照组和模型组均可见肿瘤细胞发育良好,细胞器功能及结构完善,肿瘤细胞核大,完整且深染,核内的染色体及核仁明显。见图2。
2.3 IO醇提物对胃癌BGC-823荷瘤小鼠的4E-BP1、p27kip1、Bax、Bcl-2、caspase-3蛋白吸光度的影响
免疫组化染色显示,4E-BP1、p27kip1、Bcl-2、Bax、caspase-3在细胞质有表达,呈黄染颗粒,见图3。4E-BP1、p27kip1、Bax、caspase-3在各IO醇提物组的平均光密度值随药物浓度降低呈递减趋势,均低于阳性对照组(P < 0.05),高于阴性对照组和模型组(P < 0.05);各IO醇提物组Bcl-2平均光密度值随药物浓度降低呈递增趋势,均高于阳性对照组(P < 0.05),低于阴性对照组和模型组(P < 0.05)。见表3。
2.4 IO醇提物对胃癌BGC-823荷瘤小鼠的mTOR、PTEN、PI3K、AKT的mRNA影响
PTEN mRNA在各IO醇提物组表达均高于阴性对照组和模型组,低于阳性对照组,差异有统计学意义(P < 0.05);随着IO醇提物浓度的提高,PTEN mRNA的表达呈上升趋势。各IO醇提物组mTOR、PI3K、AKT的mRNA表达均低于阴性对照组和模型组,高于阳性对照组,差异有统计学意义(P < 0.05)。见表4。
2.5 IO醇提物对胃癌BGC-823荷瘤小鼠PI3K、p-AKT蛋白的影响
与阴性对照组和模型组比较,各IO醇提物组PI3K和p-AKT表达较低(P < 0.05),但高于阳性对照组(P < 0.05)。见图4、表5。
3 讨论
俄罗斯人用桦褐孔菌泡酒来治疗肿瘤,它有“西伯利亚灵芝”之称[7-9]。桦褐孔菌醇提物具有良好的抑制肿瘤细胞增殖,加速肿瘤细胞凋亡等作用[10-11]。李根培等[12]用桦褐孔菌醇提物作用小鼠S180肉瘤,发现对其生长有显著抑制作用。白杨等[13]证明桦褐孔菌醇对人卵巢癌SKOV3细胞的增殖和凋亡具有影响。王李俊等[14]证明桦褐孔菌醇可诱导人乳腺癌MCF-7细胞凋亡。Zhang等[15]指出桦褐孔菌醇可以抑制Hela细胞的迁移、侵袭。
在胃癌生长与抑制的各种机制中,PI3K/AKT/mTOR信号通路至关重要,大量的临床研究显示,在胃癌及癌旁组织中均有PI3K、p-AKT蛋白的阳性表达,且表达水平与肿瘤大小、有无淋巴结转移、浸润程度、分化程度及分型有关[16-17]。马志恒等[18]在胃癌组织、癌旁组织、正常黏膜组织检测p-AKT蛋白,阳性率分别为68%、49%、21%。程玉等[19]收集25例正常胃组织和60例胃癌组织,发现PI3K mRNA、AKT1 mRNA和蛋白在胃癌组织中的表达高于正常胃组织,胃癌浸润加深,淋巴结转移p-AKT、PI3K表达量升高。Singh等[20]分析PTEN、PI3K、mTOR对胃癌细胞的作用机制,发现此通路的抑制剂可以改善胃癌的恶化状态。这一通路所调控下游分子对肿瘤的生长产生影响,4E-BP1与eIF-4G有竞争性抑制作用,从而影响蛋白质合成;mTOR可以使p70S6K磷酸化激活,启动蛋白质翻译信号,增强某些mRNA的转录和翻译。AKT下游分支可以影响Bcl-2/bax、caspase-3的蛋白表达[21-24]。
本研究的结果显示,IO醇提物灌胃后,促进肿瘤增长的活性因子PI3K、AKT、mTOR表达下降,抑制肿瘤生长PTEN表达增加。PTEN抑癌基因表达增加,重要调控底物PI3K、AKT、mTOR的mRNA表达减少;PI3K/AKT通路关键蛋白PI3K、p-AKT的表达降低。其抗胃癌作用机制即可能为上调PTEN,抑制PI3K、p-AKT、mTOR的表达,影响整个通路;同时或可直接影响某些底物,如4E-BP1、p70S6K、Bcl-2、bax、caspase-3等的蛋白表達,抑制肿瘤生长,促进肿瘤凋亡。
综上所述,推测桦褐孔菌醇提物可通过PI3K/AKT通路抑制胃癌BGC-823细胞增殖,促进细胞凋亡。结果提示桦褐孔菌醇提物可能成为一种新的有效的胃癌抑制药物,从而脱离桦褐孔菌作为保健品使用的命运,但目前对于桦褐孔菌抗肿瘤作用的机制还需更进一步研究,以保证其临床使用的可靠性、安全性。
[参考文献]
[1] Chan WL,Lam KO,Lee VHF,et al. Gastric Cancer-From Aetiology to Management:Differences Between the East and the West [J]. Clin Oncol,2019,31(8):570-577.
[2] 李卫威,智晓玉,胡毅.晚期胃癌的治疗进展[J/OL].解放军医学院学报:1-5[2019-09-03].
[3] 李荣庚,章红权,曾志华.腹腔镜全胃切除联合D2淋巴结清扫术治疗进展期胃癌的疗效[J].上海医药,2019,40(15):35-37.
[4] 吴建春,徐静,殷晓聆,等.中草药调节活性氧抗肿瘤的研究进展[J].中华中医药杂志,2019,34(4):1589-1594.
[5] 部丽丽.制备HPLC法分离纯化桦褐孔菌醇的研究[D].上海:上海师范大学,2018.
[6] 孙跃胜,窦巩昊,陈恩德,等.胃癌病灶内幽门螺杆菌感染与病理特征、凋亡侵袭基因和PI3K/AKT信号通路的关系[J].中国微生态学杂志,2019,31(6):666-669,676.
[7] 齐亭娟,周玉柏,曾毅.桦褐孔菌活性成分及药理作用的研究进展[J].智慧健康,2018,4(24):50-53.
[8] Han YQ,Nan SJ,Fan J,et al. Inonotus obliquus polysaccharides protect against Alzheimer′s disease by regulating Nrf2 signaling and exerting antioxidative and antiapoptotic effects [J]. Int J Biol Macromol,2019,131:769-778.
[9] Duru KC,Kovaleva EG,Danilova IG,et al. The pharmacological potential and possible molecular mechanisms of action of Inonotus obliquus from preclinical studies [J]. Phytother Res,2019,33(8):1966-1980.
[10] 趙卓卓,冉棋,丁辉,等.桦褐孔菌醇研究进展[J].食用菌学报,2018,25(4):121-129.
[11] Yan L,Wenting Z,Chun C,et al. Inotodiol protects PC12 cells against injury induced by oxygen and glucose deprivation/restoration through inhibiting oxidative stress and apoptosis[J]. J Appl Biomed,2018, 16(2).
[12] 李根培,朴惠善,陈兰仙.1桦褐孔菌乙醇提取物抗肿瘤活性的实验研究[J].求医问药:下半月刊,2012(2):12.
[13] 白杨,叶龙,李晓京,等.桦褐孔菌醇对人卵巢癌SKOV3细胞增殖和凋亡的影响[J].实用妇产科杂志,2013,29 (6):441-444.
[14] 王李俊,杨琴,王飞,等.桦褐孔菌醇诱导人乳腺癌MCF-7细胞凋亡的分子机制研究[J].中草药,2016,3(6):970-973.
[15] Zhang SD,Yu L,Wang P,et al. Inotodiol inhibits cells migration and invasion and induces apoptosis via p53-dependent pathway in HeLa cells [J]. Phytomedicine,2019,60:152957.
[16] 池苗苗,王亚坤,谢长生.南方红豆杉水提物通过PI3K/AKT/mTOR信号通路调控HER2阳性胃癌移植瘤生长实验研究[J].浙江中西医结合杂志,2019,29(3):176-180,259.
[17] 石燕燕,李树才,孙军.人参皂苷Rg3通过PI3K/AKT信号系统调控CaM基因表达促进胃癌BGC-823细胞的凋亡[J].中国肿瘤生物治疗杂志,2018,25(6):590-594.
[18] 马志恒,陈建新,蒋海存,等.p-AKT,p-ERK在胃癌组织中表达及其意义[J].中华保健医学杂志,2016,18(4):274-277.
[19] 程玉,李春辉,刘海旺,等.Akt1信号通路在胃癌组织中的表达及意义[J].广东医学,2015,36(4):560-562.
[20] Singh SS,Yap WN,Arfuso F,et al. Targeting the PI3K/AKT signaling pathway in gastric carcinoma: A reality for personalized medicine [J]. World J Gastroenterol,2015, 21(43):12261-12273.
[21] Sun R,Cheng E,Velásquez C,et al. Mitosis-related phosphorylation of the eukaryotic translation suppressor 4E-BP1 and its interaction with eukaryotic translation initiation factor 4E (eIF4E) [J]. J Biol Chem,2019,294(31):11840-11852.
[22] Li J,Liu WJ,Hao HL,et al. Rapamycin enhanced the antitumor effects of doxorubicin in myelogenous leukemia K562 cells by downregulating the mTOR/p70S6K pathway [J]. Oncol Let,2019,18(3):2694-2703.
[23] Subbarayan S,Subramanian S,Senthil KN. Recombinant Pierisin-5 Induces Apoptosis and Differential Expression of Bcl-2,Bax,and p53 in Human Cancer Cells [J]. DNA and Cell Biology,2019,38(8):773-785.
[24] 陈昱文.健脾补土组方对体外神经元低氧/复氧后凋亡及PI3K、AKT、caspase3、caspase8表达的影响[D].长沙:湖南中医药大学,2017.
(收稿日期:2019-07-18 本文编辑:任 念)

