百香果皮果胶的理化及凝胶特性
黎英,周荣池,刘夏蕾,梁月霜,罗正成,汪美珍
(龙岩学院, 福建 龙岩, 364012)
百香果又名西番莲、鸡蛋果,为半木质藤本攀缘或多年生常绿草质植物,在我国台湾、海南、广东、福建等地种植历史较长,并产生了一定的商业规模。整个百香果鲜果中,果皮约占50%~55%,百香果皮不仅含有膳食纤维、维生素、花色苷及果胶等有益成份,还含有大量的水分[1-2]。现阶段国内加工企业对于百香果的产品开发主要集中在果肉饮料加工,利用百香果皮所生产的制品受限于技术等原因,主要是初加工产品,如果脯、果酱及蜜饯类等食品,产品种类单一,生产总量少,加工水平较低,附加值也不高。同时因百香果皮水分含量高,造成其贮藏困难、易腐烂变质,污染环境。因此,合理开发和利用百香果皮,增加百香果皮附加值,减少环境污染,很有现实意义。
果胶是一种亲水性植物多糖,主要由α-1,4-糖苷键连接的聚半乳糖醛酸长链聚合而成,分子质量大多为10 000~40 000 Da,具有多种药学特性,如降血脂、降血糖、预防肥胖、保护胃黏膜等功效,作为一种凝胶剂、增稠剂、乳化剂和稳定剂在食品、化工等各领域被广泛应用[3-5]。
百香果皮果胶含量较高,目前,关于西番莲果胶或百香果果胶的研究多为提取工艺、纯化、组成和抗氧化等方面研究,如刘运花等[6],陈颖珊等[7-8],黎英等[9],彭雅玲等[10]对这相关方面进行了探究。而对百香果皮果胶理化性质、傅里叶红外光谱、质构特性及凝胶特性研究甚少,所以对百香果皮果胶进行理化指标、红外光谱分析、质构和凝胶特性的深入研究具有实际意义。本研究将百香果皮果胶作为原料,根据GB2553—2010/QB2484—2000中的方法研究了其理化特性,利用傅里叶红外光谱分析了果胶中主要的官能团结构.并研究了果胶质量浓度、蔗糖添加量、温度、pH、金属离子类型对百香果皮果凝胶特性和持水性的影响,以期为百香果皮作为一种新型原材料用于提取商品化果胶奠定基础。
1 材料与方法
1.1 实验材料
1.1.1 材料与试剂
百香果鲜果皮(紫香1号)由龙岩道心农业发展有限公司提供,将百香果皮清洗,烘干,粉碎过80目筛后备用;咔唑、D-(+)-半乳糖醛酸、考马斯亮蓝G-250、牛血清蛋白,北京博奥拓科技有限公司;卡拉胶、商品果胶(柑橘)、黄原胶,中盛生物科技有限公司;柠檬酸,河南誉信生物科技;C2H5OH、KBr、H2SO4、FeCl3、、CaCl2、MgCl2、ACl2等,均为国产分析纯。
1.1.2 仪器与设备
ST16R高速冷冻离心机,美国Thermo;CW-2000超声-微波协同萃取/反应仪,上海新拓分析仪器科技有限公司;EYELA N-1300旋转蒸发仪,日本东京理化公司;SX2-4-10箱式电阻炉,上海跃进医疗器械厂;UV-9100紫外可见分光光度计,北京莱伯泰科仪器有限公司;UB-7 PH,计美国丹佛;ZD-2自动电位滴定仪,上海精密科学仪器有限公司;FDV超细微粉碎机,燕山正德;IS10型傅立叶红外光谱仪,美国Nicolet仪器公司;NH310全自动色差仪,深圳市三恩驰科技有限公司。
1.2 实验方法
1.2.1 百香果皮果胶的制备
称取5.0 g粉末,按照液料比30∶1(mL∶g)加入蒸馏水,柠檬酸调节pH至2.0,50 ℃水浴60 min后,协同萃取(50 W超声、600 W微波)8.0 min,抽滤,浓缩后用4倍体积的体积分数为95%的乙醇过夜,滤饼(用乙醇反复洗涤2次)真空冷冻干燥,即得百香果皮果胶。
1.2.2 百香果皮果胶理化性质的测定
1.2.2.1 含水量测定
参照国标GB5009.3—2010[11],取1~2 g(精确至0.01 g,下同)百香果皮果胶于105 ℃干燥2 h后,放入干燥器中冷却称量,多次重复至正负误差小于0.002 g,按公式(1)计算百香果皮果胶含水量:
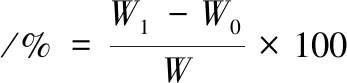
(1)
式中:W1,百香果皮果胶和干燥前称量瓶的质量,g;W0,百香果皮果胶和干燥后称量瓶的质量,g;W,百香果皮果胶质量,g。
1.2.2.2 灰分含量测定
参照企标QB2484—2000[12],取1~5 g百香果皮果胶于马弗炉中,以3.5 ℃/min的升温速度至580 ℃,灼烧至恒重,按公式(2)计算百香果皮果胶灰分含量:
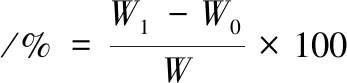
(2)
式中:W1,瓷坩埚和百香果皮果胶灰分的质量,g;W0,瓷坩埚的质量,g;W,百香果皮果胶质量,g。
1.2.2.3 酸不溶性灰分测定
称取上述灰分,按照GB25533—2010直接称重法[13],加入20 mL HCl煮沸5 min,过滤(恒重砂芯漏斗),洗涤(热蒸馏水)至滤液不含Cl-,于(105±2)℃烘至恒重,百香果皮果胶的酸不溶挥发含量按公式(3)计算:
(3)
式中:W1,百香果皮果胶不溶灰分和砂芯漏斗的质量,g;W0,砂芯漏斗的质量,g;W,百香果皮果胶的质量,g。
1.2.2.4 溶解度测定
参照李加兴等[14]文献略作修改,称取0.2~0.5 g百香果皮果胶,加入50 mL蒸馏水并用HCl(0.1mol/L)调pH至4.0,水浴(40 ℃,0.5 h),过滤(砂芯漏斗),滤液先蒸干(90 ℃水浴锅),再烘至恒重(105 ℃烘箱),百香果皮果胶的溶解度按公式(4)计算:

(4)
式中:W1,滤液恒重时的质量,g;W,百香果皮果胶质量,g。
1.2.2.5 半乳糖醛酸含量测定
参考黎英等[9]文献采用硫酸咔唑法进行测定:精确吸取1.0 mL百香果皮果胶提取液,用蒸馏水稀释到适当质量浓度后取稀释液1.0 mL,注入6 mL浓H2SO4,混匀加热20 min(沸水浴),冰浴降至室温。最后加入质量浓度为1.5 g/L咔唑-乙醇溶液0.5 mL,混匀静放暗处1 h,于528 nm波长处测其吸光度,由标准线性方程A=0.005C-0.005 2(R2=0.998 9)计算得到半乳糖醛酸含量。
1.2.2.6 酯化度测定
采用滴定法测定,称取0.5~1 g百香果皮果胶粉末,加少量无水乙醇润湿后加50 mL蒸馏水,置于磁力恒温搅拌器上搅拌至溶解,加入酚酞1滴, NaOH(0.1 mol/L)滴定至刚变色并记录消耗体积(V1),继续加入NaOH(0.1 mol/L)10 mL 混匀,静置2.0h(室温),再加入HCl(0.1 mol/L)10 mL,最后用NaOH(0.1 mol/L)滴定至刚变色并记录消耗体积(V2)。按公式(5)计算果胶的酯化度:

(5)
式中:V2,NaOH终点消耗体积,mL;V1,NaOH初始消耗体积,mL。
1.2.2.7 蛋白质含量测定
参考黎英等[15]文献采用考马斯亮蓝法测定:于试管中精确移取稀释后的百香果果胶样品1.0 mL,按标准曲线制作方法操作加入考马斯亮蓝G-250溶液 4.0 mL,反应5.0 min后于595 nm波长处测其吸光度,由标准线性方程A=0.008 2C+0.030 6(R2=0.995 3)计算得到蛋白质含量:
1.2.3 百香果皮果胶色差测定
按赵兴等[16]文献中所述方法,采用全自动色差仪在自然光下进行测定,白板校准后测定L*、a*、b*,ΔE(色差值)按公式(6)计算。
(6)
式中:L*(0~100):“0” 代表黑色,“100” 代表白色;a*(-80~100):“+” 代表偏红,“-” 代表偏绿;b*(-80~70):“+”代表偏黄,“-”代表偏蓝。值越大或越小表示偏向趋势越严重。ΔE(0~1.5):人眼感觉不到差异;ΔE(1.5~3.0):人眼感觉稍有差异;ΔE(3.00~6.0):人眼感觉到差异;ΔE(6.0~12.0):人眼感觉很明显差异;ΔE(>12.0):人眼感觉不同颜色。
1.2.4 百香果皮果胶质构特性测定
参照文献[17]方法略作改动,配制100 mL混合液(含0.1%黄原胶、0.1%百香果皮果胶、30% 蔗糖、0.9%卡拉胶、0.1%柠檬酸),拌匀,水浴杀菌(85 ℃,15 min),密封,冷藏(4 ℃,18 h)。按上述操作制备加入0.1%商品柑橘果胶和未添加果胶样品,进行对照试验。
用CT3质构仪[18],使用TA11(Φ25.4 mm,L35.0 mm)探头,在TPA测试模式,2.0 mm/s预测速度,1.0 mm/s测试和返回速度,5 g触发点负载,10 points/s数据频率,50%目标形变,2次压缩,10 s间隔时间条件下对样品(Φ60 mm×50 mm)进行测试,获得硬度、弹性、黏着性、回复性和咀嚼性等指标,对每组样品平行测定3次,每次测试完成将探头擦拭干净。
1.2.5 百香果皮果胶傅立叶红外光谱测定
取所提取的百香果皮果胶粉末5.0 mg与0.500 g KBr在红外灯下用玛瑙研钵研匀,KBr做对照,干燥1 h(60 ℃),制成薄片,在500~4 000 cm-1范围内扫描[19]。
1.2.6 百香果皮果胶的凝胶特性分析
1.2.6.1 百香果皮果胶凝胶强度和持水性测定
参照洪亚男的方法[20]制备凝胶体系:于2份50 mL柠檬酸-磷酸氢二钠缓冲溶液中,分别加入一定质量的百香果皮果胶粉末和蔗糖,水浴(80 ℃)搅拌溶解,恒温后将添加蔗糖的溶液缓慢混入,10 min后取出,冷藏(4 ℃,24 h),备用。
采用TA10(Φ12.7 mm,L35.0 mm)探头,TPA测试模式,4.5 g触发点负载,10 mm下压距离,10 points/s数据频率,1次压缩,1.0 mm/s预测速度,0.5 mm/s测试和返回速度条件下测定果胶的硬度(使果胶凝胶形变到一定程度时所出现的最大力),形变与硬度的乘积即为凝胶强度[21]。
持水性测定参照洪亚男[20]、刘贺等[22]的方法略做修改,于底部有脱脂棉离心管中称取一定量凝胶,离心(4 000 r/min,15 min),倒出上层凝胶,按公式(7)计算持水率:
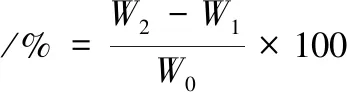
(7)
式中:W0,凝胶质量,g;W1,离心前脱脂棉和离心管质量,g;W2,离心后离心管和脱脂棉质量。
1.2.6.2 各因素对百香果皮果胶凝胶特性的影响
按1.2.6.1制备凝胶体系,设定50%蔗糖添加量、1%百香果皮果胶添加量、80 ℃水浴温度、pH 3.0、未添加金属离子为常规量,以百香果果皮果胶质量浓度(4、8、12、16、20、24 g/L)、蔗糖质量浓度(300、400、500、600、700、800 g/L)、温度(40、50、60、70、80、90 ℃)、pH(2.0、2.4、2.8、3.2、3.6、4.0)、金属离子(空白、Fe3+、Mg2+、Ca2+、Cu2+、Al3+)中的6个单因素变量替换相应的常规量进行考察,测定其持水性和凝胶强度。
1.3 数据处理
数据测试均重复3次并以X±SD表示,统计分析运用 SPSS 20.0 软件。
2 结果与分析
2.1 百香果皮果胶的理化性质
由表1可知,提取的百香果皮果胶均符合国标规定食品安全果胶标准。其中干燥失重、灰分和酸不溶性灰分指标均低于国标规定,溶解度为(85.95±0.70)%,半乳糖醛酸含量为(81.99±1.54)%,酯化度为(66.46±0.41)%,三者都高于商品柑橘果胶,且蛋白质含量较低,综上可知百香果皮果胶是一种纯度较高、溶解性好的高酯优质果胶。
2.2 百香果皮果胶色度分析
由表2可知,百香果皮果胶较商品柑橘果胶样品相比L*值偏小,即百香果皮的颜色较商品柑橘果偏暗。a*值偏大即百香果皮果胶较商品柑橘果胶样品偏红,b*小于商品果胶表明颜色偏淡黄,综合分析百香果皮果胶色差值,表明其色泽为黄褐色,与肉眼观察结果相符。出现这一颜色的原因可能与百香果皮果胶未纯化含有部分色素和杂质有关[16]。
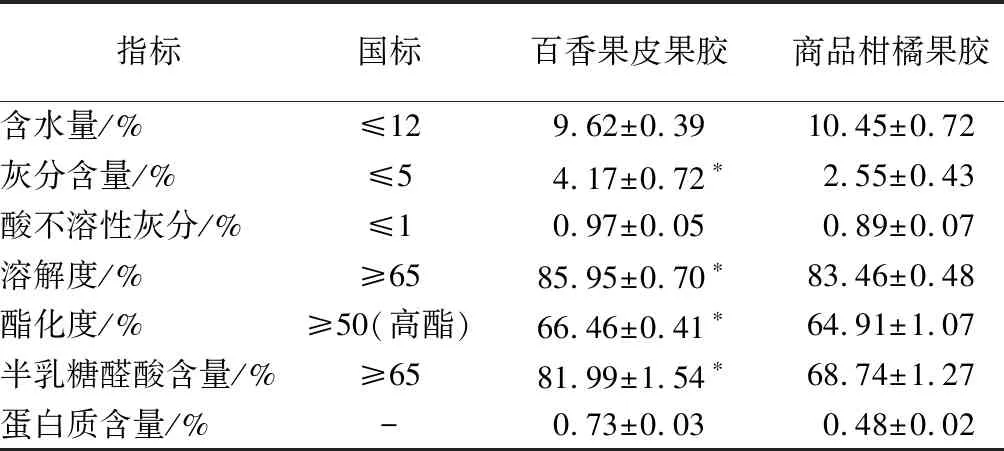
表1 百香果皮果胶的理化性质Table 1 Physicochemical properties of passion fruit peel pectin
注:*表示同一行的差异显著(P<0.05)(下同)

表2 果胶色差的测定Table 2 Color and aberration anlusis of the pectin
2.3 百香果皮果胶的凝胶质构分析
由表3可知,相同条件下,加入1 g/L百香果皮果胶和添加1 g/L商品柑橘果胶的凝胶样品内聚性相差不大,百香果果胶凝胶体系的胶着性较商品柑橘果胶样品低,但其硬度、弹性和咀嚼性均比商品柑橘果胶样品高。实验表明凝胶质地在添加百香果皮果胶后变得较坚硬,弹性较好,爽口而耐咀嚼。

表3 百香果皮果胶的质构特性Table 3 Texture properties of pectin from passion fruit peel
注:同行不同小写字母表示差异显著(P<0.05)
2.4 百香果皮果胶的傅立叶红外光谱分析

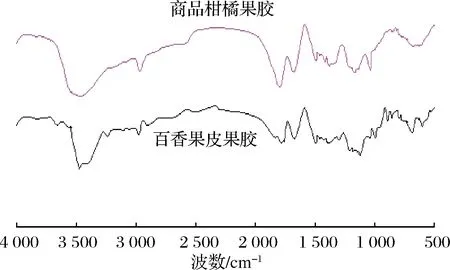
图1 百香果皮果胶的红外光谱图
Fig.1 Infrared spectrum of pectin in passion fruit peel
2.5 百香果皮果胶凝胶特性
2.5.1 百香果皮果胶质量浓度对百香果皮果胶凝胶特性的影响
由图2可知,百香果皮果胶质量浓度与果胶凝胶的形成密切相关。百香果皮果胶添加量为24 g/L时,样品的持水性和凝胶强度分别达到了85.6%和921 g·mm,是质量浓度为4 g/L时的6.5倍和15倍。这可能由于低质量浓度时溶于水的果胶分子过于分散,形成的氢键作用力弱,因而形成的凝胶不稳定,凝胶性能较差。随着质量浓度增大溶液中的羧基相应增多,从而增加三维晶型网状结点数,增强氢键与疏水作用力,造成结构越致密及截留在网络结构中水分子越多,故凝胶强度增大,持水性増强[25]。此外,试验过程中发现当果胶质量浓度大于24 g/L后,凝胶变硬并出现轻微龟裂。
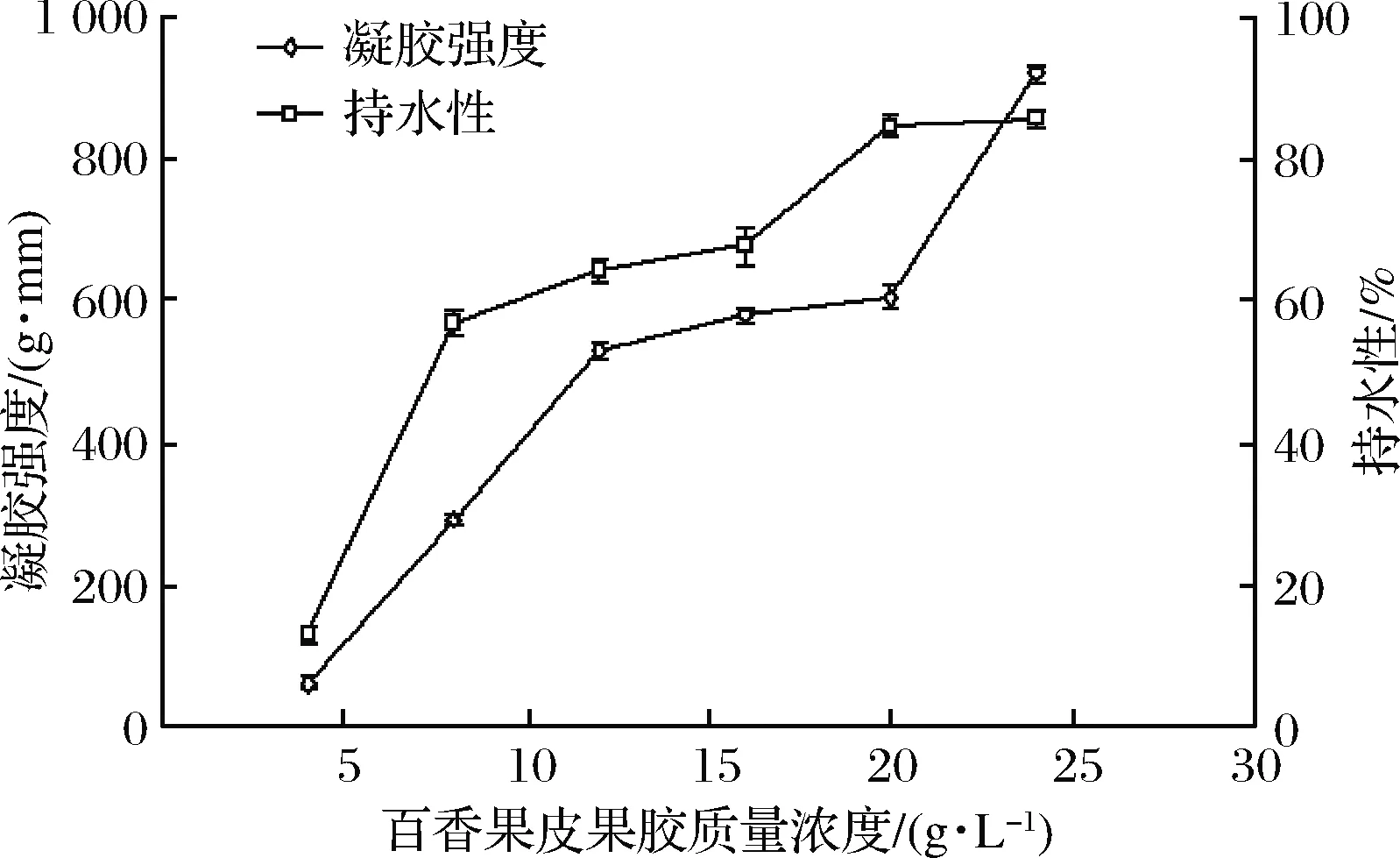
图2 百香果皮果胶质量浓度对凝胶特性的影响
Fig.2 Influence of passion peel pectin concentration on gel properties
2.5.2 蔗糖质量浓度对百香果皮果胶凝胶特性的影响
如图3所示,当蔗糖质量浓度小于600 g/L时,百香果皮果胶的凝胶强度和持水性都随蔗糖的添加以较大幅度上升,当蔗糖质量浓度达到600 g/L时,百香果皮果胶的凝胶强度和持水性分别达到了838 g·mm和77.7%,是200 g/L时的5.5倍和3.9倍。这可能在蔗糖添加量小于600 g/L时,随着质量浓度增大,蔗糖的醇羟基通过氢键和果胶分子链竞争结合水,使果胶分子之间彼此靠近聚集成长链胶束,形成三维结合区,故百香果皮果胶的凝胶强度和持水性增强。当蔗糖添加量大于600 g/L后,强度迅速降低至436 g·mm,其原因可能是因为蔗糖过量会增强蔗糖分子上的醇羟基通过氢键与果胶半乳糖醛酸残基的甲氧基及未解离羧基作用,从而改变果胶分子的立体空间结构,最终导致凝胶变软。同时由于蔗糖有亲水作用会进一步争夺果胶分子间的水分,且在离心力的作用下失去部分水分[26]。

图3 蔗糖质量浓度对凝胶特性的影响
Fig.3 Influence of sucrose concentration on gel properties
2.5.3 温度对百香果皮果胶凝胶特性的影响
由图4可以看出在温度小于70 ℃时随着温度的升高,百香果皮果胶的凝胶性能逐渐上升,分析可能是温度升高果胶分子在溶剂中热运动加剧,扩散速度加快,加速凝胶形成。70 ℃时百香果皮果胶的持水性和凝胶强度均达到最大,即为79.4%和852 g·mm。随后降至41.6%和237 g·mm,其原因可能是在较高温度下,果胶会发生β-脱酯作用,导致凝胶性能降低[5,27]。

图4 温度对果胶凝胶特性的影响
Fig.4 Influence of temperature on pectin gel properties
2.5.4 pH对百香果皮果胶凝胶特性的影响
由图5可以看出,在pH低于2.0时,凝胶性能弱,可能是由于在强酸条件下,百香果皮果胶中酯键和蔗糖中糖苷键发生水解造成。当pH达到3.2时,百香果皮果胶的凝胶强度和持水性达到最大,分别是pH为2.0时的9倍和5倍,可能是由于pH在靠近等电点时可有效抑制体系中带电荷的半乳糖醛酸羧基的电离,分子间静电排斥力变小,使果胶分子相互缠绕形成一个稳定的三维晶型网络结构并截留部分水所造成。当pH大于3.2后,可能是由于此时H+质量浓度下降,导致氢键减少,与游离羧基结合下降,羧基过多使分子间排斥力增大,从而造成凝胶性能下降[25,27]。
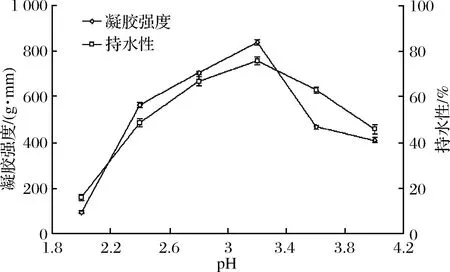
图5 pH对果胶凝胶特性的影响
Fig.5 Influence of pH on pectin gel properties
2.5.5 金属离子对百香果皮果胶凝胶特性的影响
金属离子对百香果皮果胶的凝胶强度和持水性造成的影响如图6所示。由图6可以看出,添加Fe3+和Al3+对两者所造成的影响差异不显著,当添加Mg2+时,与空白组相比减弱了百香果皮果胶的凝胶性能。添加Ca2+时,百香果皮果胶的凝胶强度和持水性分别为768 g·mm和63.7%,是空白组(未添加金属离子)的2.3倍和1.3倍。Cu2+的添加同样对凝胶强度有显著提高为空白组时的2.1倍,持水性为空白组时的1.4倍。其原因可能是果胶凝胶的形成对金属离子类型存在一定的选择性,Ca2+和Cu2+与游离羧基螯合更充分,减少了果胶分子周围的负电荷,改变果胶分子的聚集状态,从而使百香果皮果胶的凝胶特性变好。而Mg2+可能是因为其离子半径过小,不能与果胶形成稳定的桥梁,故减弱了果胶凝胶特性[28]。

图6 金属离子对果胶凝胶特性的影响
Fig.6 Influence of metalions on pectin gel properties
3 结论
果胶特性是评价果胶用途的一个重要指标,而酯化程度决定其凝胶强度,高酯果胶和低酯果胶因酯化度不同造成凝胶形成机制完全不同。高酯果胶的凝胶过程也叫氢键凝胶形成,主要通过甲酯基团和氢键之间的疏水键相互作用,其凝胶条件为高糖低酸即蔗糖质量浓度为(580~750) g/L和pH值为2.8~3.5,冷却后形成非可逆性凝胶[29]。本实验对百香果皮果胶的干燥失重、灰分含量、酸不溶性灰分等理化指标进行测定,并结合傅里叶红外光谱、质构特性和凝胶特性进行直观说明。主要结论如下:
(1)百香果皮果胶各项理化指标:干燥失重(9.62±0.39)%、灰分含量(4.17±0.72)%、酸不溶性灰分(0.97±0.05)%、溶解度(85.95±0.70)%、半乳糖醛酸含量(81.99±1.54)%、酯化度(66.46±0.41)%,均符合国家标准要求。与商品柑橘果胶相比,颜色较深,呈黄褐色。
(2)百香果皮果胶的傅里叶红外光谱:表明具有糖类的特征吸收峰,即果胶吸收峰,也证实其为高酯果胶。
(3)百香果皮果胶的质构特性:添加百香果皮果胶后胶着性有所下降,硬度、弹性和咀嚼性均有明显的提高。
(4)百香果皮果胶的凝胶特性:与百香果皮果胶质量浓度成正相关,随温度升高,蔗糖质量浓度和pH值的增大其凝胶强度和持水性均呈现先增大后减小的趋势,当果胶质量浓度为24 g/L、蔗糖添加量为60%、温度70 ℃、pH 3.2时,果胶的凝胶性能最佳。在凝胶过程中添加二价Ca2+、Cu2+可提高百香果皮果胶的凝胶特性。
本文对百香果皮果胶的相关理化和凝胶特性进行了一定程度的研究,但由于本研究所用果胶为粗品,可能会对果胶的质量和理化性质等造成一定程度影响,后续可进一步对果胶进行纯化并采用高效液相色谱、流变仪、扫描电镜和低场核磁等仪器测定和观察其分子量、单糖组成、流变模型及内部微观结构,为凝胶特性的机理提供理论依据。

