中华蜜蜂气味受体AcerOR57的表达及定位分析
冯宇佳,杜亚丽,赵慧婷,马卫华,李新宇,龙登隆,王春梅,姜玉锁*
(1. 山西农业大学动物科技学院,山西太谷 030801;2. 山西省农业科学院园艺研究所,太原 030031;3. 山西农业大学生命科学学院,山西太谷 030801)
嗅觉在昆虫和环境之间起到关键的连接作用,因为昆虫可以利用嗅觉来检测刺激物,为其提供有关食物、捕食者和潜在配偶的信息(Bruceetal., 2005; Songetal., 2008)。研究在不同物种中编码气味受体蛋白的基因不仅可以了解这些生物之间的进化关系,还可以认识到有机体与生态环境之间的交互作用(Wuetal., 2017)。气味受体作为直接参与嗅觉识别系统的蛋白之一,有着不可替代的作用。自然界中大量的气味因子通过昆虫嗅觉感觉表皮到达感器淋巴液中,与气味结合蛋白或化学感受蛋白结合构成复合体形式,复合体与嗅觉神经元树突膜上的气味受体结合,使树突膜改变了通透性,开启了信号转导过程(Rützler and Zwiebel, 2005)。对中华蜜蜂气味受体基因的研究,可以为深入了解其嗅觉机制奠定一定基础,以便更好地对其进行保护和利用。
昆虫的气味受体可根据功能分为两大类,一种是气味共受体(odorant receptor coreceptor, Orco),其在物种间高度保守,且无感知气味的功能,但可与传统的气味受体结合共同表达;另一种则是传统的气味受体(odorant receptors, Ors),这种受体在昆虫之间各不相同,可以辩别环境中丰富的气味分子和信息素(Mombaerts, 1999; Kriegeretal., 2004)。典型的气味受体有7个跨膜结构,具有与脊椎动物截然相反的拓扑结构。细胞膜内侧连接其N端,细胞膜的外侧连接C端(Bentonetal., 2006; Lundinetal., 2007),这与哺乳动物作用机制完全相反,因此昆虫的嗅觉识别机制非常特别,是通过离子门控方式来传递嗅觉信号(Satoetal., 2008; Wicheretal., 2008),这使得昆虫的嗅觉识别机制成为了研究热点。近年来,基于基因组学、转录组学的飞速进步,研究人员利用分子生物技术手段,相继发现了不同昆虫的ORs,如:在鳞翅目昆虫尧仁扇舟蛾ClosterarestituraWalker(Guetal., 2019)和家蚕BombyxmoriLinnaeus(Wanneretal., 2007)中分别鉴定出78、48个ORs;在鞘翅目昆虫稻水象甲LissorhoptrusoryzophilusKuschel(Zhangetal., 2019)和茶角胸叶甲Basileptamelanopus(Zhouetal., 2019)中分别鉴定出41、63个ORs;在直翅目昆虫亚洲小车蝗Oedaleusdecorusasiaticus(Zhouetal., 2019)鉴定出60个ORs;在半翅目昆虫中国梨喀木虱Cacopsyllachinensis(Xuetal., 2019)中鉴定出7个ORs;在双翅目昆虫冈比亚按蚊Anophelesgambiae(Foxetal., 2001)、埃及伊蚊Aedesaegypti(Bohbotetal., 2007)、黑腹果蝇Drosophilamelanogaster(Robertsonetal., 2003)中分别鉴别出79、131、62个ORs;在膜翅目昆虫西方蜜蜂ApismelliferaLinnaeus中鉴别出170左右个ORs(Robertsonetal., 2006),在中华蜜蜂Apisceranacerana足部(Duetal., 2019)鉴定出95个ORs。迄今为止,关于昆虫气味受体的各个方面都进行了大量研究,如:结构特征(Bentonetal., 2006; Wistrandetal., 2006)、异源表达(Radhikaetal., 2007; Songetal., 2009; Leeetal., 2016; Lietal., 2019)、组织特异性表达(Xuetal., 2013; Duetal., 2017; Liuetal., 2019; Tangetal., 2019)、功能(Marshalletal., 2010; Nicholsetal., 2016; Hughesetal., 2017; Guoetal., 2018; Katherineetal., 2019; Sunetal., 2019)和定位(Dwyeretal., 1998; Liuetal., 2013; Michael and Richard, 2013; Zhaoetal., 2015; Dietal., 2017)等。还有利用Orco与传统ORs结合传递气味分子的特点,研制出大量优质的Orco拮抗剂(Chen and Charles, 2012, 2013, 2014; Patricketal., 2012; Panagiotaetal., 2015),通过变构机制来抑制ORs的气味激活,从而设计开发出以空气为传播途径的优质驱虫剂。
目前对于中华蜜蜂气味受体的研究大多还停留在mRNA水平上(Yingetal., 2018; Duetal., 2019; Chenetal., 2019),蛋白水平的研究也主要集中在共表达受体Orco(Zhaoetal., 2015; Zhangetal., 2016),对于传统气味受体的表达及定位分析的研究还较少。本研究选择中华蜜蜂气味受体OR57为研究对象,在前期克隆获得中华蜜蜂OR57全长的基础上,利用quantitative real-time PCR、Western blot以及免疫组织化学技术对其在1日龄工蜂和采集蜂,1日龄雄蜂和性成熟雄蜂各部位中的表达差异及蛋白定位进行了比较分析,以期为该基因的功能研究提供理论依据。
1 材料与方法
1.1 试验蜜蜂
试验所用中华蜜蜂由山西农业大学动物科技学院实验蜂场提供。选取健康无病、群势强壮、无自然分蜂倾向的中华蜜蜂蜂群,从蜂巢中抽取一张成熟的封盖子脾(新蜂将要出房)置于34℃人工培养箱中培养(RH 70%),待其羽化出房后采集1日龄样本;于上午10 ∶00点左右(蜜蜂采集高峰期)在巢门前抓取携粉归来的工蜂(采集蜂);于下午14 ∶00~16 ∶00在巢门口抓取回巢的性成熟雄蜂。每个样本各采集300头,各自随机分为3组,根据触角、头(去除触角)、胸(去除足与翅膀)、腹、足等5个部位进行分离。在各个样本中,每100头蜜蜂各部位的混合样作为一个生物学重复。将所采集的部位立即投入到含有液氮的研钵中研磨至粉末状,倒入装有Trizol的 1.5 mL EP管中,放入超低温冰箱(-80℃)中保存备用。
1.2 主要试剂
所用主要试剂为:Trizol、反转录试剂盒PrimeScriptTMRT Reagent Kit with gDNA Eraser(perfect real time)、荧光定量试剂盒SYBR®Premix Ex TaqTMII(TliRNaseH Plus)等购自TaKaRa宝生物工程(大连)有限公司;SDS、无水乙醇、Tween-20、Tris-base、TEMED等常规分析纯购自北京索莱宝科技有限公司;SDS-PAGE凝胶制备试剂盒、微管蛋白β-tubulin、增强型RIPA裂解液、蛋白酶抑制剂PMSF、0.22 μm NC膜、脱脂蛋白冻干粉、过硫酸铵等购自Bioss;SABC免疫组化染色试剂盒、DAB显色试剂盒购自博士德;免疫组化笔、冰冻切片包埋剂购自康为世纪。
1.3 总RNA的提取及cDNA第一链的合成
按照RNA提取步骤进行各部位总RNA的提取,利用ND-1000核酸蛋白浓度测定仪测定其纯度和浓度后,根据反转录试剂盒合成cDNA第一链,反应所需RNA总量为1 000 ng。将所获cDNA模板放置于-20℃冰箱保存备用。
1.4 荧光定量PCR
根据本课题组前期实验得到的中华蜜蜂OR57 cDNA的开放阅读框设计特异性引物(F:5′-3AC CGCCATATGCAGGATAAA;R:5′-3′GGCCGAAA TTTGACCATCTA),内参使用Arp1(F:5′-3′AC TACGGCCGAACGTGAAAT;R:5′-3′GGAAAAG AGCCTCGGGACAA),对该基因在中华蜜蜂1日龄工蜂和雄蜂,采集蜂和性成熟雄蜂5个部位中mRNA的表达水平进行RT-qPCR分析。
反应体系为10 μL,其中SYBR Premix Ex TaqTM II(2x)加5 μL,ROX Refence Dye Ⅱ(50×)加0.2 μL,上、下游引物(10 μmol/L)各加0.4 μL,ddH2O加3 μL,cDNA模板加1 μL。反应条件为:95℃预变性30 s,循环条件为95℃ 5 s,62℃ 30 s,40个循环。每个样本都进行3次技术重复。以各样品所对应的Arp1的Ct值为阳性对照,从而得到AcerOR57基因在不同样本各部位的表达谱。
1.5 多克隆抗体的制备
以中华蜜蜂OR57蛋白全序列为模板,筛选并设计出两条最佳肽段进行合成并偶联(抗原一:PINEPRNPNYEKDIAY;抗原二:ELMLKYGIIG RNLT),使用HPLC和MS方法进行检测。检测成功后,每条多肽免疫2只健康的新西兰大白兔,至血清效价高于1 ∶10 000。检验标准:抗原包被量2~5 μg/mL,ELISA检测抗血清效价>1 ∶10 000。最后采用抗原亲和纯化的方法进行抗体纯化。检验标准同上,ELISA检测抗血清效价>1 ∶50 000。并委托生工生物工程(上海)股份有限公司完成。
1.6 总蛋白的提取及Western blot检测
按照组织裂解液试剂盒说明书,提取不同样本各部位的总蛋白。用微量核酸蛋白浓度测定仪测定总蛋白浓度,加入10% SDS溶液调整至浓度基本一致(25~30 mg/mL)。
将不多于20 μL的各部位总蛋白加样至10% SDS-聚丙烯酰胺凝胶电泳中进行检测。首先恒压80 V电泳30 min至溴酚蓝层到达分离胶后,之后将电压调至120 V,直到溴酚蓝到达分离胶底端;电泳结束后,进行转膜,电压调至100 V电泳100 min;将NC膜放于5%的脱脂奶粉中封闭1 h;封闭完成后用缓冲液TBS洗膜3次,TBST清洗1次,每次10 min;将清洗干净的NC膜上加入多克隆一抗,4℃摇床孵育过夜;回收一抗,TBST洗膜3次,TBS清洗1次,每次10 min,加入山羊抗兔近红外荧光二抗IRDye® 800CW,避光室温孵育1 h;充分洗膜后,用Odyssey® CLx近红外双色荧光成像系统进行结果检测。
1.7 冷冻切片与免疫组织化学定位检测
采集不同样本,取活蜜蜂的触角,放在冰冻切片机中进行切片,厚度约为5 μm。将切好的片在4%多聚甲醛溶液中进行固定,30 min后,蒸馏水清洗2~3次;之后,放于30% H2O2与甲醇(1 ∶50)的混合液中,27~28℃下浸泡30 min,用以灭活切片组织中的内源性过氧化物酶,蒸馏水清洗2~3次;将切片放于柠檬酸盐缓冲溶液中,高温煮沸,间隔10 min后,重复一次;冷却后用免疫组化专用PBS清洗1~2次;在粘附有触角的位置滴加2~3滴5% BSA封闭液,浸没全部组织,27~28℃封闭1 h;甩去多余的封闭液,滴加提前配置好的一抗,4℃孵育12 h以上,同时设置阴性对照组(用PBS溶液代替一抗);PBS洗3次,滴加生物素化山羊抗兔IgG,37℃孵育20 min;PBS洗3次,滴加试剂SABC,37℃孵育20 min;PBS洗4次。使用DAB显色剂(蓝紫色)进行显色,蒸馏水冲洗干净后封片(中性树脂)。光学显微镜下观察结果,用Image-Pro Plus 7.0软件分析并拍照。
1.8 数据分析
荧光定量PCR结果应用7500 Real-time PCR System软件进行数据分析与处理。根据所得标准曲线和荧光曲线的Ct值,采用2-△△Ct法进行数据分析。运用SPSS 22.0 软件中进行单因素方差分析(ANOVA),结合Duncan’s法完成显著性差异分析。所得结果利用GraphPad Prism 6.0软件进行作图。
Western blot结果应用Image Studio Ver 5.2软件进行分析处理。利用该软件测定内参和目的蛋白的灰度值,使用目的灰度/内参灰度的计算方式进行半定量分析。利用SPSS 22.0软件进行方差分析及差异显著性检验,并于GraphPad Prism 6.0软件中作图。
2 结果与分析
2.1 AcerOR57 mRNA在中华蜜蜂不同部位的表达谱分析
AcerOR57的转录本在1日龄工蜂和采集蜂,1日龄雄蜂和性成熟雄蜂各部位中均有表达。在1日龄工蜂和采集蜂中,触角的表达量均高于其它部位,差异极显著(P<0.01)。其它部位中,在1日龄工蜂的胸部表达量相对较高,头部和足次之,但3个部位差异不显著,腹部表达量最低,呈微量表达;在采集蜂其它部位中,头部表达量相对较高,胸部和足次之,腹部同样呈微量表达(图1)。
在1日龄雄蜂和性成熟雄蜂中,头部中的表达量均高于其它部位,差异极显著(P<0.01)。在其它部位中,1日龄雄蜂胸部表达量相对较高,触角次之,足中表达量最低;在性成熟雄蜂中,触角的相对表达量较胸部略高,腹部次之,足中表达量最低。
2.2 多克隆抗体检测
以中华蜜蜂采集蜂胸部为样本,对AcerOR57多克隆抗体的质量进行检测,其阳性结果(B)在目的蛋白分子量(46.5 kDa)处,条带清晰,且无杂带,阴性结果(A)的相应位置无明显条带,表明该抗体确为目的蛋白抗体,且特异性良好(图1)。
2.3 总蛋白提取效果检测
性成熟雄蜂各部位蛋白的SDS-聚丙烯酰胺凝胶电泳结果(R250考马斯亮蓝染色)如图2。由图可见,各部位蛋白条带清晰,无拖尾,各个泳道之间没有交叉,表明蛋白提取效果良好,可用于后续实验。
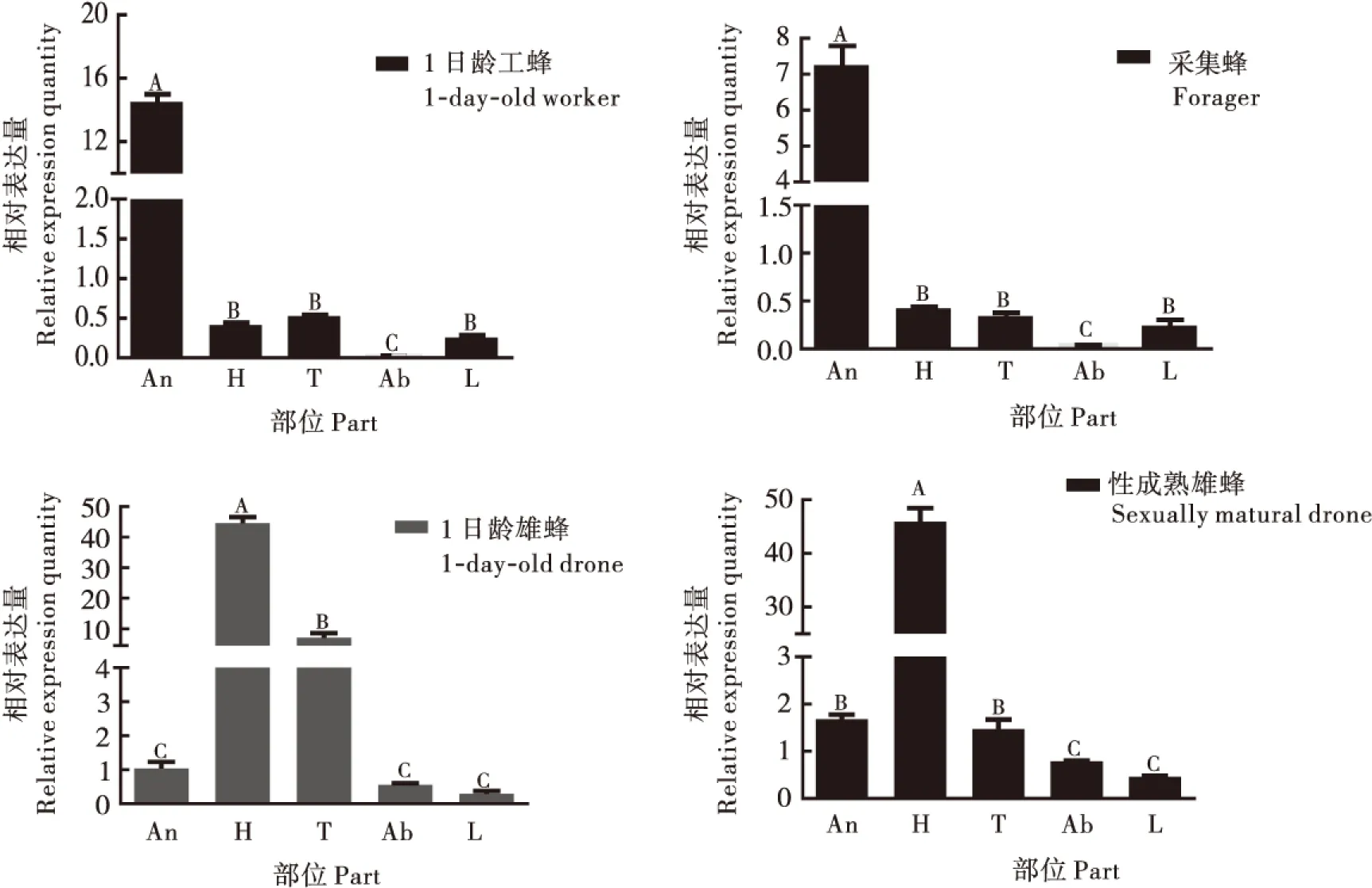
图1 中华蜜蜂AcerOR57在1日龄工蜂和采集蜂、1日龄雄蜂、性成熟雄蜂不同部位中的相对表达量Fig.1 Relative expression level of AcerOR57 mRNA in different parts of 1-day-old workers,forager,1-day-old and sexually mature drones of Apis cerana cerana注:An, 触角; H, 头(去除触角); T, 胸Thorax; Ab, 腹; L, 足。柱状图上不同大写字母表示差异极显著(P<0.01)。Notes: An, Antenna; H, Head without antenna; T, Thorax; Ab, Abdomen; L, Legs.Different capital letters above the bars indicate significant different(P<0.01).
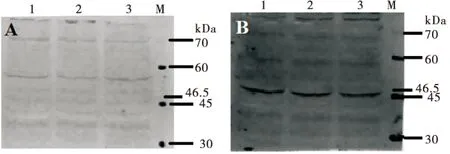
图2 中华蜜蜂AcerOR57多克隆抗体检测阴性(A)和阳性(B)结果Fig.2 Negative (A) and positive (B) serum results of AcerOR57 polyclonal antibody test in Apis cerana cerana注: 1、2、3, 采集蜂胸部样本的3个重复; M, 蛋白分子量标准。Notes: 1、2、3, Three repetitions of foragers about thorax; M, Molecular weight maekers of standard protein.

图3 性成熟雄蜂各部位蛋白提取结果的SDS-聚丙烯酰胺凝胶电泳结果Fig.3 SDS-polyacrylamide gel electrophoresis about protein samplesin different parts of sexually mature drones注: 1, 触角; 2, 头(去除触角); 3, 胸; 4, 腹; 5, 足; M, 蛋白分子量标准。Notes: 1, Antenna; 2, Head (without antenna); 3, Thorax; 4, Abdomen; 5, Legs; M, Molecular weight maekers of standard protein.
2.4 AcerOR57受体蛋白在中华蜜蜂各部位的表达分析
AcerOR57在1日龄工蜂和采集蜂,1日龄雄蜂和性成熟雄蜂各部位中蛋白表达结果如图4、图5所示,该蛋白在1日龄工蜂和采集蜂,1日龄雄蜂和性成熟雄蜂的触角、头、胸、腹和足各个部位中均有表达。
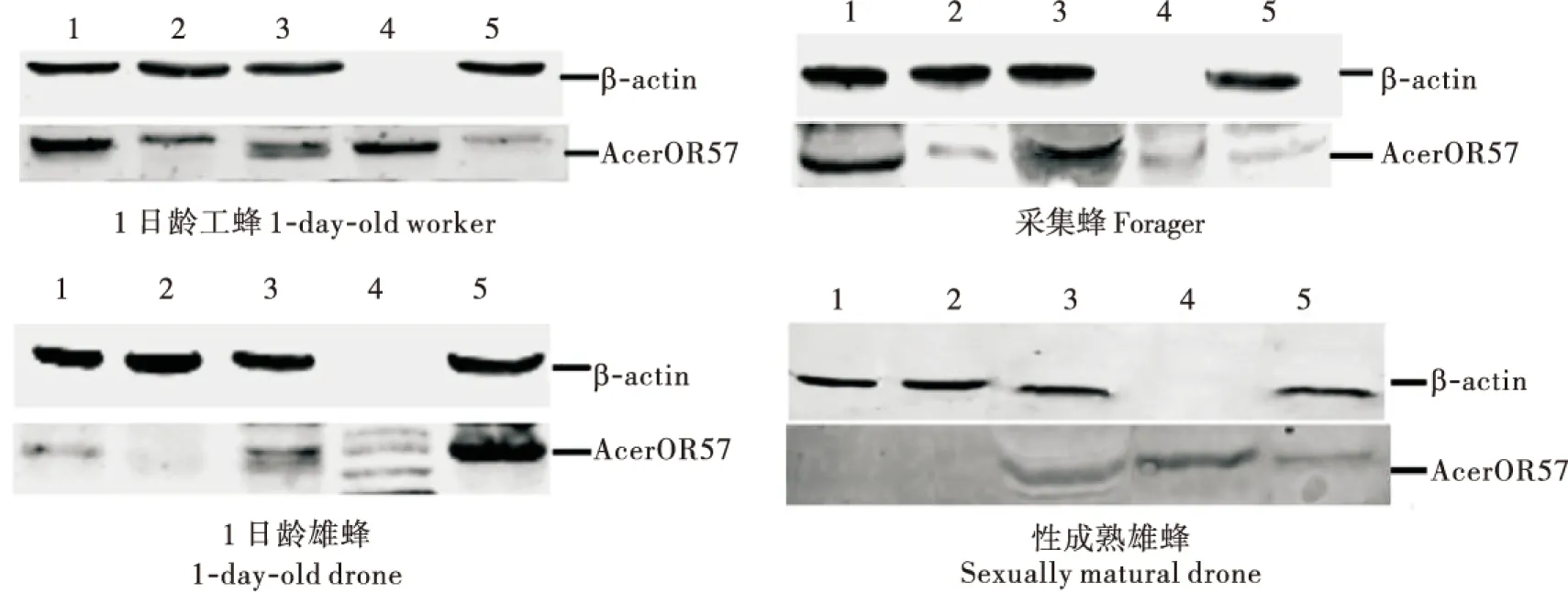
图4 中华蜜蜂AcerOR57在中华蜜蜂不同部位中的表达量Fig.4 Expression of AcerOR57 protein in different parts of of Apis cerana cerana注: 1, 触角; 2, 头(去除触角); 3, 胸; 4, 腹; 5, 足。Notes:1, Antenna; 2, Head ( without antenna); 3, Thorax; 4, Abdomen; 5, Legs.

图5 中华蜜蜂AcerOR57在1日龄工蜂、采集蜂、1日龄雄蜂和性成熟雄蜂不同部位中蛋白的相对表达量Fig.5 Relative expression level of AcerOR57 protein in different parts of 1-day-old worker,forager, 1-day-old and sexually mature drone of Apis cerana cerana注: An, 触角; H, 头(去除触角); T, 胸; Ab, 腹; L, 足。柱状图上不同大写字母表示差极异显著(P<0.01)。Notes: An, Antenna; H, Head without antenna; T, Thorax; Ab, Abdomen; L, Legs. Different capital letters above the bars indicate significant different(P<0.01).
根据Western blot结果,由于腹部内参不表达,导致图5中腹部结果无法显示,因此,结果分析只在除腹部以外的其它部位中进行。1日龄工蜂和采集蜂中,触角的表达量最高,与其它部位差异极显著(P<0.01);在1日龄雄蜂和性成熟雄蜂中,触角和头部的表达都极低;在雄蜂的其它部位中,1日龄足部及性成熟雄蜂胸部的表达量均高于其它部位,差异极显著(P<0.01)。
2.5 AcerOR57受体蛋白在中华蜜蜂触角中的定位分析
本试验使用前期制备的AcerOR57抗体,对各样本触角切片进行免疫组化反应,采用DAB(蓝紫色)染色,阳性结果出现蓝紫色点状或圆盘状,背景为淡紫色。阴性结果的背景则是无色或淡紫色,没有明显的结果,说明试验结果特异性良好。
免疫组化结果显示,AcerOR57在中华蜜蜂触角的鞭节中均有表达。AcerOR57在1日龄工蜂和雄蜂及性成熟雄蜂触角中的表达结果为:点状(图6中蓝色箭头所指)、圆盘状(图6中黄色箭头所指)以及长条状(图6中黑色箭头所指),采集蜂中只呈现点状和圆盘状表达结果,推测AcerOR57在触角的板形感器、毛形感器和锥形感器中有表达。
在1日龄工蜂和性成熟雄蜂中,点状表达结果所占的比例比圆盘状多;在1日龄雄蜂和采集蜂中,板形感器的表达相对较多,毛形感器较少。在所有样本中,长条状结果最为不明显,只有零星几处。总的来说,在1日龄工蜂和性成熟雄蜂中,AcerOR57主要在毛形感器中表达,在1日龄雄蜂和采集蜂中,主要在板形感器中表达。雄蜂中感器的分布明显少于工蜂。
3 讨论与结论
蜜蜂是一种高度社会性生活的昆虫,通过个体间合作,形成了有着完备通讯和社会分工合作的系统,以适应千变万化的自然环境。有大量数据表明,昆虫气味受体基因一般位于触角中,但在下颚须以及喙中也存在大量的嗅觉感受器(Olafsonetal., 2013; Kongetal., 2014)。扫描电镜结果显示,中华蜜蜂工蜂触角鞭节上存在7种感受器,而在雄蜂中发现6种(Zhaoetal., 2019)。其中,板形感器、锥形感器、毛形感器和栓锥形感器与蜜蜂的嗅觉感受相关(Fengetal., 1992; JINetal., 2004; Faucheuxetal., 2006; Ahmedetal., 2013)。本研究对中华蜜蜂1日龄工蜂和采集蜂,1日龄雄蜂和性成熟雄蜂的触角、头、胸、腹、足5个部位中OR57转录本的表达谱所做的分析表明,该基因主要在1日龄工蜂和采集蜂触角中高表达,这与潘建芳(Pan, 2016)的研究结果相一致。该基因还在1日龄雄蜂和性成熟雄蜂头部中高表达,推测可能是喙和下颚须包含于其中的原因,Wanner等发现在雄蜂触角中高度表达的气味受体为性信息素受体的可能性很高(Wanneretal., 2007),故推测AcerOR57可能在雄蜂摄取食物的过程中起作用,且其并非性信息素受体。
目前很少有研究报道关于昆虫传统气味受体蛋白表达特性。本研究利用Western blot技术对AcerOR57蛋白在不同样本各部位的表达特性进行研究。结果显示,AcerOR57在1日龄工蜂和采集蜂触角中表达最多,这与前期RT-qPCR的试验结果相吻合,这也从蛋白水平验证了OR57在工蜂中的表达特性。而在1日龄雄蜂和性成熟雄蜂中,AcerOR57的蛋白表达量与前期荧光定量的结果大不相同,这可能是由于AcerOR57在表达过程中,发生了转录后调控。蜜蜂是一种高度社会性生活的昆虫,在蜂群这样的“超生物体”中,尽管单个蜜蜂难以独立生存,但通过个体合作,蜂群形成了具有高度发达的通讯和社会分工合作系统,能适应多变的环境条件。在一个蜂群里,工蜂的数量最多,担任了除产卵以外的所有工作,1日龄工蜂主要在巢内进行保温孵卵、清理巢房的工作;而采集蜂作为壮年个体,主要在巢外进行采集花蜜、水、花粉、蜂胶及巢门防卫的工作(Beshers SNetal., 2001),因此,有更多机会接触不同种类的气味分子。雄蜂的唯一任务就是保证与处女王的交配,在交配季节,性成熟的雄蜂会自动聚集在某空域中,招引处女王(Rangeletal., 2013)。采集蜂需要外出采集外界的蜜粉源,AcerOR57在采集蜂触角中高表达,而在雄蜂中表达低或不表达,从另一个角度说明该气味受体并非性信息素受体。
本研究前期曾使用了α-actin、β-actin、α-tublin、β-tublin、GAPDH 5种内参蛋白抗体来检测中华蜜蜂腹部内参表达情况,但均未出现蛋白条带。根据β-actin序列设计引物,进行荧光定量PCR检测发现,其在蜜蜂不同部位(触角、头、胸部、腹部、足)均可检测出表达结果。故笔者推测,可能是由于腹部除消化系统外,只有少量肌肉来辅助运动,不利于蛋白内参的检测,所以Western blot内参结果未出,但不影响目的蛋白检测,具体原因还需进一步的探究。
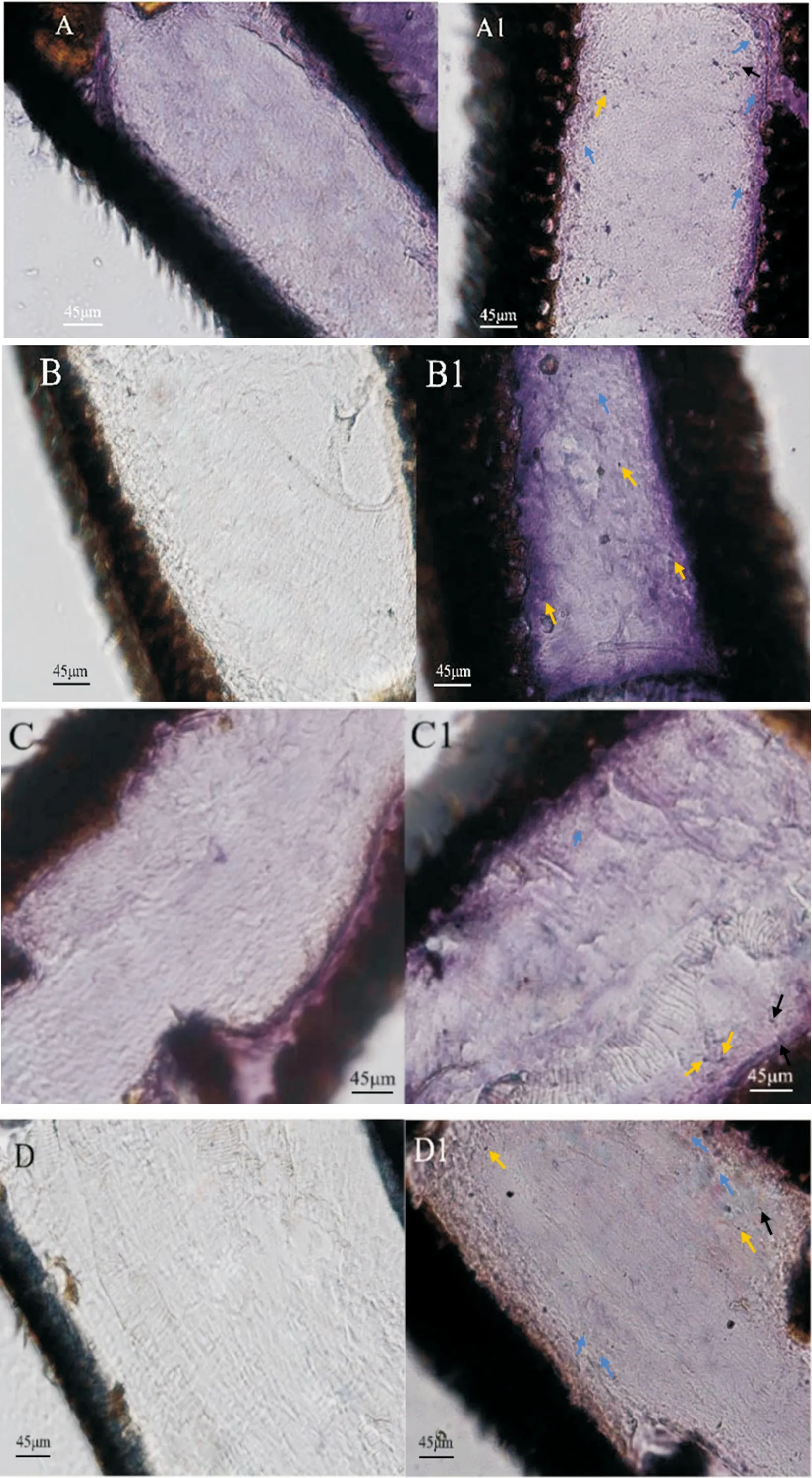
图6 中华蜜蜂AcerOR57在1日龄工蜂、采集蜂、1日龄雄蜂和性成熟雄蜂触角上的定位Fig.6 Localization of AcerOR57 in antennae of 1-day-old workers and forager, 1-day-old and sexually mature drones of Apis cerana cerana注: A, AcerOR57在1日龄工蜂触角中的阴性表达结果; A1, AcerOR57在1日龄工蜂触角中的阳性表达结果; B, AcerOR57在采集蜂触角中的阴性表达结果; B1, AcerOR57在采集蜂触角中的阳性表达结果; C, AcerOR57在1日龄雄蜂触角中的阴性表达结果; C1, AcerOR57在1日龄雄蜂触角中的阳性表达结果; D, AcerOR57在性成熟雄蜂触角中的阴性表达结果; D1, AcerOR57在性成熟雄蜂触角中的阳性表达结果。Notes: A, Negative expression result of AcerOR57 in the antenna of 1-day-old; A1, Positive expression result of AcerOR57 in the antenna of 1day workers ; B, Negative expression result of AcerOR57 in the antenna of forager; B1, Positive expression result of AcerOr57 in the antenna of forager; C, Negative expression result of AcerOR57 in the antenna of 1-day-old; C1, Positive expression result of AcerOR57 in the antenna of 1-day-old drones ; D, Negative expression result of AcerOR57 in the antenna of sexually mature drones; D1, Positive expression result of AcerOr57 in the antenna of sexually mature drones.
目前,关于蜜蜂气味受体基因的表达及定位研究,大多采用的是原位杂交的方法,包括You等将LmigOR3定位于毛状感器的神经元中(Youetal., 2016);Tim等证明了冈比亚按蚊中不同的气味受体会在相应的嗅觉神经元中表达(Timetal., 2015)。本课题组前期同样利用原位杂交技术对气味受体蛋白Orco在中华蜜蜂触角上的表达进行了定位分析(Zhaoetal., 2013; Zhaoetal., 2015)。本研究采用免疫组化技术对AcerOR57受体蛋白表达特性进行探究,发现其在中华蜜蜂触角鞭节中有点状、圆盘状及长条状表达,由于长条状结果均出现在工蜂和雄蜂中,故猜测其可能为锥形感器。与AcerOrco(Zhangetal., 2016)相比,AcerOR57的分布分散且少,这可能是由于AcerOrco作为共受体,在嗅觉感器中的分布比传统气味受体多的原因。同时,本研究结果还显示,AcerOR57在雄蜂中感器的分布明显少于工蜂,故推测该蛋白在识别外界普通气味分子中发挥重要作用。

