LC-MS/MS法测定肿瘤患者恶性腹水中紫杉醇的含量
黄翠云 张凤 柳珂 陈万生 杨军
摘 要 目的:建立测定肿瘤患者恶性腹水中紫杉醇含量的方法。方法:采用液相色谱-质谱联用(LC-MS/MS)技术,以文多灵为内标,测定肿瘤患者给予紫杉醇后恶性腹水中紫杉醇的含量,色谱柱为Zorbax SB-C18,流动相为水溶液(含0.1%甲酸和10 mmol/L醋酸铵)-乙腈溶液(40 ∶ 60,V/V),流速为0.25 mL/min,柱温为30 ℃,进样量为5 μL,离子源为电喷雾离子源,检测模式为多重反应离子监测正离子模式,干燥气温度为350 ℃,干燥气流速为10 L/min,毛细管电压为4 000 V,紫杉醇和内标在正离子模式下质荷比(m/z)分别为876.5→308.0、457.3→188.1,碎片电压分别为250、150 V,碰撞电压分别为30、20 eV。结果:紫杉醇检测质量浓度的线性范围为25~2 500 ng/mL(r2=0.996 5,n=7);定量下限为25 ng/mL;日内、日间精密度试验的RSD为0.61%~3.62%(n=5、3);准确度为95.34%~98.76%(n=5、3);提取回收率的RSD为3.19%~3.72%(n=3);基质效应的CV为1.52%~2.93%(n=3);稳定性试验的RE均小于3%(n=3)。结论:该方法简便、准确,可用于测定肿瘤患者恶性腹水中紫杉醇的含量。
关键词 液相色谱-质谱联用;肿瘤患者;腹水;紫杉醇;含量测定
中图分类号 R969 文献标志码 A 文章编号 1001-0408(2020)01-0086-05
DOI 10.6039/j.issn.1001-0408.2020.01.15
ABSTRACT OBJECTIVE: To establish a method for content determination of paclitaxel in malignant ascites of tumor patients. METHODS: LC-MS/MS method was adopted. Using vindoline as internal standard, the content of paclitaxel in ascites of tumor patients was determined. The separation was performed on Zorbax SB-C18 column with mobile phase consisted of aqueous solution (containing 0.1% formic acid and 10 mmol/L ammonium acetate)-acetonitrile (40 ∶ 60, V/V) at the flow rate of 0.25 mL/min. the column temperature was 30 ℃, and sample size was 5 μL. The ion source was electrospray ion source, and the detection mode was multiple ion monitoring positive ion mode. MS parameters were set as following as dry gas temperature 350 ℃,dry gas flow rate 10 L/min,capillary voltage 4 000 V. Quantitative determination was operated in the multiple reaction monitoring (MRM) mode,with the ion transitions m/z 876.5→308.0 for paclitaxel and m/z 457.3→188.1 for the internal standard. The fragment voltage/collision energy for paclitaxel and the internal standard were 250 V/30 eV, and 150 V/20 eV,respectively. RESULTS: The linear range of paclitaxel were 25-2 500 ng/mL (r2=0.996 5, n=7). The lowest limit of quantitation was 25 ng/mL. RSDs of inter-day and intra-day precision tests were 0.61%-3.62%(n=5, 3). Accuracies were 95.34%-98.76%(n=5, 3). RSDs of extraction recovery were 3.19%-3.72%(n=3). CV of matrix effect were 1.52%-2.93%(n=3). RE of stability tests were lower than 3% (n=3). CONCLUSIONS: The method is simple, accurate and suitable for the content determination of paclitaxel in malignant ascites of tumor patients.
KEYWORDS LC-MS/MS; Tumor patient; Malignant ascites; Paclitaxel; Content determination
惡性肿瘤已经成为全球较大的公共卫生问题之一[1]。恶性腹水是由于恶性肿瘤病变引起腹腔脏壁层腹膜发生弥漫性病变而导致腹腔内液体异常增多的现象,是恶性肿瘤晚期常见的并发症,在40%~60%的恶性腹水中能找到脱落的恶性肿瘤细胞[2]。紫杉醇是具有抗癌活性的二萜生物碱类化合物,在过去的几十年里,紫杉醇广泛用于卵巢癌、乳腺癌、肺癌等多种肿瘤的治疗,以紫杉醇为基础的联合治疗是上述恶性肿瘤晚期腹水的主要治疗方案[3-4]。已有研究表明,全身化疗联合腹腔灌注化疗方案对于全身多器官转移的晚期胃癌患者,尤其是腹膜转移胃癌患者,能够使抗癌药物在腹腔内维持较高的血药浓度,从而抑制肿瘤细胞生长[5]。但目前尚未有相关研究开展紫杉醇恶性腹水浓度与疗效之间的关系研究,而仅仅监测紫杉醇在血浆中的浓度不能准确反映其在恶性腹水中的浓度,因此,需建立稳定、可靠的检测方法,监测紫杉醇在恶性腹水中的药物浓度,为未来开展其浓度-疗效相关性研究提供检测技术。
目前已有多种分析方法对紫杉醇进行测定,例如反相高效液相色谱法(RP-HPLC)测定大鼠血浆中紫杉醇的浓度[6]、RP-HPLC法或液相色谱-质谱联用法(LC-MS/MS)测定制剂中紫杉醇的含量[7-8]。但关于恶性腹水中紫杉醇含量的检测方法目前研究较少。LC-MS/MS法是一种灵敏度高、特异性强的紫杉醇含量测定方法。因此,本课题组在前期研究[9]的基础上,采用LC-MS/MS法,以文多灵为内标,建立了测定肿瘤患者恶性腹水中紫杉醇含量的方法,以期为临床监测相关患者恶性腹水中紫杉醇的有效浓度提供检测技术。紫杉醇和文多灵化学结构图见图1。
1 材料
1.1 仪器
1200型HPLC-G6410A型三重四级杆MS/MS仪,包括G1311A型四元泵、G1322A型真空脱气机、G1329A型自动进样器、G1316A型柱温箱、MassHunter软件控制系统及数据处理工作站B.01.03(美国Agilent公司);BSA124S-CW型天平、CPA225D型天平(德国Sartorius公司);Mini spin型离心机(德国Eppendorf公司);Labnet VX-200型定时可调速涡旋混合器(美国Labnet公司);SK7200H型超声仪(上海科导超声仪器有限公司);UNIVERSAL32R型台式冷冻离心机(德国Hettich公司)。
1.2 药品与试剂
紫杉醇对照品(批号:M1201AS,纯度:98%)、文多灵对照品(批号:J1011AS,纯度:98%)均购自大连美仑生物技术有限公司;甲醇(批号:10951907818,质譜级)、乙腈(批号:JA075930,质谱级)均购自德国默克公司;甲酸(批号:17033D,分析纯)、乙酸铵(批号:H1709024,色谱纯)均购自阿拉丁试剂(上海)有限公司;水为屈臣氏纯净水。
1.3 样品
空白腹水及含药腹水均由上海长征医院肿瘤科提供,分别为2例肿瘤患者未给药和腹腔注射紫杉醇后6、8、12、24 h的腹水样品,给药剂量为20 mg/m2,所有患者都签署知情同意书。
2 方法与结果
2.1 溶液的制备
2.1.1 贮备液的制备 分别精密称取紫杉醇对照品2.01 mg、文多灵对照品2.00 mg,分别置于2 mL量瓶中,用甲醇溶解并稀释成质量浓度为1 mg/mL的紫杉醇贮备液和内标贮备液,摇匀即得,于-20 ℃冰箱保存,备用。
2.1.2 工作液的制备 精密量取紫杉醇贮备液适量,以10%甲醇溶液稀释,制备成质量浓度分别为0.25、0.625、1.25、2.5、6.25、12.5、25.0 μg/mL的标准工作液,以及质量浓度分别为0.625、2.5、12.5 μg/mL的质控工作液,现配现用。
2.1.3 标准曲线溶液与质控样品溶液的制备 取“2.1.2”项下制备的7个水平的标准工作液和3个水平的质控工作液,分别用生理盐水稀释10倍,即得紫杉醇质量浓度分别为25、62.5、125、250、625、1 250、2 500 ng/mL的标准曲线溶液和质量浓度分别为62.5、250、1 250 ng/mL的质控样品溶液。
2.2 腹水样品的处理
取腹水样品100 μL,加1 900 μL生理盐水稀释,涡旋30 s混匀;取稀释样品50 μL,置于1.5 mL的离心管中,加入含100 ng/mL内标的 0.1%甲酸甲醇溶液200 μL,涡旋混合3 min,19 751.6 ×g离心10 min,取上清液100 μL转移至自动进样小瓶,进样检测。
2.3 色谱条件与质谱条件
色谱柱:Zorbax SB-C18(100 mm×2.1 mm,3.5 μm);流动相:水溶液(含0.1%甲酸和10 mmol/L 醋酸铵)-乙腈溶液(40 ∶ 60,V/V);流速:0.25 mL/min;柱温:30 ℃;进样量:5 μL。
采用电喷雾离子源(ESI),多重反应离子监测(MRM)正离子模式,毛细管电压:4 000 V,干燥气温度:350 ℃,干燥气流速:10 L/min,碰撞气压力:40 psi,流速:10 L/min,紫杉醇和文多灵的定量分析质荷比(m/z)分别为876.5→308.0、457.3→188.1,碎片电压分别为250、150 V,碰撞电压分别为30、20 eV。
2.4 专属性考察
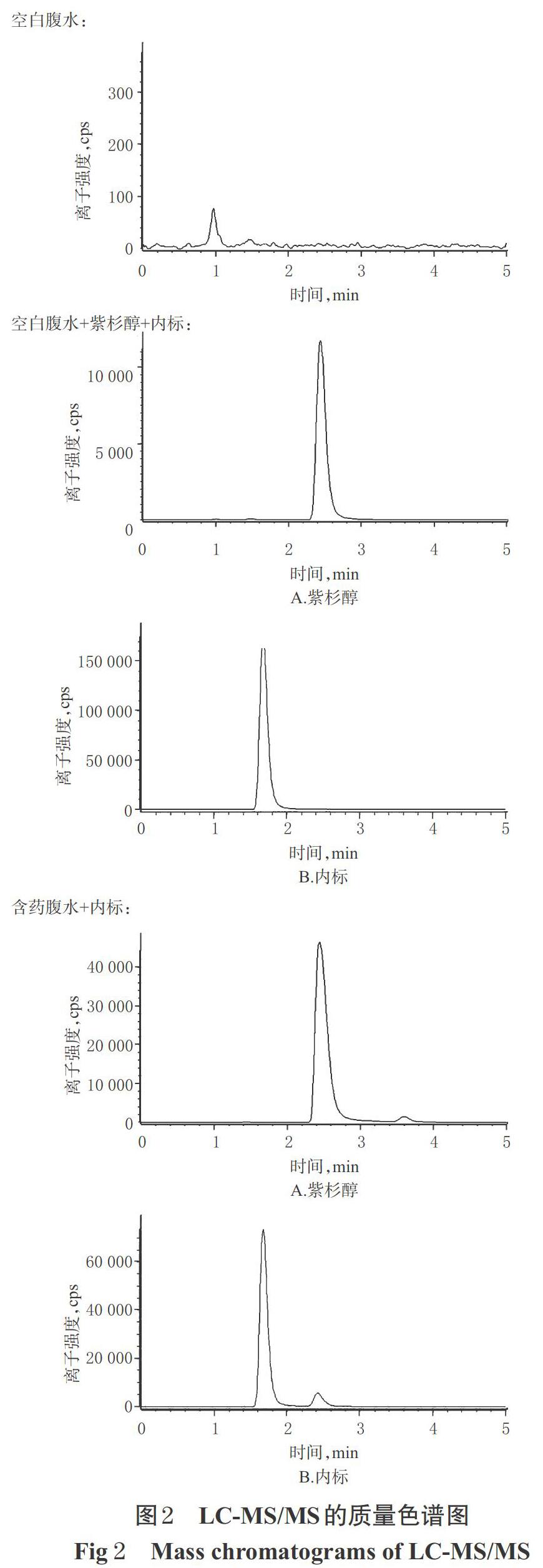
取空白腹水、空白腹水+紫杉醇对照品、含药腹水(给药后6 h),按“2.2”项下方法处理后,再按照“2.3”项下条件进样测定,记录图谱。结果显示,紫杉醇峰形良好,空白腹水中杂质不干扰紫杉醇和内标文多灵的检测,专属性符合相关要求。LC-MS/MS的总离子流图见图2。
2.5 标准曲线、线性范围和定量下限
取“2.1.3”项下质量浓度分别为25、62.5、125、250、625、1 250、2 500 ng/mL的标准曲线溶液,按“2.2”项下方法处理后,再按照“2.3”项下条件进样测定,每一个浓度平行做5个样品进行分析。以紫杉醇的质量浓度为横坐标(x),紫杉醇与内标的峰面积比值为纵坐标 (y),进行加权线性回归,权重系数为1/x2。得紫杉醇的回归方程为y=0.001 8x-0.001 0(r2=0.996 5,n=7),线性质量浓度范围为25~2 500 ng/mL,定量下限为25 ng/mL。
2.6 精密度与准确度试验
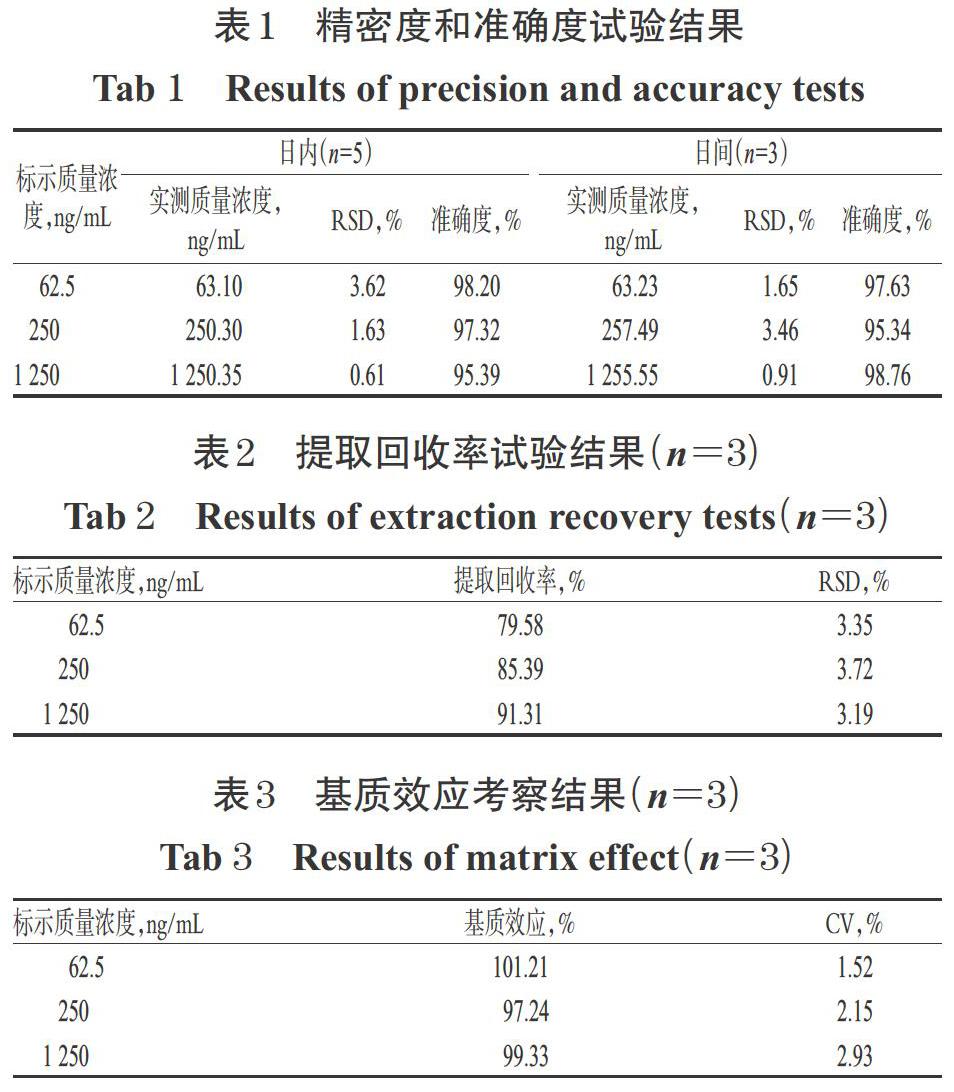
取“2.1.3”项下质量浓度分别为62.5、250、1 250 ng/mL的质控样品溶液,按“2.2”项下方法处理后,再按照“2.3”项下条件进样测定,每一个浓度平行做5个样品进行分析,连续测定3 d。根据当天的标准曲线计算质控样品溶液的实测质量浓度,考察日内、日间精密度的RSD,并以实测质量浓度/标示质量浓度×100%计算准确度。精密度与准确度试验结果见表1。
2.7 提取回收率试验
分别取“2.1.3”项下质量浓度为62.5、250、1 250 ng/mL的质控样品溶液,各3份,按“2.2”项下方法处理后,再按照“2.3”项下条件进样测定,记录峰面积A;另取空白腹水,按“2.2”项下方法处理后,加入紫杉醇对照品溶液,制备成上述相应质量浓度的样品溶液,再按照“2.3”项下条件进样测定,记录峰面积B,以A/B×100%计算提取回收率。提取回收率试验结果见表2。
2.8 基质效应考察
分别取“2.1.3”项下质量浓度分别为62.5、250、1 250 ng/mL的质控样品溶液,各3份,按“2.2”项下方法处理后,再按照“2.3”项下条件进样测定,记录峰面积A;另取“2.1.2”项下质量浓度分别为62.5、250、1 250 ng/mL的质控工作液,各3份,按照“2.3”项下条件进样测定,记录峰面积C,以A/C×100%计算基质效应。基质效应考察结果见表3。
2.9 稳定性试验
分别取“2.1.3”项下质量浓度分别为62.5、250、1 250 ng/mL的质控样品溶液,分别考察下列条件下的稳定性,每一个浓度平行做3个样品进行分析。考察条件:(1)室温条件下放置6 h,然后按“2.2”项下方法处理,再按照“2.3”项下条件进样测定;(2)自动进样室中放置24 h,再处理后进样测定;(3)-20 ℃下冷冻,室温融解,反复冻融3次,再处理后进样测定;(4)-20 ℃下放置30 d,再处理后进样测定。结果显示,所有质控样品均未出现降解、变质等变化,稳定性良好。稳定性试验结果见表4。
2.10 肿瘤患者恶性腹水中紫杉醇的含量测定
取2例肿瘤患者腹腔注射紫杉醇后0、6、8、12、24 h的腹水样品,紫杉醇的给药剂量为20 mg/m2,将腹水样品按“2.2”项下方法处理后,再按照“2.3”项下条件进样测定,代入回归方程计算恶性腹水中紫杉醇的含量。2例肿瘤患者恶性腹水中紫杉醇的药-时曲线图见图3。
3 讨论
3.1 LC-MS/MS条件的确定
笔者参考文献[10-12],在预实验中分别考察了色谱柱为Agilent ZORBAX SB C18(100 mm×2.1 mm,3.5 μm)、Agilent poroshell SB C18(75 mm×2.1 mm,2.7 μm)、Waters XBridge? BEH C18(50 mm×2.1mm,2.5 μm)时,对紫杉醇含量测定的影响,结果显示,当色谱柱为Agilent ZORBAX SB C18时,紫杉醇及内标的峰形最佳;流动相为乙腈/甲醇-甲酸水溶液、乙腈/甲醇-醋酸铵水溶液、乙腈/甲醇-甲酸与醋酸铵混合水溶液时,对紫杉醇含量测定的影响,结果显示,紫杉醇在水溶液(含0.1%甲酸和10 mmol/L醋酸铵)-乙腈溶液(40 ∶ 60,V/V)等度洗脱的条件下响应、峰形均较好;柱温为20、25、30 ℃时,对紫杉醇含量测定的影响,结果显示,柱温越高紫杉醇的出峰时间越早,且对峰形与峰面积无明显影响,故为了节省分析时间选择了柱温为30 ℃;流速为0.25、0.3 mL/min时,对紫杉醇含量测定的影响,结果显示,紫杉醇峰面积在0.3 mL/min流速下存在峰面积下降的情况,故选择了流速为0.25 mL/min。
3.2 样品的前处理
笔者在腹水处理过程中参考并借鉴了相关文献中紫杉醇在血浆样本中的处理方法[13-15],结果显示,相对于液-液萃取法,本实验采用的蛋白沉淀法更加简单快捷。其中,相比于乙腈,甲醇的沉淀效果更好,不易导致仪器系统压力过高,并且在甲醇中加入少许甲酸可获得较高的提取回收率,最终确定沉淀剂为含0.1%甲酸的甲醇溶液。依据相关文献[16-18],选择了多种沉淀剂比例V腹水 ∶ V沉淀剂(1 ∶ 2、1 ∶ 3、1 ∶ 4、1 ∶ 5、1 ∶ 6),结果发现,当二者比例超过1 ∶ 4后,提取回收率均无明显变化,故最终选择沉淀剂与含0.1%甲酸的甲醇体积比为1 ∶ 4的方案。
3.3 内标的选择
在内标选用时,笔者参考相关文献[19],选用了与紫杉醇物理化学性质相似的,且响应好、稳定的文多灵作为内标。
4 结语
综上所述,本实验通过对腹水样品处理及色谱、质谱条件进行了良好的优化后,基于LC-MS/MS法建立了恶性腹水中紫杉醇的定量检测方法。该方法的精密度和准确度良好,线性、稳定性、提取回收率及基质效应等符合2015年版《中国药典》生物样本检测方法的要求,为未来肿瘤患者恶性腹水中紫杉醇的代谢研究、量效关系考察提供了研究基础。
参考文献
[ 1 ] 吴菲,林国桢,张晋昕.我国恶性肿瘤发病现状及趋势[J].中国肿瘤,2012,21(2):81-85.
[ 2 ] 王怀碧,江飞龙,赖宗浪,等.恶性腹水的治疗现状及进展[J].中国中医急症,2017,26(12):2162-2164.
[ 3 ] 陈国宁,蔡茂怀.紫杉醇、奥沙利铂联合榄香烯腹腔灌注治疗胃癌晚期癌性腹水的临床观察[J].中国药房,2016,27(36):5095-5097.
[ 4 ] SCHIFF PB,FANT J,HORWITZ SB. Promotion of microtubule assembly in vitro by taxol[J]. Nature,1979,277(5698):665-667.
[ 5 ] 郭增清,陳誉,陈玲,等.含紫杉醇两药方案联合腹腔灌注化疗治疗合并腹腔种植转移的晚期胃癌临床观察[J].徐州医学院学报,2013,33(9):592-597.
[ 6 ] 杨涛,崔福德,金大德. RP-HPLC法测定紫杉醇在大鼠血浆中的含量[J].沈阳药科大学学报,2008,25(1):48-51.
[ 7 ] FURMAN C,CARPENTIER R,BARCZYK A,et al. Development and validation of a reversed-phase HPLC method for the quantification of paclitaxel in different PLGA nanocarriers[J]. Electrophoresis,2017,38(19):2536- 2541.
[ 8 ] 王艳宝,赵楠,王洪亮,等. LC-MS/MS法分析和鉴定抗肿瘤药MTC-220原料药中的杂质[J].中国药房,2012,23(37):3510-3514.
[ 9 ] GAO S,ZHOU J,ZHANG F,et al. Rapid and sensitive liquid chromatography coupled with electrospray ionization tandem mass spectrometry method for the analysis of paclitaxel,docetaxel,vinblastine,and vinorelbine in human plasma[J]. Therapeutic Drug Monitoring,2014,36(3):394-400.
[10] 钱隽,王漪璇,苏圣民,等. LC-ESI-MS法测定人血浆中紫杉醇的浓度及其在药代动力学中的应用[J].中国药学(英文版),2012,21(4):304-310.
[11] FERN?NDEZ-PERALBO MA,PRIEGO-CAPOTE F,LUQUE DE CASTRO MD,et al. LC-MS/MS quantitative analysis of paclitaxel and its major metabolites in serum,plasma and tissue from women with ovarian cancer after intraperitoneal chemotherapy[J]. J Pharm Biomed Anal, 2014.DOI:10.1016/j.jpba.2013.12.028.
[12] HENDRIKX JJ,ROSING H,SCHINKEL AH,et al. Combined quantification of paclitaxel,docetaxel and ritonavir in human feces and urine using LC-MS/MS[J]. Biomed Chromatogr,2014,28(2):302-310.
[13] JIANG SG,ZU YG,ZHANG L,et al. Determination of a hydrophilic paclitaxel derivative,7-xylosyl-10-deacetylpaclitaxel in rat plasma by LC-MS/MS[J]. Biomed Chromatogr,2009,23(5):472-479.
[14] MORTIER KA,RENARD V,VERSTRAETE AG,et al. Development and validation of a liquid chromatography-tandem mass spectrometry assay for the quantification of docetaxel and paclitaxel in human plasma and oral fluid[J]. Analytical Chemistry,2005,77(14):4677-4683.
[15] KOBAYASHI M. Pharmacokinetic study of paclitaxel in malignant ascites from advanced gastric cancer patients[J]. World J Gastroenterol,2006,12(9):1412-1415.
[16] LI D,ZHAO G,AI W,et al. Simultaneous LC-MS/MS bioanalysis of etoposide and paclitaxel in mouse tissues and plasma after oral administration of self-microemulsifying drug-delivery systems[J]. Biomed Chromatogr,2018,32(6):e4192.
[17] MO J,EGGERS PK,RASTON CL,et al. Development and validation of a LC/TOF MS method for the determination of carboplatin and paclitaxel in nanovesicles[J]. Anal Bioanal Chem,2014,406(11):2659-2667.
[18] 张鸣珊,刘国柱,李圣军,等.溶剂诱导相变萃取法用于高效液相色谱-质谱分析的血浆样品前处理[J].高等学校化学学报,2010,31(8):1517-1521.
[19] MALHI S,STESCO N,ALRUSHAID S,et al. Simultaneous quantification of reparixin and paclitaxel in plasma and urine using ultra performance liquid chromatography-tandem mass spectroscopy (UPLC-MS/MS):application to a preclinical pharmacokinetic study in rats[J]. J Chromatogr B Analyt Technol Biomed Life Sci,2017.DOI:10.1016/j.jchromb.2016.12.015.
(收稿日期:2019-09-10 修回日期:2019-11-13)
(編辑:邹丽娟)

