珍稀食用菌的抗氧化性评价及筛选
杨 娟, 杨立志, 邱铭锰, 陈婕婷, 徐叶洁, 刘新锐, 江玉姬,
(1.福建农林大学食品科学学院;2.福建农林大学菌物研究中心,福建 福州 350002)
活性氧自由基是体内高活性分子,通过氧化作用损伤组织器官,引起机体脂代谢、蛋白质代谢异常、DNA损伤,进而导致心脑血管及神经系统疾病;抗氧化剂能阻止氧化反应并清除自由基[1-2].因此,天然、无副作用的药物成为当今抗氧化性药物研发的重点之一.
食用菌富含蛋白质、维生素、矿物质等营养成分,具有高蛋白和低脂肪的特点.近年来,研究表明食用菌具有一定的药理活性,如抗氧化、抗肿瘤和消炎[3-4]等功效.我国菌类资源丰富,许多食用菌已实现工厂化栽培,如金针菇[5]、双孢蘑菇[6]和杏鲍菇[7]等.但关于珍稀食用菌如硫磺菌和木蹄层孔菌的抗氧化研究较少[8-9],且硫磺菌和木蹄层孔菌目前较难进行人工栽培.本文结合模糊数学评价法对14株珍稀食用菌的抗氧化性进行综合评价,旨在为珍稀食用菌的开发及加工利用奠定基础.
1 材料与方法
1.1 供试材料
菌株:14株菌株由福建农林大学菌物研究中心提供(表1).
1.2 主要试剂与设备
DPPH、乙醇、邻苯三酚、Tris-HCl缓冲溶液、盐酸、硫酸亚铁、水杨酸、过氧化氢、磷酸盐缓冲溶液、铁氰化钾、三氯乙酸、氯化铁均为分析纯.

表1 供试菌株
紫外分光光度计(UV-2601)由北京瑞利分析仪器有限公司提供;冷冻干燥机(LGJ-18S)由河南兄弟仪器设备有限公司提供;离心机(DL-5-B)由厦门精艺兴业科技有限公司提供.
1.3 方法
1.3.1 培养基的制备 PDA固体培养基:1 000 mL水、200 g马铃薯、20 g葡萄糖、20 g琼脂.PDB液体培养基:1000 mL水、200 g马铃薯、20 g葡萄糖[10].
1.3.2 食用菌发酵液与菌丝体提取液的制备 取一小块菌种转接于试管斜面上,置于25 ℃恒温培养箱培养7~10 d,待长满管后接4块大小较一致的菌块于100 mL PDB培养基中,置于25 ℃、160 r·min-1恒温箱培养8 d,过滤后分别得到发酵液(备用)和菌丝体,用去离子水冲洗菌丝体3次,预冻24 h后置于冷冻干燥机干燥24 h.称取0.1 g干燥的菌丝体,研磨,蒸馏水定容100 mL,超声提取30 min,过滤后取上清液即菌丝体提取液,测定发酵液和菌丝体提取液的抗氧化性,每组重复3次,取平均值.
1.3.3 DHHP自由基清除率的测定 参照林佳萍等[11]的方法.取样品1 mL,分别加0.1 mmol·L-1DPPH 1 mL充分混匀,避光静置30 min,于517 nm测定光密度.1 mL DPPH溶液与1 mL样品混合均匀,测定其光密度(D1);1 mL DPPH溶液与1 mL 95%(体积分数)乙醇混合均匀,测定其光密度(D2);测定空白对照光密度(D0).DPPH自由基清除率计算公式表示如下:
DPPH自由基清除率/%=[1-(D1-D2)/D0]×100
(1)
式中,D1为样品光密度,D2为样品参比液光密度,D0为空白对照光密度.
1.3.4 羟基(OH·)自由基清除率的测定 H2O2与Fe2+在水杨酸溶液体系中发生反应,产生OH·,同时水杨酸捕捉OH·生成有色物质,在510 nm处达到最大光密度值[12].依次向试管中加入1 mL 5 mmol·L-1水杨酸溶液、1 mL 5 mmol·L-1FeSO4和1 mL样品,最后加入1 mL 5 mmol·L-1H2O2,启动反应.室温反应30 min,测其光密度(D).空白液以蒸馏水代替样品,其它试剂相同;样品本底液以蒸馏水代替H2O2,其它试剂相同.羟基自由基清除率计算公式表示如下:
羟基自由基清除率/%=[D0-(D1-D2)]/D0×100
(2)
式中,D0为空白光密度,D1为样品光密度,D2为样品本底液光密度.
(3)
式中,D1表示不含有样品的光密度,D2表示不含有样品和邻苯三酚的光密度,D3表示含有样品的光密度,D4表示含有样品、不含有邻苯三酚的光密度.
1.3.6 食用菌还原力的测定 在试管中分别加入1 mL样品、1 mL 0.1 mol·L-1磷酸盐缓冲溶液(pH=6.5)、1 mL 1%(体积分数)铁氰化钾,混合均匀,于50 ℃反应20 min;迅速冷却后加入1 mL 10%(体积分数)三氯乙酸,混合均匀,3 000 r·min-1下离心10 min,取1 mL上清液,加3 mL去离子水和0.4 mL 0.1%(体积分数) FeCl3,混合均匀,静置10 min.以蒸馏水为空白对照.700 nm下测光密度[14].

权重的确定:由于各项指标对食用菌抗氧化性的影响程度不同,因此可根据各项指标的权重值确定一个权重向量[15].权重集是各项指标在总体抗氧化性中所占比重的集合,每一个抗氧化指标对应一个权重系数[16].并对所有指标的抗氧化数据进行归一化分析,得到权重系数(X)={x1,x2,x3,xn},0≤x≤1.∑xi=1,其中X因素是U中的一个模糊子集,X与U相互对应.
模糊关系综合评价集:采用模糊秩加权平均法建立模糊数学综合评价模型,将权重集x与模糊关系矩阵R相乘,得到模糊综合评价模型,即B=x·R.
(4)
式中,k为待定系数(k=2).

1.3.9 数据处理 采用Spss 19.0分析数据,采用Excel绘图.
2 结果与分析
2.1 食用菌发酵液与菌丝体提取液对DPPH自由基的清除率
DPPH自由基是具有单电子、稳定、以氮为中心的顺磁化合物,当自由基清除剂存在时,DPPH自由基接受一个氢原子或电子,形成稳定的DPPH-H化合物[17].由图1可知,除木蹄层孔菌外,其它菌株发酵液对DPPH的清除率均高于菌丝体提取液,表明食用菌发酵液对DPPH自由基具有较好的清除能力.其中13号硫磺菌(9+1)菌株、14号硫磺菌(9+2)菌株发酵液对DPPH的清除率较高,分别为96.6%和94.08%;12号朱红密孔菌(上杭)菌株发酵液对DPPH的清除率次之,为88.33%.从图1可知食用菌菌丝体的胞外浸出液和发酵过程中产生的次级代谢产物具有一定的抗氧化性[18].4个菌株发酵液对DPPH的清除率大小表现为13号硫磺菌(9+1)>14号硫磺菌(9+2)>12号朱红密孔菌(上杭)>4号红缘拟层孔菌(177),与其它菌株相比,有极显著差异(P<0.01),说明食用菌发酵液对DPPH自由基的清除率比菌丝体大.
2.2 食用菌发酵液与菌丝体提取液对OH·自由基的清除率
OH·是一种重要的活性氧化剂,其基团非常活泼,反应活性极强,具有电子配对的倾向[19-20].由图2可知,除了3号红缘拟层孔菌(270)、9号朱红密孔菌(78)菌株外,其它菌株发酵液对OH·自由基的清除率均高于菌丝体提取液.OH·自由基清除率较高的2株菌株为14号硫磺菌(9+2)和13号硫磺菌(9+1),清除率分别达到99.13%和98.93%.与其它菌株相比,差异极显著(P<0.01).
2.3 食用菌发酵液与菌丝体提取液对自由基的清除率
2.4 食用菌发酵液与菌丝体提取液的还原力
由图4可知,12号朱红密孔菌(上杭)、13号硫磺菌(9+1)菌株、14号硫磺菌(9+2)菌株发酵液的还原力均高于菌丝体,与其它菌株相比存在极显著差异(P<0.01).12号朱红密孔菌(上杭)、13号硫磺菌(9+1)、14号硫磺菌(9+2)发酵液的还原力分别为0.299、0.272、0.128.说明不同菌株之间发酵液产物存在差异性,同一菌种不同菌株可能因为生长特性有所不同,胞内外抗氧化活性物含量不同,导致抗氧化性有差异.
2.5 抗氧化性的综合评价
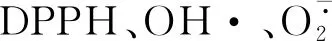
采用秩权平均法研究14株菌株抗氧化性并进行筛选(表2).由表2可知,各项指标权重系数X={0.33,0.3,0.32,0.05}.对其抗氧化性结果进行归一化处理得到模糊关系矩阵,以R1为例,确定其模糊综合评价模型B1.以同样方法得到其它菌株的模糊综合评价模型.

表2 不同菌株抗氧化的模糊评价
(5)
(6)
={0.61,0.68,0.45,0.78}
从表3可知,食用菌发酵液的抗氧化性比菌丝体提取液强,其中4种菌的抗氧化性较强,抗氧化性表现为14号硫磺菌(9+2)>13号硫磺菌(9+1)>4号红缘拟层孔菌(177)>12号朱红密孔菌(上杭).菌株发酵液抗氧化活性大于菌丝体,可能是因为不同菌株胞内和胞外产生的抗氧化物质的种类和含量不同[23].

表3 菌株抗氧化活性的综合评价及筛选
3 小结


