吴茱萸碱对缺氧微环境下胆囊癌细胞增殖及HIF-1α、VEGF表达的影响
徐智 刘春燕 温娟 刘绍华


[摘要] 目的 探讨吴茱萸碱对缺氧微环境下胆囊癌细胞(GBC-SD)增殖及缺氧诱导因子1α(HIF-1α)、血管内皮生长因子(VEGF)表达的影响。 方法 以3%O2、5%CO2模拟缺氧微环境,将GBC-SD分为正常对照组、缺氧组、吴茱萸碱(浓度100 μg/mL)+缺氧组,分别置于常氧和缺氧微环境下培养。MTT法检测各组12、24、48、72、96 h细胞增殖能力;Annexin V-FITC/PI双染流式法检测各组细胞凋亡情况;Western blot检测各组细胞HIF-1α、VEGF蛋白表达状况。 结果 MTT结果显示:12 h三組间细胞的光密度值比较,差异无统计学意义(P > 0.05);24、48、72、96 h缺氧组细胞的光密度值低于正常对照组,差异有统计学意义(P < 0.05);24、48、72、96 h吴茱萸碱(浓度100 μg/mL)+缺氧组细胞的光密度值低于缺氧组,差异有统计学意义(P < 0.05)。流式细胞结果显示:缺氧组细胞凋亡率高于正常对照组(P < 0.05);吴茱萸碱(浓度100 μg/mL)+缺氧组的细胞凋亡率高于正常对照组和缺氧组,差异均有统计学意义(均P < 0.05)。吴茱萸碱(浓度100 μg/mL)+缺氧组细胞内HIF-1α、VEGF的蛋白表达均低于正常对照组和缺氧组,差异均有统计学意义(均P < 0.05)。 结论 吴茱萸碱能够抑制缺氧微环境下GBC-SD增殖,并促进细胞凋亡,这可能与吴茱萸碱抑制肿瘤细胞内的HIF-1α和VEGF的表达有关。
[关键词] 吴茱萸碱;胆囊癌;缺氧诱导因子1α;血管内皮生长因子
[中图分类号] R735.8 [文献标识码] A [文章编号] 1673-7210(2020)06(b)-0030-04
Effects of evodotaxine on the proliferation of gallbladder carcinoma cells and the expression of HIF-1α and VEGF in anoxic microenvironment
XU Zhi1 LIU Chunyan2 WEN Juan1 LIU Shaohua3
1.Department of Clinical Medicine, Pingxiang Health Vocational College, Jiangxi Province, Pingxiang 337000, China; 2.Department of Nursing, Pingxiang Health Vocational College, Jiangxi Province, Pingxiang 337000, China; 3.Department of Hepatobiliary Surgery, Pingxiang People′s Hospital, Jiangxi Province, Pingxiang 337000, China
[Abstract] Objective To investigate the effects of evodotaxine on the proliferation of gallbladder carcinoma cells (CBC-SD) and the expression of hypoxia-inducing factor 1α (HIF-1α) and vascular endothelial growth factor (VEGF) in GBC-SD in anoxic microenvironment. Methods Using 3%O2 and 5%CO2 to simulate anoxic microenvironment, CBC-SD cells were divided into normal control group, hypoxic group and evodotaxine (100 μg/mL) + hypoxic group, they were cultured in normal and hypoxic microenvironments. MTT assay was used to detect the proliferation of 12, 24, 48, 72 and 96 h cells in each group. Annexin V-FITC/PI double staining flow method was used to detect apoptosis in each group. HIF-1α, VEGF protein expression was detected by Western blot. Results MTT results showed that there was no statistically significant difference in the optical density values between the three groups at 12 h (P > 0.05). At 24, 48, 72 and 96 h, the optical density of the hypoxia group was lower than that of the normal control group, and the difference was statistically significant (P < 0.05). At 24, 48, 72, and 96 h, the light density value of evodotaxine (100 μg/mL) + hypoxia group was lower than that of the hypoxia group, and the difference was statistically significant (P < 0.05). Flow cytometry results showed that the apoptosis rate of hypoxia group was higher than that of normal control group (P < 0.05). The apoptosis rate of evodotaxine (100 μg/mL) + hypoxia group was higher than that of normal control group and hypoxia group, and the difference was statistically significant (all P < 0.05). The protein expression of the HIF-1α, VEGF in the cells of the evodotaxine (100 μg/mL) + anoxic group was lower than that of the normal control group and the hypoxic group, and the differences were statistically significant (all P < 0.05). Conclusion Evodotaxine can inhibit the proliferation of GBC-SD cells in gallbladder cancer under hypoxic microenvironment and promote apoptosis, which may be related to evodotaxine′s inhibition of HIF-1α and VEGF expression in tumor cells.
[Key words] Evodiamine; Gallbladder carcinoma; Hypoxia-inducing factor 1α; Vascular endothelial growth factor
胆囊癌是胆道系统最常见的恶性肿瘤之一,近年来该病的发生率和死亡率均有明显上升趋势[1-2]。长期以来,胆囊癌因其发病隐匿、病情进展迅速、手术切除率较低等特点,使该病在早期诊断及治疗方面没有取得有效进展,加之手术及放化疗的效果不理想,患者预后不佳[3]。因此,急需寻找一种有效治疗胆囊癌的方法。
吴茱萸碱是中药吴茱萸的有效成分,它不仅能调节免疫,同时也能抑制肿瘤增殖,促进肿瘤凋亡[4-5],但其具体的抗肿瘤分子机制仍不明确。本研究采用人胆囊癌细胞(GBC-SD)作为研究对象,探讨吴茱萸碱对GBC-SD增殖的影响及相关分子机制,现报道如下:
1 材料与方法
1.1 材料与细胞培养
DMEM培养基(Hyclone,货号:SH30022.01);胎牛血清(GIBCO,货号:42F7180K);Annexin V-FITC/PI双染细胞凋亡检测试剂盒(Biolegend);血管内皮生长因子(VEGF)兔抗人多克隆抗体(Abclonal,货号:A2556);缺氧诱导因子1α(HIF-1α)鼠抗人多克隆抗体(Abcam,货号:Ab113642),胰酶(Genview,货号:89040101100),MTT(Genview,货号:298-93-1)。荧光倒置显微镜(日本Nikon),流式细胞仪(美国BD),酶标仪(美国Thermo Labsystems),化学发光仪(上海勤翔)。GBC-SD(购于中国科学院细胞库)置于含10%胎牛血清的DMEM培养基,在37℃饱和湿度、含5%CO2的常氧孵箱中培养;以37℃饱和湿度,含3%O2、5%CO2的条件模拟肿瘤细胞缺氧环境。
1.2 MTT法检测GBC-SD增殖能力
分组:正常对照组(常氧组),缺氧组(模拟缺氧环境),吴茱萸碱(浓度100 μg/mL)+缺氧组。取对数生长期的GBC-SD悬液,以0.8×104个/孔的密度接种于96孔板中培养,放于常氧和缺氧环境下各培养24 h,按照分组加入吴茱萸碱100 μg/mL,再继续培养12、24、48、72、96 h;弃培养液,每孔加150 μL DMSO,振荡10 min;选择490 nm波长测定各孔吸光值,实验重复3次。
1.3 流式细胞术检测GBC-SD的凋亡情况
采用Annexin V-FITC/PI双染流式细胞术进行检测。细胞分组同MTT法,取处于对数生长期的GBC-SD悬液,以密度为3.5×104个/孔接种到6孔板中,放于常氧和缺氧環境下各培养24 h,按分组加入吴茱萸碱100 μg/mL,再继续培养24 h。收集各组细胞,PBS洗涤2次后加入Annexin V-PI,再加入FITC于室温下孵育15 min,用流式细胞仪检测细胞凋亡情况,实验重复3次。
1.4 Western blot检测VEGF、HIF-1α蛋白表达
实验分组同MTT法,提取各组细胞的总蛋白,使用BCA蛋白定量试剂盒进行蛋白浓度检测。分别制备浓缩胶和分离胶,加样后进行蛋白电泳、转膜,用含有5%脱脂牛奶封闭后,分别用一抗(稀释倍数1∶1000)、二抗(稀释倍数1∶1000)在室温下孵育1 h,后在暗室内加超敏发光液孵育5 min,放于化学发光成像系统成像,采用Image J分析软件进行图像分析,实验重复3次。
1.5 统计学方法
采用SPSS 23.0对所得数据进行统计学分析,计量资料采用均数±标准差(x±s)表示,多组间比较采用方差分析,两两比较采用LSD-t多重检验,以P < 0.05为差异有统计学意义。
2 结果
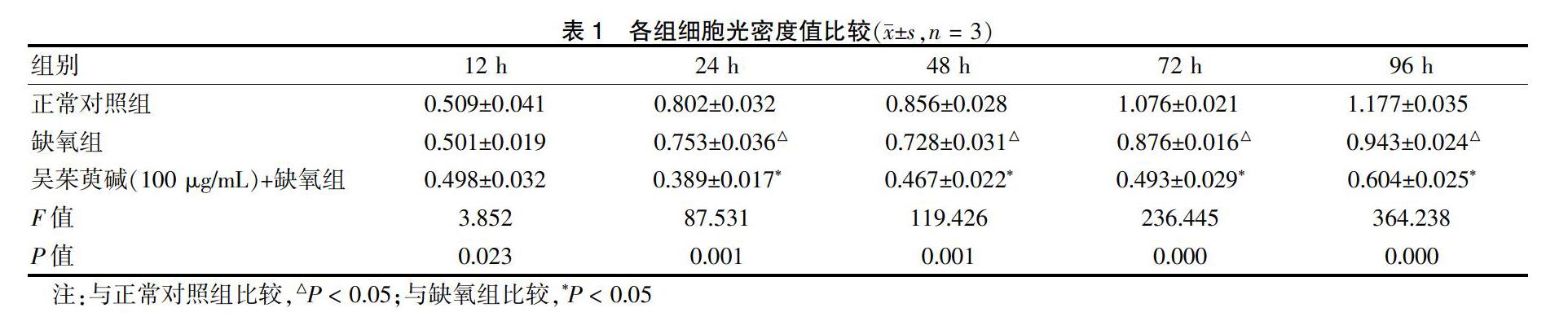
2.1 各组细胞光密度值比较
三组GBC-SD光密度值在12 h时比较,差异无统计学意义(P > 0.05);与正常对照组比较,24、48、72、96 h缺氧组细胞光密度值均降低,差异均有统计学意义(均P < 0.05);与缺氧组比较,吴茱萸碱(浓度100 μg/mL)+缺氧组24、48、72、96 h的细胞光密度值均降低,差异均有统计学意义(均P < 0.05)。见表1。
2.2 各组凋亡情况比较
三组GBC-SD的凋亡率分别:正常对照组为(6.97±0.36)%、缺氧组为(17.43±0.29)%、吴茱萸碱(浓度100 μg/mL)+缺氧组为(26.60±0.23)%,与正常对照组比较,缺氧组GBC-SD凋亡率升高,差异有统计学意义(P < 0.05)。吴茱萸碱(浓度100 μg/mL)+缺氧组GBC-SD凋亡率高于正常对照组和缺氧组,差异均有统计学意义(均P < 0.05)。见图1。
2.3 各组HIF-1α、VEGF蛋白表达水平比较
缺氧组GBC-SD的HIF-1α、VEGF蛋白的表达水平高于正常对照组,差异有统计学意义(P < 0.05)。与正常对照组比较,吴茱萸碱(浓度100 μg/mL)+缺氧组细胞内HIF-1α、VEGF蛋白表达水平降低,差异有统计意义(P < 0.05);与缺氧组比较,吴茱萸碱(浓度100 μg/mL)+缺氧组细胞内HIF-1α、VEGF蛋白表达水平降低,差异有统计意义(P < 0.05),吴茱萸碱能明显抑制GBC-SD内HIF-1α、VEGF蛋白表达。三组GBC-SD细胞的HIF-1α、VEGF蛋白表达带及蛋白表达量。见图2。
3 讨论
缺氧是实体肿瘤生长过程中普遍存在的状态,HIF-1α是肿瘤细胞在缺氧应答中的重要转录调节因子[6]。由于缺氧的程度和时间不同,HIF-1α在缺氧组织细胞凋亡中发挥了双重作用。一方面,随着肿瘤体积不断增大,其生长的微环境中氧含量出现降低时,肿瘤细胞内HIF-1α蛋白的降解过程被抑制,导致其在肿瘤细胞内不断积聚,进而刺激肿瘤细胞在缺氧状态下血管生成,改善肿瘤生长微环境[7-8];另一方面,HIF-1α也能促进肿瘤细胞的凋亡,在缺氧状态下,抑制凋亡蛋白数量减少,而促进凋亡蛋白Bax及前凋亡蛋白BNIP3表达水平均增高,并与HIF-1α表达水平呈正相关;此外野生型p53与HIF-1α的氧依赖ODD相互作用促进缺氧导致的细胞凋亡[9]。
VEGF是目前已知的作用最強、特异性最高的肿瘤血管生成促进因子,它也是HIF-1α的重要靶基因之一。VEGF能促进肿瘤细胞的增殖、抑制其凋亡,并且能够诱导肿瘤细胞对放、化疗产生耐受。研究发现,肿瘤细胞高表达的HIF-1α不仅可与VEGF 5′-末端增强子相互作用,促进VEGF基因表达上调;还可增加VEGF mRNA的稳定性,促进肿瘤细胞VEGF表达增加,从而调节肿瘤血管生成,增加肿瘤的供氧能力[10-11]。在肿瘤的血管生成和生长侵袭过程中VEGF和HIF-1α两者起着相互协同的作用。多项研究提示,通过抑制HIF-1α的表达使VEGF的表达下调,可减少肿瘤组织的血管生成,抑制肿瘤组织在缺氧微环境下的糖酵解,从而抑制肿瘤生长[12-14]。
研究显示,胆囊癌组织中的HIF-1α、VEGF均为高表达状态,二者的表达量不仅与胆囊癌组织中的微血管计数呈正相关,也与患者的疾病进展成明显正相关[15-16]。细胞凋亡实验结果提示,缺氧微环境诱导胆囊癌细胞的凋亡,推测可能是由于缺氧时间较短,HIF-1α介导的促凋亡作用强于抗凋亡作用。蛋白检测结果显示,无论是在常氧环境还是在缺氧微环境下,GBC-SD内的HIF-1α和VEGF蛋白均有表达,但在缺氧的微环境下二者的表达要明显增强。GBC-SD内的HIF-1α在缺氧微环境的刺激下表达上调,并诱导其下游靶基因VEGF的表达增强。
吴茱萸碱是中药吴茱萸的有效成分,具有抗肿瘤作用[17]。大量实验结果证实,吴茱萸碱能够抑制肿瘤细胞的生长、促进其凋亡,并能抑制肿瘤细胞的侵袭转移[18-20]。吴茱萸碱可通过抑制HIF-1α使VEGF的表达下调,导致过度增殖的肿瘤细胞无法适应缺氧微环境,达到抑制肿瘤增殖的效果[21]。此外,吴茱萸碱还可通过抑制缺氧状态下肿瘤细胞HIF-1α的表达促进肿瘤细胞的凋亡[22-23]。本实验结果显示,在缺氧微环境下,吴茱萸碱能够抑制GBC-SD的增殖,同时促进其凋亡。进一步的实验结果提示,吴茱萸碱能够明显抑制GBC-SD的HIF-1α及VEGF蛋白的表达。由此,本研究认为在缺氧微环境下,通过抑制HIF-1α及其靶基因VEGF的表达可抑制GBC-SD增殖并促进其凋亡。因此,抑制肿瘤细胞HIF-1α及其靶基因VEGF的过表达,对于抑制肿瘤细胞的增殖、促进其凋亡有着十分重要的意义,这为抑制肿瘤生长带来了新的思路。
综上所述,吴茱萸碱能够抑制缺氧微环境下GBC-SD的HIF-1α、VEGF蛋白的表达,使其无法适应缺氧微环境,从而抑制肿瘤细胞的生长,这为胆囊癌的治疗提供了新方向。
[参考文献]
[1] 阮戈.胆囊癌患者HIF-1α在胆囊癌侵袭转移中的作用研究[J].中国普通外科杂志,2012,21(8):1004-1006.
[2] Hundal R,Shaffer EA. Gallbladder cancer:epidemiology and outcome [J]. Clin Epidemiology,2014,6(1):99-109.
[3] 孙学军,石景森,王林,等.原发性胆囊癌诊治分析(附1222例报告)[J].中国实用外科杂志,2014,34(2):179-182.
[4] 张志仙,蒋美玲,王欣慧,等.吴茱萸碱的药理学研究进展[J].现代生物医学进展,2014,14(21):4189-4191.
[5] 张庆然,周昭伶,潘振海,等.吴茱萸碱抑制Huh7细胞生长并增强细胞对TRAIL的敏感性[J].中国病理生理杂志,2018,34(2):212-217.
[6] Jun JC,Rathore A,Younas H,et al. Hypoxia-Inducible Factors and Cancer [J]. Curr Sleep Medicine Rep,2017,3(1):1-10.
[7] 秦一雨,王健东,全志伟.胆囊癌血管生成的研究进展[J/CD].中华肝脏外科手术学电子杂志,2016,5(1):56-58.
[8] Schito L. Hypoxia-Dependent Angiogenesis and Lymphangiogenesis in Cancer [J]. Adv Exp Med Biol,2019,1136:71-85.
[9] 杜静,孙保存,刘易欣.缺氧诱导因子-1α在肿瘤学中的研究进展[J].临床与实验病理学杂志,2013,29(5):548-551.
[10] May D,Itin A,Gal O,et al. Ero1-L alpha plays a key role in a HIF-1-mediated pathway to improve disulfide bond formation and VEGF secretion under hypoxia:implication for cancer [J]. Onco-gene,2005,24(6):1011-1020.
[11] Liu K,Xu LM,Peng J,et al. The Changes of HIF-1α and VEGF Expression After TACE in Patients With Hepatocellular Carcinoma [J]. J Clin Med Res,2016,8(4):297-302.
[12] Jayant D,Sonal S,Sakshi M,et al. Salinomycin inhibits breast cancer progression via targeting HIF-1α/VEGF mediated tumor angiogenesis in vitro and in vivo [J]. Biochem Pharmacol,2019,164:326-335.
[13] Tian QG, Wu YT,Liu Y,et al. Expressions and correlation analysis of HIF-1α,survivinand VEGF in patients with hepatocarcinoma [J]. Eur Rev Med Pharmacol Sci,2018,22(11):3378-3385.
[14] Zhou F,Du J,Wang JJ. Albendazole inhibits HIF-1α-dependent glycolysis and VEGF expression in non-small cell lung cancer cells [J]. Mol Cell Biochem,2017,428(1/2):171-179.
[15] Lin W,Jiang L,Chen Y,et al. Vascular endothelial growth factor-D promotes growth,lymphangiogenesis and lymphatic metastasis in gallbladder cancer [J]. Cancer Lett,2012,314(2):127-136.
[16] Xu DQ,Li JW,Jiang FF,et al. The Effect and Mechanism of Vascular Endothelial Growth Factor (VEGF) on Tumor Angiogenesis in Gallbladder Carcinoma [J]. Iran J Public Health,2019,48(4):713-721.
[17] Hu X,Li DH,Chu C,et al. Antiproliferative Effects of Alkaloid Evodiamine and Its Derivatives [J]. Int J Mol Sci,2018,19(11):3403.
[18] Ji YH,So HP,Hye YM,et al. Anti-Proliferative Effects of Evodiamine in Human Lung Cancer Cells [J]. J Cancer Prev,2014,19(1):7-13.
[19] Zhou P,Li XP,Jiang R,et al. Evodiamine inhibits migration and invasion by Sirt1-mediated post-translational modulations in colorectal cancer [J]. Anticancer Drugs,2019,30(6):611-617.
[20] Shen HM,Zhao S,Xu ZP,et al. Evodiamine inhibits proliferation and induces apoptosis in gastric cancer cells [J]. Oncology letters,2015,10(1):367-371.
[21] Huang J,Chen ZH,Ren CM,et al. Antiproliferation effect of evodiamine in human colon cancer cells is associated with IGF-1/HIF-1αdown regulation [J]. Oncol Rep,2015,34(6):3203-3211.
[22] Li YL,Zhang NY,Hu X,et al. Evodiamine induces apoptosis and promotes hepatocellular carcinoma cell death induced by vorinostat via downregulating HIF-1α under hypoxia [J]. Biochem Biophys Res Commun,2018,498(3):481-486.
[23] 袁志堅,何文涓,胡晶.吴茱萸次碱药理学研究进展[J].中国医药导报,2018,15(36):40-43.
(收稿日期:2019-12-16 本文编辑:封 华)

