赶黄草总黄酮对活化的肝星状细胞TGF-β1/Smads信号通路的影响
余 蕾,谢晓芳,彭 芙,谢 君,李梦婷,彭 成,
1成都中医药大学基础医学院,成都 610075;2四川大学药学院,成都 610021;3西南特色中药资源国家重点实验室,成都 611137
肝纤维化是一种世界性的常见病疾病,以肝内纤维结缔组织的异常增生为病理特征,主要是由于酒精肝、脂肪肝、病毒性肝炎、胆汁淤积性和代谢性肝损伤等刺激肝脏产生慢性炎症,诱导肝星状细胞活化,致使ECM的过度积累,从而导致肝纤维化[1-3]。目前,肝纤维化的治疗主要通过抗炎、抗病毒、减少ECM沉积等方式,但这些治疗效果并不理想,因此寻找有效的抗纤维化方法仍是当前的首要任务。
赶黄草又名水泽兰、水杨柳等,是虎耳草科扯根菜属植物扯根菜(PenthorumchinensePursh)的干燥地上部分,始载于明代《救荒本草》[4],具有清热活血、祛湿退黄、利水消肿等功效,可用于黄疸,水肿,跌打肿伤,以及各型肝炎、胆囊炎、脂肪肝等[5]。临床上有文献报道以赶黄草制成的单味成方制剂“肝苏颗粒”能明显改善慢性乙肝肝纤维化患者临床症状,具有降酶、退黄、促进肝功能恢复等作用,且对阻断及逆转肝纤维化有一定疗效[6,7]。课题组前期研究也证明“肝苏颗粒”对CCl4诱导所致的大鼠肝纤维化有显著的治疗作用,可改善肝功能、减轻肝脏纤维化病变。现代研究表明,赶黄草中主要含有黄酮、生物碱、多糖等成分,因黄酮成分含量较高且具有较强的抗氧化活性所以被广泛研究[8]。目前已有研究表明赶黄草总黄酮可抑制大鼠酒精性肝纤维化的形成,其抗肝纤维化作用可能与其抗氧化作用及抑制TNF-α和IL-6的分泌有关[5]。但是,赶黄草总黄酮治疗肝纤维化的具体作用机制尚不清楚,因此,本实验选用LX-2作为研究对象,采用TGF-β1刺激LX-2活化建立肝纤维化细胞模型,研讨赶黄草总黄酮抗肝纤维化的作用及可能的机理。
1 实验材料与仪器
1.1 实验药物
黄草总黄酮(total flavonoids ofPenthorumchinensePursh,TFPCP),赶黄草购于四川新荷花中药饮片股份有限公司,由成都搏屹科技有限公司提取,测得提取物中总黄酮的含量为55.3%。实验前将赶黄草总黄酮粉末溶于二甲基亚砜(DMSO)中,使用时稀释成所需浓度,各给药组中DMSO浓度均小于0.1%。

表1 赶黄草总黄酮含量测定结果
1.2 实验细胞
HSC-LX2(苏州北纳创联生物技术有限公司,货号:BNCC337957)。
1.3 实验试剂
Human TGF-β1(美国Pepro Tech 公司)、FBS(美国Gibco公司)、RPIM-1640培养基(美国Gibco公司)、MTT(德国Biofroxx公司)、Ⅰ型鼠尾胶原(杭州欣友生物技术有限公司)、α-SMA(Actin alpha,smooth muscle aorta)、FN、Col Ⅰ酶联免疫吸附测定试剂盒(武汉Elabscience 公司)、兔抗Smad7多克隆抗体(美国Proteintech公司)、兔抗Smad2、phospho-Smad2、Smad3、phospho-Smad3、α-SMA抗体(美国Cell Signaling Technology公司)、辣根酶标记山羊抗兔IgG(北京中杉金桥生物技术有限公司)。
1.4 实验仪器
二氧化碳培养箱(Thermo公司)、酶标定量分析仪(Thermo公司)、MiLL-Q纯水仪(Millipore公司)、SW-CJ-1F型洁净工作台(苏净安泰集团苏州安泰空气技术有限公司)、倒置显微镜(德国蔡司公司)、电泳仪(Bio-Rad公司)、凝胶成像仪(广州博鹭滕公司)。
2 实验方法
2.1 细胞分组及处理
LX2细胞用含10% FBS和1%青-链霉素的RPIM-1640培养基培养,培养条件为:37 ℃、5% CO2,取对数生长期的细胞用于实验。在预实验中将赶黄草总黄酮药物浓度设定为5、10、15、20 mg/L时,发现浓度超过15 mg/L细胞毒性较大,而在浓度为10 mg/L时细胞存活率较高,故降低浓度间距,采用5、9、13 mg/L三个浓度进行实验。将细胞分为空白对照组、TGF-β1组、TGF-β1+赶黄草总黄酮5、9、13 mg/L组,除空白对照组以外,其余各组均使用TGF-β1(6 ng/L)处理24 h造模,造模成功后给予不同浓度的赶黄草处理24 h。
2.2 细胞活力测定
将细胞消化并重悬,调整细胞浓度为5×104个/mL,以每孔100 μL接种于96孔板,次日晨给予TGF-β1,作用24 h后分别给予不同浓度的赶黄草总黄酮,给药结束后每孔加入5 mg/mL的MTT溶液15 μL,避光孵育4 h后将细胞液全数吸出,每孔加入150 μLDMS0,摇床上震荡混匀,用酶标仪在波长为570 nm处测量OD值(A),计算细胞存活率:细胞存活率=(给药组A-调零孔A)/(空白组A-调零孔A)×100%。
2.3 细胞划痕试验
用标记笔在6孔板背面等距离画3条间隙为0.5 cm的虚线,用于后续拍照选取视野时定位。以1×106个/mL种板,次日给予TGF-β1造模,24 h后用10 μL的枪尖沿背面虚线在孔底画线,然后将培养液吸出,用无菌PBS轻轻冲洗将细胞碎片洗掉,分别加入含有不同浓度的赶黄草总黄酮的培养基,此时显微镜下选取视野进行拍照。培养24 h后,选择与第一次拍照相同的视野再次拍照。用Image J软件测量划痕的宽度。
2.4 细胞分泌ECM含量测定
将细胞以1×105个/mL接种于24孔板,药物作用完毕后将细胞上清液收集起来,离心去除细胞杂质,然后4 ℃保存备用,于一周内检测。检测具体操作方法按ELISA试剂盒说明书进行。
2.5 胶原收缩试验
因LX-2活化后产生的ECM可使胶原收缩,增加血管阻力、促进门脉高压[9],故可通过体外建立三维胶原,研究赶黄草总黄酮对胶原收缩的影响。将Ⅰ型鼠尾胶原以300 μL/孔铺满24孔板底,待胶原凝固后每孔加500 μL培养液平衡胶原。将细胞将细胞以1×105个/mL接种于板内,造模完成后用枪头沿胶原边缘划一圈,使胶原与板壁分离,然后给药处理,药物作用完毕后进行拍照,观察胶原收缩情况。
2.6 TGF-β1/Smads信号通路相关蛋白测定
细胞培养完成后用冰PBS清洗3遍,刮取细胞后离心,向沉淀中加入含有1%磷酸酶抑制剂和1%蛋白酶抑制剂的RIPA裂解液在冰上裂解30 min提取总蛋白;测定蛋白浓度后进行SDS-PAGE电泳,PVDF膜转移,用5% BSA室温封闭1 h,一抗4 ℃中过夜;次日用TBST洗三次后,每次8 min;二抗室温孵育1 h,然后TBST洗三次,用凝胶成像仪曝光并拍照。用Image J测量条带的灰度值。
2.7 统计学方法

3 实验结果
3.1 赶黄草总黄酮对TGF-β1活化的LX-2细胞活力的影响
如图1所示,与空白组相比,TGF-β1处理可促进细胞增殖(P<0.05),而给予药物作用后,各组细胞增殖均降低,且药物浓度越高,抑制作用越明显,在9 mg/L时有显著抑制作用(P<0.05)。说明赶黄草总黄酮可抑制TGF-β1活化后的LX-2的增殖。

图1 赶黄草总黄酮对TGF-β1活化后的LX-2细胞活力的影响
3.2 赶黄草总黄酮对TGF-β1活化的LX-2细胞迁移和胶原收缩能力的影响
表2与图2示,与空白组相比,TGF-β1刺激后,细胞划痕愈合率明显增加(P<0.01);而在给药处理的各组中,划痕愈合率与单纯给TGF-β1组相比明显降低,在9 mg/L时抑制作用显著(P<0.01),说明赶黄草总黄酮可抑制LX-2的迁移。

图2 赶黄草总黄酮对TGF-β1活化后LX-2细胞迁移的影响

表2 赶黄草总黄酮对TGF-β1活化后的LX-2后的划痕愈合率
如图4示,与空白组相比,单纯给予TGF-β1刺激组,胶原收缩明显增加,而赶黄草总黄酮作用后的各组与单纯TGF-β1组相比较,胶原的收缩被明显抑制,作用效果呈剂量依赖,在9 mg/L时抑制用显著(P<0.01)。

图3 赶黄草总黄酮对TGF-β1活化后LX-2细胞胶原收缩的影响

图4 赶黄草总黄酮对TGF-β1活化的LX-2细胞分泌FN和Col I含量的影响
3.3 赶黄草总黄酮对TGF-β1活化的LX-2分泌FN和Col I含量的影响
图4结果显示,与空白对照组相比,TGF-β1刺激后,细胞分泌FN及ColⅠ显著增加(P<0.01),而在给予药物作用的各组里,FN及ColⅠ含量显著减少(P<0.01),说明赶黄草总黄酮可抑制FN及ColⅠ的沉积。
3.4 赶黄草总黄酮对TGF-β1活化的LX-2细胞TGF-β1/Smads 信号通路相关蛋白表达的影响
图5结果显示 在给予TGF-β1作用后,α-SMA分泌明显增加(P<0.05),而给予药物作用后,α-SMA分泌被抑制。另外,TGF-β1作用后,Smad3、p-Smad2和p-Smad3均显著增加(P<0.01),而给予药物作用后,其表达均有不同程度减少;Smad7在TGF-β1作用后则显著减少(P<0.05),而给予不同浓度药物作用后Smad7的分泌有一定程度的提升,且在药物浓度达到9 mg/L时,差别具有统计学意义(P<0.01)。
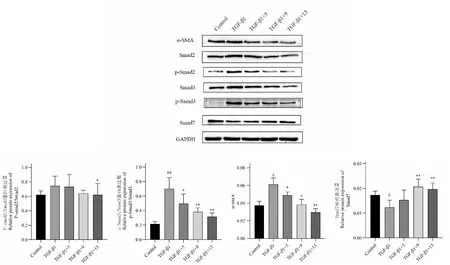
图5 赶黄草总黄酮对TGF-β1活化的LX-2细胞分TGF-β1/Smads 信号通路相关蛋白表达的影响
4 讨论
HSC-LX2是分布在肝脏各处的常驻的周围型细胞,在肝损伤过程中,LX-2被激活成肌成纤维细胞,产生大量α-SMA、ColⅠ等ECM,从而导致肝纤维化[10-13]。TGF-β1是一类能够调节细胞生长和分化的因子,可活化肝星状细胞,促进胶原基因表达、增加ECM沉积,是最重要的促肝纤维化细胞因子之一[14,15]。TGF-β1主要通过TGF-β1/Smads信号通路促进肝纤维化发展,TGF-β1与肝星状细胞表面受体结合,然后催化其下游Smad分子磷酸化,接着,磷酸化的Smad进入细胞核,调节其相应靶基因的转录,导致ECM产生[16,17]。Smad家族中Smad2和Smad3为受体激活型蛋白,可促进肝纤维化的进程;而Smad7则是一种抑制型蛋白,过表达可阻止Smad2和Smad3的磷酸化,抑制信号通路,减缓肝纤维化进程[18]。
本实验中,体外培养的LX-2在TGF-β1刺激后,细胞增殖及迁移速率显著增加,FN、Col I等细胞外基质大量沉积,胶原收缩明显增加,说明TGF-β1诱导肝星状细胞活化建立肝纤维化模型成立。而在给予赶黄草总黄酮处理后,细胞增殖和迁移速率被抑制,细胞外基质的沉积显著减少,胶原收缩明显降低,说明赶黄草总黄酮可抑制肝星状细胞的活化,减少细胞外基质的沉积,降低血管阻力,减缓肝纤维化的发展进程。此外,Western blot实验表明,TGF-β1作用后,Smad3、p-Smad2和p-Smad3表达均显著增加,Smad7表达则显著减少,可以说明TGF-β1/Smads信号通路被激活,而在给予赶黄草总黄酮处理后,Smad3、p-Smad2、p-Smad3表达均明显减少,Smad7的表达则明显提升,说明赶黄草可抑制TGF-β1/Smads信号通路。
综上所述,赶黄草总黄抑制肝星状细胞的增殖和迁移,减少ColⅠ及FN等细胞外基质的沉积,机制与其抑制TGF-β1/Smads信号通路有关。这可能是赶黄草治疗肝纤维化的机制之一。

