基于量表的帕金森病睡眠障碍的发生率及临床特点分析
张荷笛 张丽 朱骏 蒋旭 吴壮
PD是一种常见的与年龄相关的神经系统变性疾病,患病率随年龄增长而增加,超过60岁的老年人发病率约为1%~2%[1]。随着对该病的研究和认识,除运动症状外,嗅觉减退、认知障碍、睡眠障碍(sleep disorders,SD)、情绪改变以及自主神经功能障碍等非运动症状(non-motor symptoms,NMS) 逐渐引起临床医生的重视。其中,SD作为PD重要的非运动症状,1817年首先被James Parkinson作为PD晚期出现的伴随症状所提及[2]。现研究发现,SD在PD的前驱期即可出现,睡眠质量的持续恶化可作为PD发生的前驱期标志[3],并发展贯穿在整个疾病过程中。常用的对睡眠状况的评价方式包括睡眠相关量表评定及视频多导睡眠监测(PSG)。本研究通过整理多种PD相关量表数据,回顾性分析PD病人SD的发生率、临床特点,并探讨相关因素间的关系,以便于临床诊疗中早期发现、干预SD,有效提高病人的生活质量。
1 资料与方法
1.1 研究对象 选取2017年3月至2018年2月于南京脑科医院PD门诊就诊、经神经科专科医生确诊的原发性PD病人253例。入组标准:参照UK脑库原发性PD的诊断标准[4]。排除标准:(1)各种原因引起的继发性帕金森综合征及帕金森叠加综合征病人;(2)合并严重器质功能障碍(如心肺衰竭、COPD、颈腰椎病等)及恶性肿瘤等重大疾病病人;(3)精神病及药物成瘾者;(4)听力丧失、言语障碍、痴呆及其他原因不能配合完成评估者。所有纳入病人均签署知情同意书。
1.2 研究方法
1.2.1 病人一般情况及临床资料收集:采集包括性别、年龄、起病年龄、病程、受教育程度、临床表型、PD家族史及抗PD用药情况等信息,并将使用药物转换为左旋多巴等效剂量[5](levodopa equivalent dose,LED)。根据Mehanna等[6]对PD发病年龄的研究,以49岁为界分为早发型和晚发型;按照PD病人临床表现分为震颤型、强直型和混合型3种PD类型。
1.2.2 分组:根据匹兹堡睡眠质量指数(PSQI)评分结果对病人进行分组。总分≥7分认为存在SD[7],为SD组,PSQI评分<7分为NSD组。
1.2.3 病情严重程度:采用Hoehn-Yahr (H-Y)分级进行评估,据病情分为1~5级,将1~2级定义为早期,3~5级定义为中晚期[8]。
1.2.4 运动功能:PD开期的运动症状采用统一帕金森病评分量表第三部分(UPDRS-Ⅲ)进行评价,分数越高,运动障碍越重。
1.2.5 非运动症状:采用帕金森病非运动症状问卷(NMS-Quest)30项评估非运动症状,问卷内容涉及感觉、神经精神、自主神经功能及睡眠情况,分数越高,表示存在的非运动症状越多。同时采用汉密尔顿抑郁量表(HAMD)24项评价抑郁情况,总分≥8分认为可能存在抑郁。汉密尔顿焦虑量表(HAMA)14项评价焦虑情况,总分≥7分认为可能存在焦虑。采用MMSE和MoCA评估病人的认知功能受损情况,评分越低,认知功能损害越重。
1.2.6 生活质量:采用39项生活质量调查问卷(PDQ39)评估病人日常生活状况,分数越高,生活质量越差。
2 结果
2.1 PD病人睡眠障碍的发生率 253例PD病人中,有165例存在SD,SD发生率为65.22%;其中男性100例(60.61%),女性65例(39.39%);按发病年龄分型,早发型10例(6.06%),晚发型155例(93.94%);按临床症状分型,震颤型47例(28.48%),强直型87例(52.73%),混合型31例(18.79%);按病情严重程度分期,早期92例(55.76%),中晚期73例(44.24%)。
2.2 NSD和SD组人口资料的比较 2组病人性别、年龄、起病年龄、按发病年龄分型、受教育程度、PD家族史差异均无统计学意义(P>0.05)。见表1。
2.3 NSD和SD组运动功能的比较 SD组的UPDRS-Ⅲ评分及H-Y分级显著高于NSD组,差异有统计学意义(P<0.05)。见表1。

表1 NSD与SD组一般资料及临床特征的比较
2.4 NSD和SD组其他非运动症状的比较 2组病人日间思睡、入睡困难/易醒、夜梦增多及休息时下肢不适发生率差异有统计学意义(P<0.05)。2组其他非运动症状,如疼痛、兴趣减退、情绪低落、焦虑、注意力下降、头晕乏力、夜尿增多发生率差异亦有统计学意义(P<0.05),见表2。

表2 NSD与SD组非运动症状的比较(n,%)
2.5 NSD和SD组情绪、认知及生活质量的比较 2组病人HAMD评分、HAMA评分、MMSE评分、MoCA评分及PDQ39评分差异均有统计学意义(P<0.05),见表3。
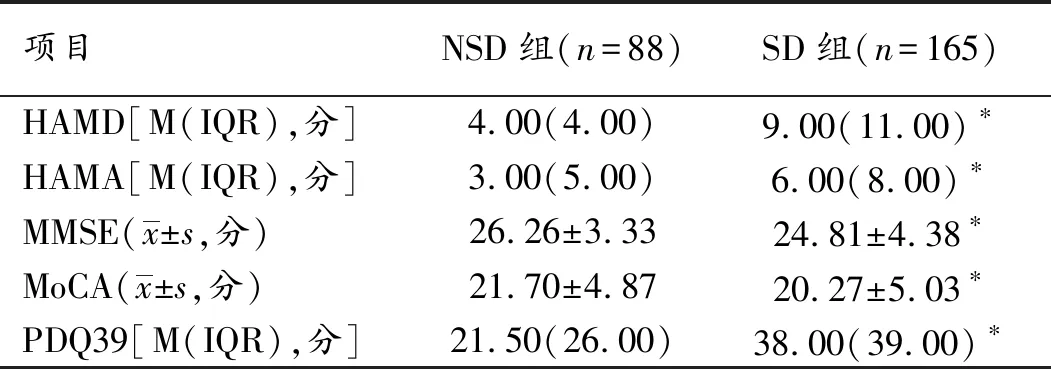
表3 NSD与SD组情绪、认知及生活质量的比较
2.6 睡眠障碍的相关因素分析 Spearman相关分析显示,PSQI评分与性别、起病年龄、教育程度、PD家族史无相关性,与年龄、病程、亚型、LED、H-Y分级、UPDRS-Ⅲ评分、HAMD评分、HAMA评分、PDQ39评分呈正相关(r=0.164、0.171、0.177、0.191、0.336、0.310、0.470、0.359、0.429,P<0.05),与MMSE评分、MoCA评分呈负相关(r=-0.271-0.225,P<0.05)。
3 讨论
睡眠障碍常见于PD病人,可发生在PD的临床前期、前驱期及临床期的任一时期。其发病机制尚未明确,病因学多样,包括调节睡眠区域的神经变性及递质的改变,睡眠结构被年龄、情绪、药物等因素影响,药物诱发的睡眠障碍及多因素所致的睡眠破碎[9]。失眠、快速眼动睡眠行为障碍、日间嗜睡、不宁腿综合征及昼夜节律紊乱是临床上最常见的SD表现形式[10]。不同形式的睡眠障碍可单发或共存。文献报道PD伴发SD的发生率可高达98%[11]。本研究中,PD病人SD的发生率为65.22%,可能与诊断标准的差异、人口资料的选择及评估方式的不同有关。
本研究结果显示,SD组较NSD组病人运动症状重,中晚期例数占比高,每日使用LED明显增高。原因可能在于抗PD药物可通过抑制快速动眼相(REM)对睡眠结构产生影响[2],且多巴胺能药物对睡眠存在剂量相关的双相作用,低剂量使用可缓解运动障碍,改善睡眠,长期大量使用可延长睡眠潜伏期、降低睡眠效率而加重睡眠障碍[12]。PD病程与PSQI 评分呈正相关,原因可能因病程的延长,PD病人的病理进程继续进展,运动症状较前加重,并易出现其他非运动症状,而与PD相关的运动和非运动症状也会导致夜间睡眠问题[13]。Zhu等[14]对421例PD病人的失眠状况进行了为期5年的纵向队列研究,基线失眠患病率为27%,随着时间的推移,无失眠PD病人中33%出现失眠症状。另一项对400例PD病人日间过度嗜睡(EDS)的研究中,基线EDS患病率为43%,随着病程延长,在无EDS的PD病人中,5年间EDS患病率为46%[15]。以上研究均证实病程进展与SD发生的相关性。
2组病人在发病年龄分型中,均以晚发型为主(>90%),符合该病的临床起病年龄特点。临床亚型分型中,SD组强直型发生率最高,而NSD组则以震颤型更常见,相关分析提示SD的发生与运动亚型相关,强直型对SD的影响最大。原因可能在于:(1)强直型PD病人的运动症状导致病人夜间活动受限更为显著,肌肉强直、肌张力增高导致翻身困难、疼痛以及夜间起卧、如厕困难,更易造成SD的发生。(2)强直型较震颤型PD病人非运动症状增加[16],从而造成SD的发生增加。(3)强直型病人多表现为轴性损伤,对左旋多巴的反应不佳,以致较震颤型使用的多巴胺剂量相对增加,而大剂量药物的使用可能造成SD的进一步加重。将病人按病情严重程度分组,NSD组早期占比人数更高,SD组相较趋向于中晚期,提示病情的严重程度对SD的发生存在影响,结果与Lin等[17]的研究结果一致。
本研究中,SD组抑郁和焦虑的发生率明显高于NSD组,分别为61.21%(101/165)和21.59%(19/88)、45.45%(75/165)和22.73%(20/88)。抑郁和焦虑症状是独立存在的,与睡眠障碍存在相关性[18]。Seritan等[19]探讨PD病人焦虑、抑郁的发病年龄时发现,焦虑与抑郁早于PD出现,原因可能在于脑干黑质神经元变性出现在运动障碍之前,脑干网状核和部分边缘系统已存在神经退行性变,情绪障碍可能是PD出现前的信号。因此,重视早期出现的情绪问题不仅有助于睡眠质量的提高,也有助于PD的早期诊治。睡眠障碍与认知功能损害可能存在相互影响关系[20]。郭鹏等[21]对394例PD病人的研究发现,伴有认知损害的病人表现出更多诸如总睡眠时间减少、睡眠效率降低、觉醒次数增加的睡眠问题。
综上,PD病人SD发生率较高,严重影响病人的生活质量。重视PD病人的睡眠,早期识别并干预出现的睡眠问题及相关因素,个体化制定抗PD用药方案,对PD病人整体生活质量的提高有一定积极意义。

