EP受体拮抗剂AH6809对炎症导致的BV-2小胶质细胞凋亡的影响*
蒋鸿雁 曹 艳□ 李恒希 吴德野 杨方林 吴海鹰# 李 坪△
(1 昆明医科大学人体解剖学与组织学胚胎学系,昆明 650500;2 齐鲁医药学院人体解剖学与组织学胚胎学系,淄博 255213;3 昆明医科大学第一附属医院急诊医学科,昆明 650032)
小胶质细胞在中枢神经系统(central nervous system,CNS)内约占成熟胶质细胞的10%,是CNS固有的巨噬细胞和免疫监视细胞。小胶质细胞是脑内炎症反应的主要执行者[1],一旦受到免疫原或内毒素的刺激就会被激活,分泌前列腺素E2(prostaglandin E2,PGE2)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和 白 介 素-1β(interleukin-1β,IL-1β)等炎症因子[2]。这些炎症介质的过量产生成为损害大脑的主要神经毒素[3],其中的 PGE2在炎症早期反应中发挥着重要作用。在正常生理和病理状态下,PGE2通过作用于靶细胞膜表面的4种G蛋白偶联受体亚型(EP1、EP2、EP3和EP4)发挥调节作用[4],其中EP2受体与慢性炎症和神经退行性疾病的继发性神经毒性密切相关[5]。国内外文献记载了AH6809作为EP2受体抑制剂的应用[6-8],在细胞实验研究中,大部分仅做了AH6809对细胞活力的检测,而未对其是否诱发细胞凋亡进行探索。脂多糖(lipopolysaccharides,LPS)被广泛应用于激活和诱导小胶质细胞释放致炎因子和一系列活性物质,从而对神经元产生毒性作用[9-10]。因此,本研究使用AH6809干预LPS激活的小鼠小胶质细胞株BV-2细胞[11],通过免疫荧光染色、流式细胞术、TUNEL等检测不同浓度AH6809干预炎症反应导致BV-2细胞的凋亡情况。
1 材料和方法
1.1 材料
DMEM培养基、小胶质细胞特异性标记物lectin-FITC、荧光二抗Cy3标记羊抗兔多克隆IgG、一抗多克隆兔抗cleaved caspase-3和一抗鼠抗单克隆β-actin,购于Sigma公司(美国);10%胎牛血清,购于Invitrogen公司(美国);EP2受体拮抗剂AH6809,购于Cayman公司(美国);二抗为羊抗兔IgG和羊抗鼠IgG,购于Pierce公司(美国);TUNEL试剂盒购于德国罗氏公司。
1.2 BV-2细胞培养
用含1%抗生素和10%FBS的DEME培养基,将BV-2细胞置于恒温箱(37℃,含5%CO2)培养。每2 d更换培养液,当BV-2细胞密度达80%时,用胰酶消化,传代比例控制在1∶4,当其密度达3×105/mL时接种于6孔板中。实验分为正常对照组、LPS组和LPS+AH6809干预组。此外LPS+AH6809组 在LPS(1 μg/L)作 用 下,各 滴加不同浓度梯度的AH6809,即10、20、30、40、80 μmol/L和160 μmol/L,然 后 再 孵 育24 h后 进行分析,各组分别为:LPS+AH10、LPS+AH20、L P S+A H 3 0、L P S+A H 4 0、L P S+A H 8 0、LPS+AH160。用倒置显微镜观察实验各组BV-2细胞的形态、密度和贴壁状况。
1.3 免疫荧光细胞化学检测cleaved caspase-3表达
将制备好的细胞爬片用预冷的4%多聚甲醛磷酸缓冲液进行固定(15 min),室温下用5%羊血清封闭(1 h),滴加稀释浓度为1∶200的兔抗cleaved caspase-3多克隆抗体,将培养板放入湿盒中过夜(4℃);加入稀释浓度为1∶100的羊抗兔荧光二抗Cy3,室温孵育1 h; PBS液冲洗后加入稀释浓度为1∶300的lectin-FITC,室温孵育1 h;同样方法PBS液冲洗后,用稀释比例为1∶50 000的DAPI复染细胞核;吸干爬片上的液体,用准备好的荧光封片剂封片;将制备好的玻片用锡箔纸遮光,放在室温下,待其干燥后,利用激光共聚焦显微镜进行观察和拍片。
1.4 TUNEL法原位检测细胞凋亡
采用细胞凋亡检测试剂盒提供的实验步骤进行TUNEL实验;DAPI复染细胞核(10 min);用PBS漂洗3次(每次5 min),荧光封片剂封片;室温下用锡箔纸遮光进行干燥,激光共聚焦显微镜采图。
1.5 流式细胞仪检测细胞凋亡
用0.25%胰酶充分消化BV-2细胞后吹打为单细胞悬液置于离心机离心,1 500 r/min,10 min;用预先准备好的EP管收集离心后的BV-2细胞;用PBS洗涤2次,每次5 min,后用浓度为70%预冷乙醇固定;PBS洗涤2次,每次5 min,将细胞浓度调整为1×106/mL后,加入碘化丙啶染液充分摇匀;室温下进行避光染色,30 min,再用流式细胞仪进行检测;采用Cell Quest Pro收集所需实验数据,并通过Mod Fit进行分析。
1.6 免疫印迹检测cleaved caspase-3蛋白含量
BV-2细胞加入细胞裂解液,置于离心机离心,4℃,13 000 r /min,25 min,收集上清;用含有蛋白酶抑制剂的试剂提取蛋白质; SDS-PAGE电泳分离;通过半干法将蛋白转印到PVDF膜上,用含5%脱脂牛奶的封闭液在室温下封闭1 h;采用PBS漂洗3次,每次5 min,再滴入一抗,摇床孵育,4℃过夜;PBS漂洗后滴加二抗,摇床室温孵育;暗室曝光并观察结果,以β-actin为内参,Image J软件分析条带灰度值。
1.7 统计学处理
采用SPSS 22.0进行统计学分析,对计量资料进行方差齐性和正态检验,各组数据资料采用x±s表示,并采用单因素方差分析(one-way ANOVA)分析实验结果及两两比较的SNK-q检验。
2 结果
2.1 BV-2细胞形态
正常状态下,BV-2细胞呈现出静息的形态特征,胞体较小,多呈圆形、椭圆形,偶见短小突起(图1 A1、B1)。LPS 刺激后,可见BV-2细胞出现激活特征变化:大部分细胞呈长梭形,胞体大,细胞核大而圆,核仁明显,胞体发出细而长的突起(图 1 A2、 B2)。加入干预的AH6809浓度在10、20、30、40 μmol/L时(图 1 A3、B3),部分细胞的长突起发生回缩,细胞体积变小、形态变圆(其中低浓度的10、20、30 μmol/L图未展示);当浓度逐渐升高至80 μmol/L时,观察到BV-2细胞的形态显著改变(图1 A4、B4),较多细胞的突起皱缩、变短,数量减少或者消失,外形趋于圆形,体积变小;当AH6809浓度达到160 μmol/L时(图1A5、B5),细胞轮廓模糊,染色质深染、碎裂,细胞密度降低,可见空泡状细胞。
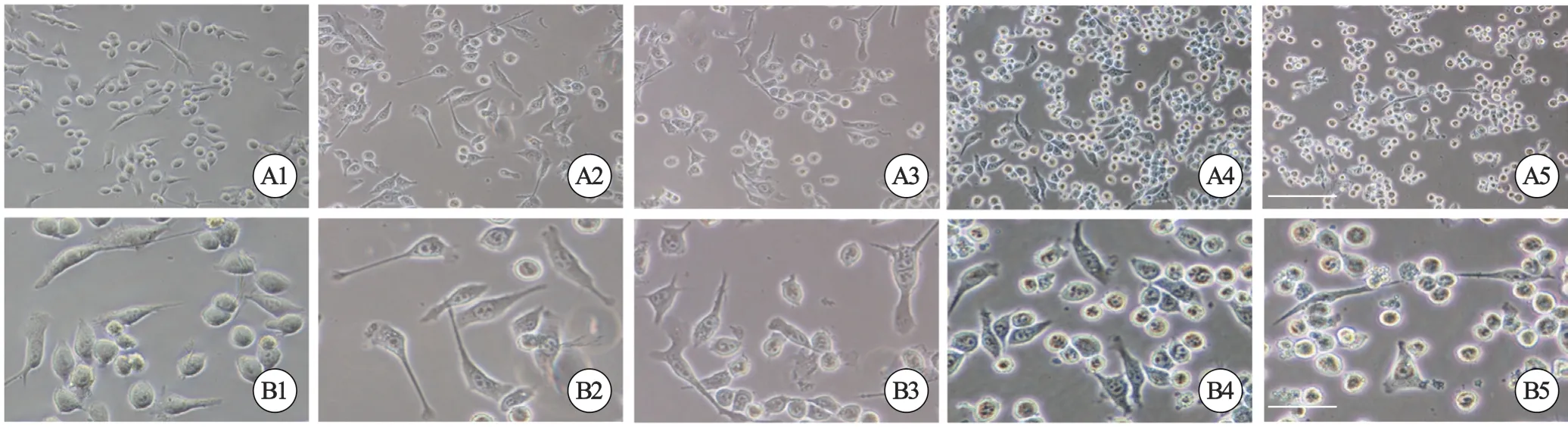
图1 倒置显微镜下BV-2细胞形态Fig 1 Morphological changes of BV-2 cells
2.2 BV-2细胞凋亡情况
BV-2细胞用绿色荧光进行标记,显示红色荧光则为凋亡细胞。结果表明,正常对照组和LPS组未见凋亡细胞(图2A1~A3, B1~B3,见封二)。LPS+AH6809(<80 μmol/L)组可见cleaved caspase 3阳性细胞,细胞大小、形态趋于正常,阳性染色主要位于细胞质(图2C1~C3,见封二),但随AH6809干预浓度上升至80 μmol/L,LPS+AH6809组BV-2细胞中cleaved caspase 3的形态变得不规则,出现细胞皱缩,突起变大、变粗,阳性染色深,且主要位于细胞质(图2D1~D3,E1-E3,见封二)。
TUNEL染色实验结果证实,正常对照组和LPS组未出现细胞凋亡(图3A1~A3, B1~B3,见封二)。AH6809≤40 μmol/L时,偶见极个别BV-2细胞凋亡(图3C1~C3,见封二)。AH6809≥80 μmol/L时,BV-2细胞的凋亡数目渐增,而当AH6809浓度达160 μmol/L时,大面积BV-2细胞发生凋亡(图3D1~D3, E1~E3,见封二)。提示凋亡BV-2细胞的增多与AH6809的浓度呈正相关。
从流式细胞结果图中观察到正常对照组和LPS组BV-2细胞无凋亡发生(图4A、B)。伴随AH6809浓度的上升,BV-2细胞的凋亡数上升(P<0.05)(图4G),即AH6809的浓度低于80 μmol/L时(图4C、D),BV-2细胞凋亡数目极少;AH6809浓 度 超 过80 μmol/L(含80 μmol/L)时,BV-2细胞凋亡数目增多明显(图4E);浓度达160 μmol/L时(图4F),BV-2细胞凋亡达高峰。
2.3 Cleaved caspase-3表达情况
免疫印迹检测结果显示,在AH6809干预浓度40 μmol/L时,cleaved caspase-3蛋白条带略开始出现,浓度达80 μmol/L时条带渐明显,浓度为160 μmol/L时条带最为明显(图5A)。通过对条带图进行灰度值测量和分析,与LPS组相比,当AH6809浓度在80 μmol/L以上时,差异开始有统计学意义(P<0.05)(图5B)。

蒋鸿雁等. EP受体拮抗剂AH6809对炎症导致的BV-2小胶质细胞凋亡的影响
3 讨论
小胶质细胞起源于神经外胚层,当CNS受到损害时,静息状态下的小胶质细胞会被激活,持续释放TNF-α、IL-1β和PGE2等炎症介质和细胞毒性物质,引发神经性炎症反应,继而损伤周围神经元,受损的神经元又会进一步诱导BV-2细胞的活化,导致神经性炎症进行性加重[12-13]。本研究通过倒置显微镜观察,正常状态下的BV-2细胞外形呈上皮细胞样,胞体和核较小,呈圆形,偶见有突起;LPS刺激后处于炎症状态的BV-2细胞,胞体肥大,核大而圆,长出分枝样突起;突起向细胞两极延长、呈纺锤样改变,同时出现BV-2细胞突起之间互相连接的现象,这与聂永慧等[14-15]对病理状态下BV-2细胞的形态学报道具有相似性。课题组前期研究结果显示,AH6809对BV-2细胞TNF-α、IL-1β表达具有抑制作用,AH6809有干预减轻炎症反应的效用[2]。本实验结果显示梯度浓度增高的AH6809在抑制LPS诱发的炎症反应中,BV-2细胞出现突起变短、变粗,细胞胞体变圆和变小等变化,和小鼠腹腔内注射LPS 1周后出现的小胶质细胞形态学变化近似[16],推测BV-2细胞形状的变化与AH6809减轻炎症反应有一定的联系。课题组前期研究显示,AH6809干预后TNF-α、IL-1β、mPGES-1等出现低表达, BV-2细胞发生类似于炎症反应减轻的形状转归,进一步推测可能与AH6809干预后炎症反应减轻有一定关系[2,8,17]。
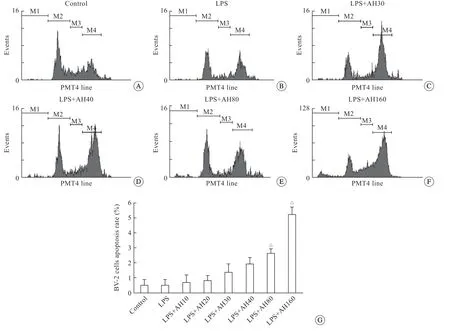
图4 流式细胞术检测对照组(A)、LPS组(B)和LPS + AH6809干预组(C~F)的BV-2细胞的凋亡率及其条形图(G)显示,随着AH6809浓度增加,凋亡率增加,△P<0.05 vs 对照组BV-2细胞Fig 4 The apoptosis rate of BV-2 cells in control group(A), LPS group(B) and LPS+AH6809 (C~F).Bar graph (G) showed the apoptosis rate of BV-2 cells increased following the increasing concentration of AH6809,△P<0.05 vs control group
同样,在前期研究中AH6809对BV-2细胞是否致凋亡的实验显示,AH6809在40 μmol/L以上时,BV-2细胞开始出现凋亡迹象;随着AH6809浓度的递增,凋亡的BV-2细胞呈现出逐渐增多的趋势,表现出浓度依赖性特征[21]。异常凋亡往往会诱发各种疾病,如自身免疫性疾病、神经退行性疾病和癌症等。而本研究利用BV-2细胞株,通过体外实验,探索BV-2细胞的凋亡对神经退行性疾病的影响和可能机制具有重要意义[22]。值得注意的是,本实验结果中,当AH6809抑制炎症反应的浓度<80 μmol/L时,镜下BV-2细胞中的cleaved caspase-3阳性细胞的大小、形态趋于正常,阳性染色主要位于胞质;当浓度≥80 μmol/L时,可见BV-2细胞变圆,胞质内溶酶体颗粒明显增多,胞质浓缩甚至最终消失,核内染色质深染、浓缩边聚,核仁裂解,核固缩等凋亡迹象出现;当浓度为160 μmol/L时,观察区域出现核溶解及大量空泡状细胞,以及与周围细胞分离等密集凋亡现象,这与谷氨酸诱导的BV-2细胞凋亡出现的细胞形态改变相似[18],说明伴随AH6809在抗炎时的干预浓度的升高也会导致BV-2细胞出现凋亡。类似地,用PGE2干预后,过氧化氢诱导人乳头瘤病毒E5转染的C-33A宫颈癌细胞凋亡减少,而AH6809使用后增加了细胞凋亡;此外,有研究报道用PGE2预处理人类白血病HL-60细胞,PGE2通过EP2激活Ras-Raf-ERK途径,清除ROS,增加细胞谷胱甘肽水平和降低脂质过氧化,抑制甲萘醌诱导的细胞凋亡,AH6809干预后,这种抑制作用受到逆转[19-20]。

图5 免疫印迹检测不同浓度AH6809干预后cleaved caspase-3蛋白的表达Fig 5 The expression of cleaved caspase-3 protein after different concentrations of AH6809 intervention was detected by Western blotting
以上研究均表明AH6809在不同的细胞研究中,会对细胞的凋亡产生一定的影响,但是出现细胞凋亡的浓度存在一定的差异[21]。本研究中,检测使用不同浓度的AH6809在抑制LPS诱发的炎症反应时,BV-2细胞的凋亡情况显示,仅当AH6809浓度≥80 μmol/L时,凋亡细胞数明显增加;当AH6809浓度达160 μmol/L时,可见大量凋亡细胞。因此推测,AH6809在抑制炎症反应的同时,随着浓度的增高会诱导BV-2细胞的凋亡,且当浓度≥80 μmol/L时,凋亡细胞数与浓度呈现出正相关增多的现象,而国外关于AH6809引起基质细胞22B和子宫内膜上皮细胞12Z凋亡的浓度为75 μmol/L[23-24]。于是有学者指出,采用LPS刺激二甲双胍处理RAW264.7小鼠巨噬细胞,评估它们对细胞增殖和细胞凋亡的影响,LPS可以强烈抑制AMP蛋白激酶激活,进而干扰其介导的细胞凋亡,推测与LPS抑制细胞周期,阻止细胞转移到sub-G1,达到抑制细胞凋亡[25]。而本实验中LPS诱发炎症后使用AH6809进行干预,其引起细胞出现凋亡的浓度也相对较高[21]。
综上所述,AH6809在体内外的应用中,有抑制炎症反应的作用,也在一定程度上对细胞有致凋亡影响,因此在使用AH6809抑制炎症反应的同时,需要考虑到AH6809浓度对细胞凋亡的影响。
图2 免疫荧光双标染色共聚焦图像显示BV-2细胞中cleaved caspase-3蛋白的免疫阳性表达,标尺=50 μm。A:对照组;B:LPS组;C:LPS+AH40组;D:LPS+AH80组;E:LPS+AH160组。A1~E1:不同分组细胞形态;A2~E2:cleaved caspase-3凋亡蛋白;A3~E3:Lectin标记的小胶质细胞与cleaved caspase-3融合,DAPI复染细胞核.
图3 BV-2细胞TUNEL染色显示LPS+AH6809增加TUNEL+细胞数(C2~E2)。TUNEL+细胞被标记为绿色,标尺=50 μm。A:对照组;B:LPS组;C:LPS+AH40组;D:LPS+AH80组;E:LPS+AH160组。A1~E1:不同分组细胞形态;A2~E2:TUNEL染色;A3~E3:DAPI复染细胞核.
Explanation of figures(see inside front cover)
Fig 2 Confocal images showing the immunoreactivities of cleaved caspase-3 protein in BV-2 cells by double-labeling immunofluorescence staining,bar=50 μm. A: Control group; B: LPS group; C: LPS+AH40 group; D:LPS+AH80 group; E: LPS+AH160 group. A1-E1: Cell morphology of different groups; A2-E2: Cleaved caspase-3 apoptotic protein;A3-E3: Lectin-labeled microglial cells were fused with cleaved caspase-3, and DAPI counterstained nuclei.
Fig 3 TUNEL staining of BV-2 cells showed that LPS+AH6809 increased the number of TUNEL+cells (C2-E2). TUNEL+cells were labeled green,bar=50 μm. A: Control group;B: LPS group; C: LPS+AH40 group;D: LPS+AH80 group; E: LPS+AH160 group. A1-E1: Cell morphology of different groups; A2-E2: TUNEL staining; A3-E3: DAPI counterstained nuclei.

