肿瘤恶液质病人肌肉减少的分子机制
朱明星 卢宗亮 吴长蓬 许红霞
据全球肿瘤流行病数据估计(GLOBOCAN 2018),2018年全球约有1 810万新增癌症病例和960万癌症死亡病例[1]。其中,亚洲癌症患病人数和死亡人数分别占全球病例的60%和70%。在我国,癌症同样是人口死亡的主要原因,也是重大的公共卫生问题。国家癌症中心提供的数据显示,2015年中国约新增429.2万癌症病例和281.4万癌症死亡病例[2]。
终末期癌症病人往往表现为极度消瘦、厌食、乏力、体能差甚至卧床,即出现恶液质(cachexia)状态。恶液质是肿瘤最常见的并发症之一,报道称80%左右的胃癌或胰腺癌,50%左右的结肠癌、肺癌或前列腺癌,以及约40%的乳腺癌病人随癌症进展会出现恶液质[3],约30%的癌症病人因恶液质死亡[4]。骨骼肌减少(muscle atrophy,MA)是恶液质的核心表现。恶液质的定义比较公认的是Fearon等[5]在2011年肿瘤恶液质国际大会专家共识中提出的:“以持续性骨骼肌丢失为特征,不能被营养支持完全缓解,逐步导致器官功能损害的多因素综合征”。除恶性肿瘤,多种慢性疾病,如COPD、CHF、慢性肾功能衰竭、艾滋病等到疾病后期均可发生肌肉减少及恶液质状态[6]。2008年在华盛顿召开的恶液质大会中,临床医师和研究人员对恶液质的诊断标准达成共识[7],即人体在无节食的情况下,6个月内体质量下降>5%;或BMI<20(我国<18.5)同时伴有体质量下降>2%;或四肢骨骼肌量指数(appendicular skeletal muscle index, ASMI)符合肌肉减少症标准(男性<7.0 kg/m2,女性<6.0 kg/m2-欧洲人群)及同时伴有体质量下降>2%。
世界肿瘤恶液质年会(International Society on Sarcopenia, Cachexia and Wasting Disorders Conference)截至2019年已举行11届,大会每年对肿瘤恶液质最新进展和热点问题进行探讨,其中对肿瘤恶液质病人肌肉减少的分子机制研究逐年增多。肌肉减少原因归结起来就是肌肉蛋白质降解增加与蛋白质合成受阻。研究显示,恶液质肌肉减少涉及的蛋白质合成的信号通路主要是PI3K/AKT/mTOR信号通路,而涉及的蛋白质降解通路主要包括AKT/FOXO3a通路、Myostatin/Activin A/B信号通路、炎症因子NF-κB通路、p38MAPK信号通路以及JAK-STAT通路等(图1)。
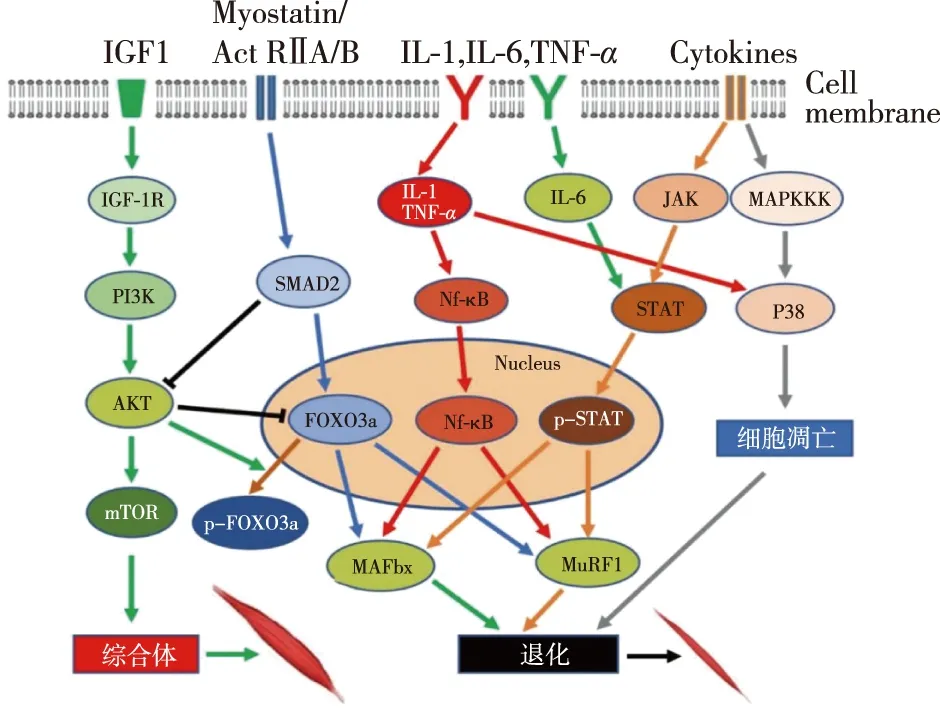
图1 肿瘤恶液质发生肌肉减少机制示意图
1 蛋白质合成PI3K/AKT/mTOR通路
磷脂酰肌醇3-激酶(phosphatidylinositol3-kinases,PI3Ks)是细胞内的一种磷脂酰肌醇激酶,参与多种细胞生命活动,如细胞生长、增殖、分化、运动、存活和物质转运等。PI3Ks的作用与致癌基因PIK3CA和抑癌基因PTEN密切相关[8]。
蛋白激酶B(protein kinase B, PKB)即AKT,是一种丝氨酸/苏氨酸特异性蛋白激酶,在多种细胞生长过程中发挥关键作用,如葡萄糖代谢、凋亡、细胞增殖、转录和细胞迁移。过表达AKT的转基因小鼠,其骨骼肌肌量明显增大,AKT相关信号通路被激活[9]。磷酸化的AKT可促进小G蛋白Rheb(Ras homology enriched in brain,Rheb)的正调控,从而促进Rheb集聚,激活哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)复合体。这一过程激活蛋白质翻译,进而增加骨骼肌细胞分化生长。mTOR与其他蛋白相结合,形成mTOR复合物1(mTORC1)和mTOR复合物2(mTORC2)2种不同的蛋白质复合物,他们调节不同的细胞过程,具有促进物质代谢,参与细胞凋亡、自噬的功能。
PI3K/AKT/mTOR通路主要与蛋白质的合成相关。该通路具体的分子途径是:PI3K-AKT经PI3K生成磷脂酰肌醇三磷酸(PIP3),进一步激活磷酸肌苷依赖性蛋白激酶-1(phosphoinositide dependent proteinkinase-1,PDK1),PDK1通过磷酸化激活AKT,使AKT定位于质膜,进一步激活αNF-κB激酶抑制剂(inhibitor of nuclear factor kappa-B kinase subunit alpha,IKK-α),IKK-α磷酸化激活mTORC2。
一些因子可以激活该通路,其中包括表皮生长因子(epidermal growth factor,EGF)、类胰岛素生长因子(insulin-like growth factors-1,IGF-1)、胰岛素和钙调蛋白(calcium modulated protein,CaM)等[10-12]。胰岛素或IGF-1与其受体相结合后,通过胰岛素受体底物(insulin receptor substrate-1,IRS-1)激活PI3K/AKT/mTOR信号通路,促进蛋白质的合成[13]。当细胞缺乏IGF-1或者发生胰岛素抵抗时,会抑制PI3K/AKT/mTOR通路,从而使真核翻译起始因子4E结合蛋白(eukaryotic translation initiation factor 4E-binding protein,4E-BP)和p70核糖体蛋白S6激酶(ribosomal protein S6 kinase beta-1,S6K1,也称p70S6K)下调,最终导致真核翻译起始因子(eukaryotic initiation factor 4E, eIF4E)和p70S6K等促进蛋白质合成相关过程受到抑制[13]。有研究显示,当小鼠被敲除胰岛素受体后,肌肉重量和功能下降的主要原因是蛋白合成受到抑制而非分解增加[14]。
2 肌肉AKT/FOXO信号通路
叉头因子O蛋白家族(forkhead box class O family,FOXO)是调节骨骼肌细胞平衡的重要分子,其中FOXO1和FOXO3是调节骨骼肌蛋白质降解的主要成员。AKT可以促进FOXO磷酸化,抑制FOXO核转位而阻止其转录,同时阻止E3连接酶上调,抑制蛋白水解系统激活,减少蛋白降解[15]。恶液质状态时,FOXO通路相关基因增加,促进病人的肌肉减少。动物实验研究显示,骨骼肌FOXO1转基因小鼠的Ⅰ型肌纤维基因表达下调、血糖控制受损,小鼠骨骼肌体积减小[16]。Milan等[17]发现,在肌肉减少过程中,FOXO转录网络通过调节泛素-蛋白酶体系统和自噬系统发挥作用。抑制FOXO的转录活性可抑制肌肉蛋白质的泛素化降解。在小鼠恶液质模型中,FOXO过度激活导致肌肉减少。有证据显示,抑制FOXO能够挽回肌肉损失[18]。
FOXO1和FOXO3在诱导转录泛素化酶肌肉环状指基因1(muscle ring finger1,MuRF1)和肌肉萎缩盒F基因(muscle atrophy F-box,MAFbx,Atrogin-1)的上调中发挥关键作用[19]。MuRF1和MAFbx是一种E3连接酶,为骨骼肌萎缩的蛋白标志物。肌蛋白在降解过程中,需要经过其泛素化后再被蛋白酶体降解。在去神经、糖皮质激素过量等条件下,MuRF1和MAFbx过度活化,引起恶液质[20]。MuRF1不仅能降解细肌丝中的肌动蛋白和肌钙蛋白相关成分,而且MuRF1和MAFbx还均参与了粗肌丝肌球蛋白重链相关成分的分解[21]。有研究显示,激活IGF-1/AKT/mTOR信号通路,能够抑制MuRF1和MAFbx等的活性,从而使蛋白酶体系统中E3泛素化连接酶活性下调。将IGF-1注入小鼠体内,可以激活AKT,然后磷酸化FOXO,导致MuRF1和MAFbx表达降低,减少肌肉降解[19,22]。
一项有趣的研究发现,过氧化物酶体增殖物激活受体γ辅激活子1α(peroxisome proliferator-activated receptor gamma coactivator 1-alph, PGC-1α)与AKT作用类似,能负调控FOXO的激活[22]。在荷瘤小鼠和肌肉萎缩的条件下,PGC-1α在血液和组织中的含量下降,而过表达PGC-1α则抑制FOXO3a的表达,逆转部分肌肉损失。同时,在运动过程中可以激活PGC-1α的表达。进一步研究发现,PGC-1α可调节肌纤维中线粒体的生物合成和氧化磷酸化[23]。在肿瘤恶液质中,肌肉萎缩针对的是Ⅱ型肌纤维,而Ⅰ型肌纤维并没有类似的降解[24]。这有可能是由于PGC-1α抑制Ⅰ型肌纤维中的FOXO3a活性所致。尝试寻找PGC-1α的激活剂可能是一种很有前景的、可以防止肿瘤或者其他分解代谢条件下的肌萎缩的方法。
3 Myostatin和激活素A/B信号通路
Myostatin又称肌肉生长抑制素,是较晚发现的在生物进化中极保守的转化生长因子-β(TGF-β)超家族成员,Myostatin主要由骨骼肌细胞合成和分泌,具有特异性抑制肌肉生成的作用,能诱导恶液质的发生[25]。Myostatin可有效抑制细胞周期由G1期向S期的过渡,使细胞生长速度显著变慢,细胞周期蛋白CyclinD1表达下调,从而抵制成肌细胞的增殖;同时骨骼肌分化标志肌细胞生成素(Myogenin)和主要组织相容性复合体(MHC)的表达也受Myostatin抑制,导致成肌细胞不能分化为多核的融合肌管细胞。小鼠过表达Myostatin可导致骨骼肌明显萎缩[26],相反,通过不同基因方法抑制Myostatin的表达可促进肌肉质量和肌纤维增大[27]。Myostatin的拮抗剂已被证明能够预防Lewis肺癌(Lewis lung carcinoma,LLC)小鼠模型中的肿瘤恶液质[28]。
除Myostatin外,激活素A/B (Activin A/B)作为TGF-β家族成员,可激活TNF-α/TAK1通路,在骨骼肌细胞中可发现Activin A上调[29],阻断该模型中的Activin A,可以逆转肌肉萎缩。TGF-β分子通常与激活素Ⅱ型受体(ActRⅡ)相结合,激活ActRⅡ通路中肌肉萎缩关键的泛素连接酶MAFbx/Atrogin1,增加MuRF1的表达,可增强肌肉蛋白的泛素化作用,从而导致肌原纤维蛋白降解[30-31]。ActRⅡ拮抗剂能完全抵消上述作用[32]。最近的研究显示,ActRⅡB受体拮抗剂可用于治疗4种不同小鼠模型的肿瘤恶液质。
因此,Myostatin主要通过ActRⅡB-SMAD2/3通路阻断骨骼肌分化增殖[33]。有趣的是,IGF-1可以显著逆转Myostatin对AKT的抑制[34]。但在肿瘤病人中,这显然是存在一定问题的,因为IGF-1可能与肿瘤的发生发展有关。骨骼肌的保存是通过阻断Myostatin和Activin A/B信号通路而实现的,但他并不一定是所有动物模型和人类发生肿瘤恶液质的原因。
4 炎症因子通路
肿瘤恶液质常伴有全身性慢性炎症状态,NF-κB、CRP、 IL-1、IL-6、TNF-α等炎症因子水平会有不同程度的升高。
NF-κB是肌肉萎缩中一种重要的转录因子,它参与细胞凋亡、炎症和分化等多种细胞生命活动[35],能被许多炎症因子所激活。研究发现,NF-κB可被TNF-α、TWEAK(TNF-related weak inducer of apoptosis)、IL-1、蛋白水解诱导因子(proteolysis inducing factor,PIF)、血管紧张素Ⅱ(AngⅡ)等通过活性氧簇诱导激活,激活的NF-κB能够促进Myostatin的表达增加,从而使肌肉分化生长因子(myogenic differentiation,MyoD)的mRNA表达下调,导致骨骼肌的生长与分化受阻,最终破坏肌肉组织的损伤修复[36]。IL-1能通过介导NF-κB和p38-MAPK信号通路,促进E3连接酶MuRF1和MAFbx基因的表达,进而使肌纤维蛋白发生泛素化降解[37]。TWEAK通过激活NF-κB而上调MuRF1,导致MyHC消耗增加[37]。NF-κB抑制剂可以通过抑制NF-κB通路减少MuRF1和MAFbx的表达,从而显著地降低肿瘤恶液质引起的肌肉萎缩[38]。
TNF-α由活化的巨噬细胞合成,可以诱导恶液质的发生[39]。在体外试验中,TNF-α可使脂肪细胞从血浆脂蛋白中摄取脂肪酸减少,抑制脂肪合成,同时抑制骨骼肌细胞的分化,并在一定程度上抵抗胰岛素,进而影响胰岛素信号通路[40]。加入TNF-α抑制PI3K/AKT通路,可以导致培养的肌细胞肌管萎缩,还可以通过NF-κB和p38-MAPK激活MuRF1等E3连接酶诱导泛素化-蛋白酶体途径,导致肌原纤维蛋白分解[41-43]。恶液质状态下,骨骼肌组织中是否存在先天免疫细胞很少被报道,因此,这些细胞也不太可能在肌肉组织环境中产生TNF-α。从这个角度来说,TNF-α与肿瘤恶液质的关系就不太清楚。最近的一项研究显示[44],对肿瘤恶液质病人使用TNF-α抗体抑制其功能后,恶液质并没有获得任何改善效果,在观察的浓度下,TNF-α可能是一种促进因子,但不足以促使肌肉组织萎缩,还需要其他肿瘤或炎症因子的协同作用。
IL-6是由活化的巨噬细胞产生的,是癌症恶液质全身炎症的驱动因子,多种肿瘤都会分泌IL-6[45]。IL-6可能是通过中枢神经系统引起恶液质,促进恶液质病人氧化应激的发生,抑制下丘脑脂肪酸氧化,从而引起食物摄入减少。中枢注入IL-6的拮抗剂可以改善病人食物摄入,但只有超生理剂量下的IL-6才能诱导无肿瘤或疾病状态下的肌肉萎缩[46]。在IL-6依赖的鼠恶液质模型中,肌蛋白合成的抑制在早期即发生,与正常对照组相比,C26荷瘤小鼠腓肠肌重量减轻到对照组的84%,蛋白水解酶的活性明显降低,说明溶酶体组织蛋白酶通路和ATP依赖性蛋白水解通路参与其中[47]。在IL-6诱导的肌肉萎缩过程中,IL-6是否直接调控E3连接酶的表达还具有一定争议。IL-6信号通路模式是通过信号转到受体形成的异质二聚体(gp130)和膜结合受体,激活JAK/STAT信号转导通路下游,导致信号传导及转录激活蛋白(STAT)磷酸化,进入细胞核调控基因的转录[48]。最近,在消瘦的肺癌病人中的试验显示,IL-6单克隆抗体可以逆转厌食、疲劳和贫血,但对体质量改善无明显影响[49]。
5 p38MAPK通路
肿瘤病人在形成恶液质的过程中,细胞对各种胞外调节信号作出特异性应答,除上述一些信号通路外,大多数细胞中还存在另外2条细胞因子通路途径:p38MAPK途径和JAK-STAT途径。2条途径独立存在于细胞内,共同进行信号转导。但有研究发现,丝裂原活化蛋白激酶(MAPK)可能是两者的关键分子,因为当JAK激活的同时,伴有MAPK的活化[50]。
p38MAPK最早因为与应激相关而引起研究者注意,后来发现它与多种肿瘤(包括宫颈癌、卵巢癌、肝癌、淋巴瘤)凋亡的启动、细胞周期的静止等密切相关。p38MAPK除介导炎症、凋亡外,还参与细胞存活、分化和发育等过程。TNF-α、IL-1和TWEAK能通过介导NF-κB和p38MAPK信号通路,促进E3连接酶MuRF1和MAFbx基因的表达,进而使肌纤维蛋白发生泛素化降解[37,51]。研究显示,阻断p38MAPK级联反应,可以减轻细胞的炎症反应[52]。在肿瘤细胞中,p38MAPK可增加TNF-α的表达,反过来,TNF-α也可以活化p38MAPK上游MAPKKK(MAP kinase kinase kinase),进而激活p38-MAPK,诱导凋亡[53]。
6 JAK-STAT通路
JAK-STAT信号途径是由Heim在研究干扰素诱导细胞内信号传导的过程中发现。当蛋白酪氨酸激酶(Janus activated kinase,JAK)与配体结合时,他们通过单个酪氨酸上的磷酸化激活STAT,促使STATs形成二聚体,然后转移到细胞核内,与目标基因启动子中的特定反应元件结合,并激活其转录[54]。有研究表明,STATs能调节与细胞增殖、分化、凋亡相关基因的表达。其下游基因的表达,能抑制肿瘤细胞的凋亡,促进其增殖分化,从而增强免疫逃避能力,促进肿瘤的发生发展及侵袭和转移的能力[55]。加入STAT3蛋白抑制剂能够阻断STAT与DNA相结合,进而抑制肿瘤细胞的分化、增殖与生长,促进其凋亡[56]。虽然JAK-STAT信号通路与肌肉减少直接相关的研究鲜有报道,但可以发现,抑制JAK-STAT信号通路,就可抑制肿瘤的生长、转移,促进其凋亡坏死,从而阻止病人发生肿瘤恶液质,防止肿瘤病人的肌肉减少。这为治疗肿瘤恶液质提供了方向,且已成为抗癌治疗研究的热点。

