AEG-1、HER2在胃癌组织中表达及与临床病理特征的相关性
黄勇 王静 鲍广建 伦增军 褚朋 支良


【摘要】 目的 探討胃癌组织中星形细胞上调基因-1(AEG-1)、人表皮生长因子受体-2(HER2)的表达情况及其与胃癌临床病理特征的相关性。方法 47例胃癌患者为研究对象, 另随机选取其中18例,取距肿瘤5 cm以上的癌旁胃组织作为对照组。采用免疫组织化学方法、反转录-聚合酶链反应(RT-PCR)及荧光原位杂交技术(FISH)检测所有患者AEG-1、HER2表达情况。比较胃癌组织及癌旁胃组织中AEG-1、HER2、AEG-1 mRNA表达情况;分析胃癌组织中HER2基因扩增情况;胃癌组织中AEG-1、HER2的表达与临床病理特征的关系;分析在胃癌组织中AEG-1 mRNA表达与HER2基因扩增表达, AEG-1表达与HER2表达的相关性。结果 AEG-1在胃癌组织中的阳性表达率为74.47%(35/47), 明显高于癌旁胃组织的0;HER2在胃癌组织中的阳性表达率为38.30%(18/47), 明显高于癌旁胃组织的0, 差异均具有统计学意义(P<0.05)。采用FISH技术检测到胃癌组织中HER2基因扩增9例, HER2基因扩增率为19.15%(9/47)。RT-PCR检测胃癌组织中AEG-1 mRNA表达水平(0.702±0.123)显著高于癌旁胃组织的(0.244±0.111), 差异具有统计学意义(P<0.05)。胃癌组织中不同分化程度、TNM分期及淋巴结转移患者的AEG-1 mRNA表达阳性情况比较, 差异均具有统计学意义(P<0.05), 分化程度越低、TNM分期越晚、有淋巴结转移, 其阳性表达越高。胃癌组织中不同分化程度患者的HER2基因扩增情况比较, 差异具有统计学意义(P<0.05), 分化程度越高, 其基因扩增率越高。胃癌组织中AEG-1 mRNA表达与HER2基因扩增无相关性(P>0.05)。胃癌组织中免疫组化AEG-1表达与HER2表达呈正相关(r=0.361, P=0.033<0.05)。结论 胃癌组织中可能存在AEG-1、HER2信号通路, 检测胃癌组织中AEG-1、HER2的表达, 有助于判断胃癌的发生、发展、浸润、转移。
【关键词】 星形细胞上调基因-1;人表皮生长因子受体-2;胃癌;病理学特征
DOI:10.14163/j.cnki.11-5547/r.2020.22.002
The expression of AEG-1 and HER2 in gastric cancer tissue and its correlation with clinical-pathological features HUANG Yong, WANG Jing, BAO Guang-jian, et al. Department of General Surgery, Zaozhuang Municipal Hospital, Zaozhuang 277100, China
【Abstract】 Objective To discuss the expression of astrocyte elevated gene-1 (AEG-1) and human epidermal growth factor receptor2 (HER2) in gastric cancer tissue and its correlation with clinical-pathological features. Methods There were 47 cases of gastric cancer as study subjects, of which 18 cases were randomly selected, and the adjacent gastric tissues more than 5 cm from the tumor were used as the control group. The expression of AEG-1 and HER2 was detected by immunohistochemistry, reverse transcription polymerase chain reaction (RT-PCR) and fluorescence in situ hybridization (FISH). The expression of AEG-1, HER2, AEG-1 mRNA expression in gastric cancer tissues and adjacent gastric cancer tissues was compared. HER2 gene amplification in gastric cancer tissues, and the correlation between the expression of AEG-1 and HER2 in gastric cancer tissues and clinical-pathological features was analyzed. The correlation between AEG-1 mRNA expression and HER2 gene amplification expression, AEG-1 expression and HER2 expression in gastric cancer tissues was analyzed. Results The positive expression rate of AEG-1 in gastric cancer tissue was 74.47% (35/47), which was significantly higher than that of tissue adjacent to gastric cancer 0. The positive expression rate of HER2 in gastric cancer tissue was 38.30%(18/47), which was significantly higher than that of tissue adjacent to gastric cancer 0, and the difference was statistically significant (P<0.05). There were 9 cases of HER2 gene amplification in gastric cancer tissues detected by FISH technique, and the HER2 gene amplification rate was 19.15% (9/47). According to RT-PCR, the expression of AEG-1 mRNA (0.702±0.123) in gastric cancer tissues was significantly higher than that in tissues adjacent to gastric cancer (0.244±0.111), and the difference was statistically significant (P<0.05). Compared with the positive expression of AEG-1mRNA in patients with different degrees of differentiation, TNM stages and lymph node metastasis in gastric cancer tissues, the differences were statistically significant (P<0.05). The lower the degree of differentiation, the later the TNM stage and the lymph node metastasis, the higher the positive expression. Comparison of HER2 gene amplification in patients with different degrees of differentiation in gastric cancer tissues, the difference was statistically significant (P<0.05). The higher the differentiation degree, the higher the gene amplification rate. There was no correlation between AEG-1 mRNA expression and HER2 gene amplification in gastric cancer tissues (P>0.05). The expression of immunohistochemical AEG-1 was positively correlated with the expression of HER2 in gastric cancer tissue, and the difference was statistically significant (r=0.361, P=0.033<0.05). Conclusion There may be AEG-1 and HER2 signaling pathway in gastric cancer tissue. Detecting the expression of AEG-1 and HER2 in gastric cancer tissues helps judgment the occurrence, development, invasion and metastasis of gastric cancer.
【Key words】 Astrocyte elevated gene-1; Human epidermal growth factor receptor-2; Gastric cancer; Pathological features
我国胃癌有早期胃癌约占10%、进展期病例较多、发病率和病死率高等特点[1]。星形细胞上调基因-1(astrocyte elevated gene-1, AEG-1), 即异粘蛋白(metadherin, MTDH), 当前不仅成为多种恶性肿瘤潜在的关键调节基因, 还是复杂癌基因信号通路的关键交汇点[2]。HER2是表皮生长因子受体家族中的成员, 既往研究表明HER2 在多种癌症的发生、发展中起作用[3]。2010年ToGA试验[4]采用曲妥珠单抗联合化疗治疗提高了HER2 阳性的晚期胃癌和胃食管连接部腺癌患者的生存期。胃癌组织中AEG-1表达情况的相关研究不多[5-7], 国内外AEG-1、HER2在胃癌组织中表达及其信号通路的研究很少见。本研究应用免疫组织化学方法、RT-PCR及FISH检测AEG-1、HER2在胃癌组织中表达及其与胃癌临床病理特征的相关性, 探讨AEG-1与HER2在胃癌组织中表达的相关性。
1 资料与方法
1. 1 一般资料 选取2018年5月~2019年11月在山东省枣庄市立医院普通外科住院手术, 并且术后病理证实为胃癌患者47例为研究对象。男25例, 女22例;年龄32~78岁;高及中分化腺癌19例、低及未分化腺癌28例;依据TNM分期(2018年AJCC胃癌TNM分期, 第8版)其中Ⅰ期及Ⅱ期17例、Ⅲ期30例。入选患者术前均未接受化疗或放疗, 均排除其他肿瘤, 均未长期口服非甾体类消炎药及糖皮质激素;患者所有的临床病理资料全面无缺失。所有患者中随机选取18例, 取距肿瘤5 cm以上的癌旁胃组织作为对照组。所有患者术后接受至少4个周期的FOLFOX或XELOX方案化疗, FISH检测HER2阳性患者接受赫赛汀联合化疗。新鲜标本经10%甲醛固定, 石蜡包埋, 厚4 ?m连续切片。
1. 2 试剂 兔抗人AEG-1抗体及兔抗人HER2抗体均购自英国Abcam公司。HER2基因检测试剂盒购自中山大学达安基因股份有限公司。AEG-1及GAPDH引物由上海生工生物工程公司合成, 两步法RT-PCR试剂盒和PCR试剂购自普洛麦格公司。
1. 3 方法
1. 3. 1 免疫组织化学染色 免疫组织化学染色sp方法检测胃癌组及对照组中AEG-1、HER2的表达, 依照试剂盒的说明书实施染色。采用已知的AEG-1及HER2染色阳性的胃癌组织作为阳性对照, 以磷酸缓冲盐溶液(PBS)代替一抗作为阴性对照。由两位病理医师采用双盲法对切片进行观察, 每张切片随机选取5个(×400倍)高倍视野, 每个视野计数100个细胞。AEG-1染色阳性为细胞质呈棕黄色着染, 评分结果为染色指数(阳性细胞比例×染色强度), 其中染色指数得分为0~2为阴性表达, 3~9为阳性表达[6]。参照中国《胃癌HER2检测指南》[8]进行HER2结果判断:HER2以细胞膜出现棕黄色颗粒为阳性表达, 随机选取5个视野(×200倍), 每个视野计数100个细胞, 其中(-)为细胞膜均无着色或≤10%细胞的细胞膜呈淡黄色;(+)为>10%细胞的细胞膜呈淡黄色或有隐约可见的膜染色, 并且染色间断, 未包绕细胞膜;(2+)为>10% 细胞的细胞膜呈黄色或棕黄色, 且染色连续, 包绕细胞膜;(3+)为>10% 细胞的细胞膜呈深棕色, 并且染色连续, 包绕细胞膜。
1. 3. 2 FISH法检测HER2基因扩增 详细操作步骤及判读标准见说明书, 由病理医师选定的检测区域在蜡块上做标记, 石蜡切片, 65℃下烤片1 h;采用二甲苯室温脱蜡, 应用逐级酒精水化, 超纯水浸泡3 min, 采用沸水煮片20 min;蛋白酶K反应液覆盖组织, 37℃下消化5 min, 通过 2×SSC 缓冲液, 逐级酒精脱水;应用探针杂交液覆盖组织, 盖上盖玻片, 采用橡皮胶水封边, 85℃下变性5 min, 37℃下避光杂交过夜;孵育后, 通过2×SSC 缓冲液, 通过0.1% NP-40/2×SSC缓冲液, 采用70%乙醇脱水3 min, 滴加DAPI染液, 加盖盖玻片, 应用荧光显微镜观察计数, 结果判读采用参考文献方法[9]。
1. 3. 3 RT-PCR检测AEG-1 mRNA表达 石蜡切片样品含有足够比例的肿瘤细胞, 采用Trizol法提取组织总RNA, 随后紫外分光光度计检测RNA的浓度和纯度, 取A260/A280比值为1.9~2.2的样品1 ?g, 按两步法RT-PCR试剂盒说明书逆转录为cDNA, -20℃保存备用。参照试剂盒说明书配制聚合酶链式反应(PCR)体系, 得到产物采用1.5%琼脂糖凝胶电泳, 应用GAPDH做内参, 采用Image Lab 4.0分析PCR结果, AEG-1的mRNA表达相对值=AEG-1基因灰度值(T)/GAPDH灰度值(N)。PCR引物情况如下, AEG-1:上游引物5-GGC AAT TGG GTA GAC GAA GA-3, 下游引物5-CCTGTT TTG GAC GGG TTT TA-3;GAPDH:上游引物5-TCT TCG CTT TGT CCT TTC GT-3, 下游引物5-TGC TGT AGC CAA ATT CGT TG-3。PCR反应条件如下:94℃变性1 min, 55℃退火30 s, 72℃延伸1 min, 30個循环后72℃延伸2 min。AEG-1 mRNA在胃癌组织的条带灰度值高于癌旁胃组织时为表达阳性。
治疗后进行随访, 采用上门或电话问答等进行(包括患者饮食、睡眠等一般状况和复发、转移的情况), 直至患者死亡, 若末次随访仍然存活则定为截尾值。随访截止时间2020年1月, 其中47例胃癌患者中无死亡病例。
1. 4 观察指标 比较胃癌组织及癌旁胃组织中
AEG-1、HER2、AEG-1 mRNA表达情况;分析胃癌组织中HER2基因扩增情况;胃癌组织中AEG-1、HER2的表达与临床病理特征的关系;分析在胃癌组织中AEG-1 mRNA表达与HER2基因扩增表达, AEG-1表达与HER2表达的相关性。
1. 5 统计学方法 采用SPSS16.0统计学软件处理数据。计量资料以均数±标准差( x-±s)表示, 采用t检验;计数资料以率(%)表示, 采用χ2检验;相关性检验采用Spearman等级相关分析法。P<0.05表示差异有统计学意义。
2 结果
2. 1 胃癌组织及癌旁胃组织中AEG-1及HER2表达情况比较 AEG-1在胃癌组织中的阳性表达率为74.47%(35/47), 明显高于癌旁胃组织的0;HER2在胃癌组织中的阳性表达率为38.30%(18/47), 明显高于癌旁胃组织的0, 差异均具有统计学意义(P<0.05)。见表1。
2. 2 胃癌组织中HER2基因扩增情况 采用FISH技术检测到胃癌组织中HER2基因扩增9例, HER2基因扩增率为19.15% (9/47), 免疫组化结果情况如下:HER2(3+)6例, 基因扩增6例;HER2(2+)7例, 基因扩增3例;HER2(+)5例, 基因扩增0例;HER2(-)29例, 基因扩增0例。
2. 3 RT-PCR检测胃癌组织和癌旁胃组织AEG-1 mRNA表达情况比较 应用RT-PCR检测胃癌组织和癌旁胃组织中AEG-1 mRNA表达结果提示, 胃癌组织中AEG-1 mRNA阳性表达35例。胃癌组织中AEG-1 mRNA表达水平(0.702±0.123)显著高于癌旁胃组织的(0.244±0.111), 差异具有统计学意义(P<0.05)。见表2。
2. 4 胃癌组织中AEG-1 mRNA表达、HER2基因扩增与临床病理特征的关系分析 胃癌组织中不同分化程度、TNM分期及淋巴结转移患者的AEG-1 mRNA表达阳性情况比较, 差异均具有统计学意义(P<0.05), 分化程度越低、TNM分期越晚、有淋巴结转移, 其阳性表达越高, 但AEG-1 mRNA表达与胃癌的年龄、肿瘤大小、肿瘤部位、浸润深度无关, 差异无统计学意义(P>0.05)。胃癌组织中不同分化程度患者的HER2基因扩增情况比较, 差异具有统计学意义(P<0.05), 分化程度越高, 其基因扩增率越高, 但HER2基因扩增与患者的年龄、肿瘤大小、肿瘤部位、浸润深度、TNM分期、淋巴结转移无关, 差异无统计学意义(P>0.05)。见表3。
2. 5 胃癌组织中AEG-1 mRNA及HER2基因扩增表达的相关性分析 胃癌组织中AEG-1 mRNA表达与HER2基因扩增无相关性(P>0.05)。见表4。
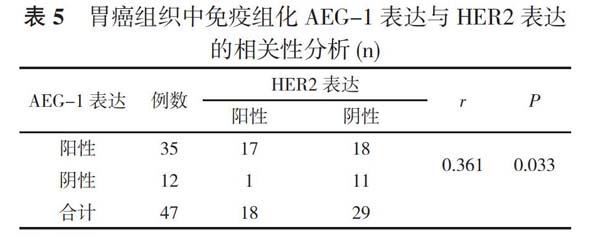
2. 6 胃癌组织中免疫组化AEG-1表达与HER2表达的相关性分析 胃癌组织中免疫组化AEG-1表达与HER2阳性表达呈正相关(r=0.361, P=0.033<0.05)。见表5。
3 讨论
采用免疫组织化学方法、RT-PCR及FISH检测AEG-1、HER2在胃癌组织中表达, 研究其与胃癌临床病理特征的关系, 并探讨AEG-1与HER2在胃癌组织中表达的相关性。
首先Su等[10]于2002年克隆出来AEG-1基因, 后来Kang等[11]测定AEG-1基因共包含12个外显子和11个内含子, 编码由582个氨基酸组成的单次跨膜蛋白。众多研究表明AEG-1可以在肿瘤的多个方面发挥关键作用, 并且AEG-1在多种恶性肿瘤中高表达, 还与这些肿瘤的进展以及临床不良预后相
关[12]。曾有研究提示AEG-1在胃癌组织中高表达, 其表达与肿瘤分化程度、临床分期、淋巴结转移有关[6]。但伊朗的研究提示, 胃癌肿瘤组AEG-1基因的表达仅比配对的非肿瘤组表达稍高, 并且其表达与肿瘤分期、分级无关[7]。本研究显示胃癌组织中不论是采用免疫组化还是RT-PCR检测AEG-1表达, 其阳性表达率均明显高于癌旁胃组织, 而且其阳性表达与分化程度、TNM分期、淋巴结转移有关, 差异均具有统计学意义(P<0.05)。本研究结果与既往Xu等[5]研究结果类似, 因此认为AEG-1可能参与了胃癌的发生、发展, 对胃癌的转移有推动作用。将来还有待于大样本、多中心研究及细胞水平研究, 来进一步证实胃癌中AEG-1的重要作用。
HER2属于原癌基因, 是HER2/erbB家族成员, 其定位在染色体17q12, 编码产物为Ⅰ型跨膜生长因子受体酪氨酸激酶[13]。HER2在乳腺癌、胃癌细胞中可以异常扩增和(或)过表达, 可以导致肿瘤细胞内信号通路的异常活化, 并且与肿瘤的发生、发展和侵袭、转移有关[14]。本研究表明HER2在胃癌组织中的阳性表达率为38.30%(18/47), 明显高于癌旁胃组织的0, 并且HER2基因扩增与分化程度有关, 差异均具有统计学意义(P<0.05)。但其与浸润深度、TNM分期、淋巴结转移无关。这与既往研究结果[15]类似, 但又有不同, 可能与研究样本量、病例临床分期不同等有关, 本研究显示HER2参与了胃癌发生、发展及浸润、转移过程。
既往研究表明, AEG-1/MTDH在乳腺癌细胞中通过上调Her2/neu表达促进癌症增殖和侵袭[16]。本研究显示胃癌組织中AEG-1 mRNA表达与HER2基因扩增无相关性(P>0.05)。胃癌组织中免疫组化AEG-1表达与HER2表达呈正相关(r=0.361, P=0.033<0.05)。可能与研究样本量、临床分期等因素有关, 推测胃癌组织中AEG-1可能通过上调HER2信号通路改变胃癌的发生、发展、浸润及转移, 但还需要胃癌细胞水平研究进一步揭示具体机制。
综上所述, 胃癌组织中AEG-1、HER2表达明显高于癌旁胃组织, 并且与胃癌的临床病理特征相关。胃癌组织中可能存在AEG-1、HER2信号通路。检测胃癌组织中AEG-1、HER2的表达, 有助于判断胃癌的发生、发展及浸润、转移。
参考文献
[1] 季加孚. 我国胃癌防治研究三十年回顾. 中国肿瘤临床, 2013, 40(22):1345-1351.
[2] Emdad L, Sarkar D, Su ZZ, et al. Astrocyte elevated gene-1: recent insights into a novel gene involved in tumor progression, metastasis and neurodegeneration. Pharmacol Ther, 2007, 114(2):155-170.
[3] 唐焕, 尹晓玲, 张献全. HER2与胃癌预后的研究进展. 现代医药卫生, 2018, 34(10):1522-1525.
[4] Bang YJ, Van Cutsem E, Feyereislova A, et al. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2 -positive advanced gastric or gastro-oesophageal junction cancer (To-GA): a phase 3, open-label, randomised controlled trial. Lancet, 2010, 376(9742):687-697.
[5] Xu JB, Wu H, He YL, et al. Astrocyte-elevated gene-1 overexpression is associated with poor prognosis in gastric cancer. Med Oncol, 2011, 28(2):455-462.
[6] 刘凯军, 李勇, 王文韬. 胃癌组织中AEG-1的表达及与临床病理特征的关系研究. 河北医药, 2012, 34(5):653-655.
[7] Baygi ME, Nikpour P. Deregulation of MTDH gene expression in gastric cancer. Asian Pac J Cancer Prev, 2012, 13(6):2833-2836.
[8] 《胃癌HER2检测指南(2016版)》专家组. 胃癌HER2检测指南(2016版). 中华病理学杂志, 2016, 45(8):528-532.
[9] Tafe LJ, Steinmetz HB, Allen SF, et al. Rapid fluorescence in situ hybridisation (FISH) for HER2 (ERBB2) assessment in breast and gastro-oesophageal cancer. J Clin Pathol, 2015, 68(4):306-308.
[10] Su ZZ, Kang DC, Chen Y, et al. Identification and cloning of human astrocyte genes displaying elevated expression after infection with HIV-1 or exposure to HIV-1 envelope glycoprotein by rapid subtraction hybridization, RaSH. Oncogene, 2002, 21(22):3592-3602.
[11] Kang DC, Su ZZ, Sarkar D, et al. Cloning and characterization of HIV-1-inducible astrocyte elevated gene-1, AEG-1. Gene, 2005, 353(1):8-15.
[12] Huang Y, Li LP. Progress of cancer research on astrocyte elevated gene-1/Metadherin (Review). Oncol Lett, 2014, 8(2):493-501.
[13] 中國临床肿瘤学会抗肿瘤药物安全管理专家委员会, 中国抗癌协会胃癌专业委员会, 中国抗癌协会肿瘤病理专业委员会. HER2阳性晚期胃癌分子靶向治疗的中国专家共识(2016版). 临床肿瘤学杂志, 2016, 21(9):831-839.
[14] Korkaya H, Paulson A, Iovino F, et al. HER2 regulates themammary stem/progenitor cell population driving tumorigenesisand invasion. Oncogene, 2008, 27(47):6120-6130.
[15] 阿娜尔古丽·阿布都热合曼, 迪丽努尔·阿西木. 胃癌组织中Akt2、HER2蛋白表达与临床病理学特征的关系. 实用癌症杂志, 2015, 30(12):1767-1770.
[16] Zhang X, Zhang N, Zhang MX. Astrocyte elevated gene-1 induces breast cancer proliferation and invasion through upregulating HER2/neu expression. Chin Med J (Engl) 2011, 124(21):3546-3550.
[收稿日期:2020-02-19]

