氮掺杂氧化锌的制备及其催化高氯酸铵热分解性能研究①
王景风,李 杨,王小涛,吴晓宏
(哈尔滨工业大学 化工与化学学院,哈尔滨 150001)
0 引言
随着航天技术的不断进步,固体推进剂的高能化成为必然趋势[1]。高氯酸铵(Ammonium Perchlorate,AP)因具有氧化性强、有效含氧量高、气体生成量大、成本低廉以及与其他组分相容性好等诸多优点,而成为固体推进剂中常用氧化剂,含量高达70%以上,且其热分解性能与推进剂能量等性能密切相关[2-4]。研究表明,降低AP热分解温度和增加放热量等是提高推进剂能量性能的关键,而目前添加燃烧催化剂是提高AP热分解性能的有效方法之一[5-6]。
在众多燃烧催化剂中,氧化锌(ZnO)材料具有催化活性高、化学稳定性好和制备成本低廉等优点,使其在推进剂领域内表现出一定的应用前景[4-7]。为改善ZnO材料的催化活性,从微观结构设计(分级结构[7-8]、晶面控制[4])到材料组成设计(元素掺杂[9-10]、半导体复合[11]、贵金属修饰[12]、碳材料复合[13])的研究均有报道。如2015年,Tian等[7]采用简单的无模板低温湿化学方法制备了由纳米棒组装而成的分级ZnO中空微球,发现这些ZnO中空微球具有更好的催化活性; 2018年,Bu等[11]制备了花状ZnO@Fe2O3复合材料,二者协同作用进一步提高了其对AP热分解反应的催化性能;2019年,Jagtap R M等[9]采用共沉淀法合成了掺镧量为0~1.00%的La-ZnO,由于La掺杂后其比表面积的减低,导致其催化性能相较于ZnO稍有降低。然而,在光催化和气敏等领域内,元素掺杂是提高其性能的有效方法之一,这是因为金属或非金属原子掺杂进入材料晶格中后,微量杂原子便可引起材料内部缺陷种类和数量的巨大改变以及表面态密度的变化,有利于反应物吸附和活化,进而提高了催化性能[14]。但ZnO存在掺杂不对称问题,即n型掺杂容易实现,p型掺杂的实现较为困难[15];而氮(N)因具有与氧(O)原子相近的尺寸、较小的电离能、较浅的NO受主能级等特点,而被认为是ZnO实现p型掺杂的最佳优选元素[16-18]。
目前,N-ZnO的制备方法有金属有机化学气相沉积、磁控溅射、水热法等,且在制备过程中N源的选择尤为重要,常用N源有N2、NH3、NO、N2O和尿素等[17]。2-甲基咪唑(C4H6N2)作为一种含N源,可在甲醇溶液中去质子化反应并通过N与Zn(Ⅱ)的配位成键作用合成沸石咪唑类骨架化合物(ZIF-8)[19],同时2-甲基咪唑的弱碱性又能在水溶液中水解产生OH-,可用于合成ZnO[20-21]。因此,本文选择2-甲基咪唑为N源和碱源,利用水-甲醇双溶剂热法一步制备出稳定的N-ZnO,进而探究N-ZnO对AP热分解反应的催化作用。
1 实验
1.1 试剂与仪器
试剂:硝酸锌(Zn(NO3)2·6H2O)、高氯酸铵(NH4ClO4),分析纯,国药集团化学试剂有限公司;2-甲基咪唑(C4H6N2),分析纯,上海阿拉丁生化科技股份有限公司;甲醇(CH3OH),分析纯,天津富宇精细化工有限公司。
仪器:德国蔡司公司Merlin Compact型场发射扫描电镜(FE-SEM);美国FEI公司Tecnai G2 F30型场发射高分辨透射电镜(TEM);荷兰Panalytical分析仪器公司 Empyrean-X 射线衍射仪(XRD);美国Thermo Fisher公司ESCLAB 250Xi型X射线光电子能谱仪(XPS);美国赛默飞世尔公司Nicolet is50型傅里叶变换红外光谱(FT-IR);日立U-4100型紫外可见分光光度计(UV-Vis DRS);美国TA仪器公司SDT Q600型同步热分析仪(TG-DSC)。
1.2 ZIF-8、氮掺杂ZnO及纯ZnO的制备
(1) ZIF-8的制备
将0.63 g Zn(NO3)2·6H2O和0.346 9 g 2-甲基咪唑溶于30 ml甲醇溶液,搅拌至完全溶解后,转移至50 ml反应釜中,并在100 ℃下反应12 h。
(2) 氮掺杂ZnO的制备
将0.63 g Zn(NO3)2·6H2O和0.346 9 g 2-甲基咪唑溶于30 ml甲醇与水混合溶液中,体积比分别为2∶1和1∶2,搅拌至完全溶解后,转移至50 ml反应釜中,并在100 ℃下反应12 h。
(3) ZnO的制备
将0.63 g Zn(NO3)2·6H2O和0.296 9 g 六亚甲基四胺(HMTA)溶于30 ml水溶液中,搅拌至完全溶解后,转移至50 ml反应釜中,并在100 ℃下反应12 h。
上述反应结束后,产物均经无水乙醇离心洗涤3次后,置于真空干燥箱中,在80 ℃下干燥12 h,以得到目标产物。
1.3 催化剂/AP复合粒子的制备
取一定量的 AP 于研钵中,加入少量无水乙醇后充分研磨,之后按照3∶97的催化剂与AP质量比加入催化剂材料,继续研磨。待催化剂材料和AP混合均匀后,80 ℃真空干燥24 h,即得到催化剂/AP复合粒子。
1.4 催化AP热分解性能测试
采用美国TA SDT Q600型同步热分析仪(TG-DSC)对AP的热分解性能以及催化AP热分解性能进行测试,测试条件为:试样3 mg左右、升温速率10 ℃/min,氮气气氛,流量100 mL/min,温度范围室温~500 ℃,加盖氧化铝坩埚。通过分析其差示扫描量热(Differential Scanning Calorimetry,DSC)、热重(Thermogravimetry,TG)和微商热重(Derivative Thermogravimetry,DTG)曲线,可获得AP热分解反应基本数据:低温分解峰温、高温分解峰温、表观分解热、起始分解温度、终止分解温度以及最大失重温度。
2 结果与讨论
2.1 微观结构及组成表征
图1为不同条件下所制备材料的XRD谱图。由图1(a)可见,甲醇溶液中所制备材料的XRD谱图于7.3°、10.4°、12.7°、14.7°、16.4°、18.0°等处有明显的晶体衍射峰,且这些峰位置、峰型及相对强度与ZIF-8的理论谱图相吻合[19],由此可证明纯相ZIF-8的成功制备。但在甲醇-水双溶剂中,XRD谱图中隶属于ZIF-8的衍射峰完全消失,位于31.7°、34.4°、36.3°、47.4°处的衍射峰与纯ZnO及ZnO标准谱图(PDF#79-2205)相吻合,分别对应于ZnO(100)、(002)、(101)、(102)晶面[22]。
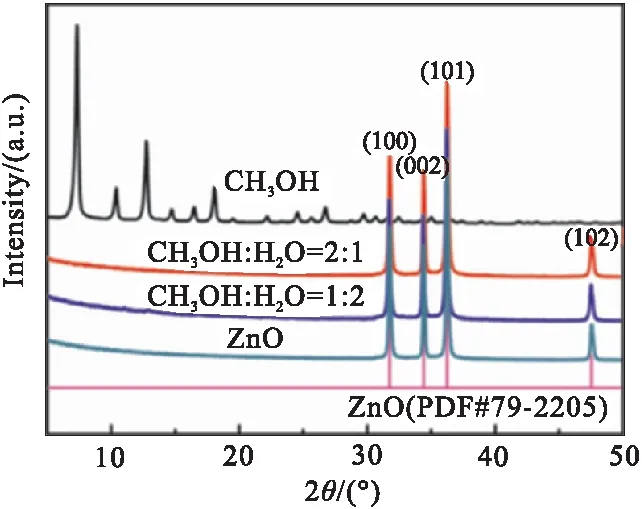
(a)XRD patterns
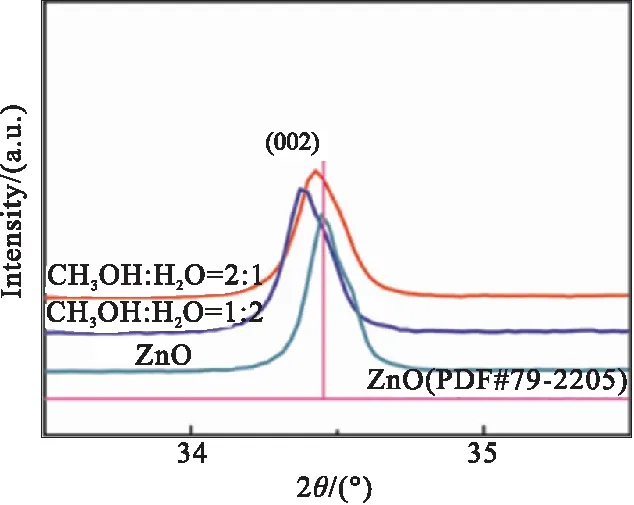
(b)Bragg angle shift of (002) peak图1 不同条件所制备材料的XRD图Fig.1 XRD patterns of materials prepared under different conditions
为进一步分析不同条件下所制备ZnO的晶体结构,放大ZnO位于33.5°~35.5°范围内的衍射峰,如图1(b)所示,发现在甲醇-水双溶剂中所制备ZnO的衍射峰均向低衍射角方向移动,其中在甲醇与水体积比为1∶2时,(002)晶面由34.42°移动至34.37°处,移动了0.05°。该结果与Ye等[23]以NO为氮源、采用CVD法所制备N掺杂ZnO的研究结果一致,(002)晶面在氮掺杂下向低衍射角方向移动。因此,文中将这种微小位移归因于N掺入ZnO晶格引起的微小拉伸应力[17-23]。
图2为在甲醇溶剂中所制备ZIF-8、ZnO和在甲醇-水体积比为1∶2时所制备N-ZnO的SEM和SAED图。

(a)SEM image of ZIF-8 (b)SEM image of ZnO (c)SAED images of ZnO

(d)SEM image of N-ZnO (e)TEM images of N-ZnO (f)SAED image of N-ZnO图2 不同条件下所制备ZIF-8、ZnO和N-ZnO的微观形貌图Fig.2 Micro graphs of ZIF-8,ZnO and N-ZnO prepared under different conditions

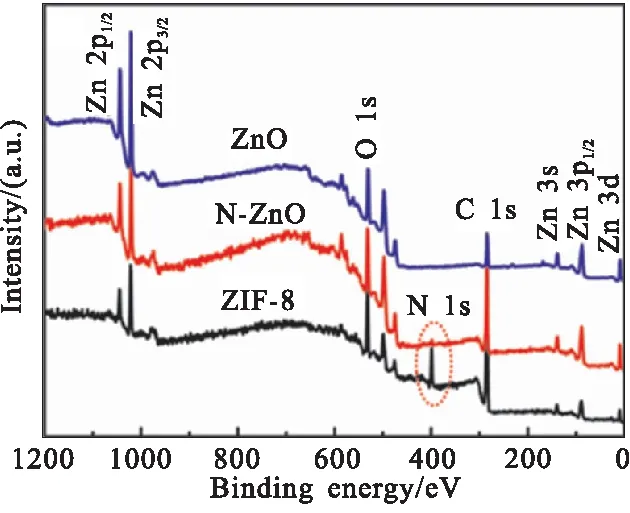
(a)Survey spectra
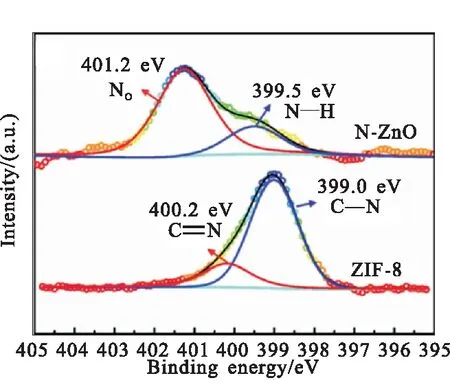
(b)High resolution XPS spectra of N 1s图3 ZIF-8、ZnO和N-ZnO的XPS谱图Fig.3 XPS spectra of ZIF-8,ZnO and N-ZnO

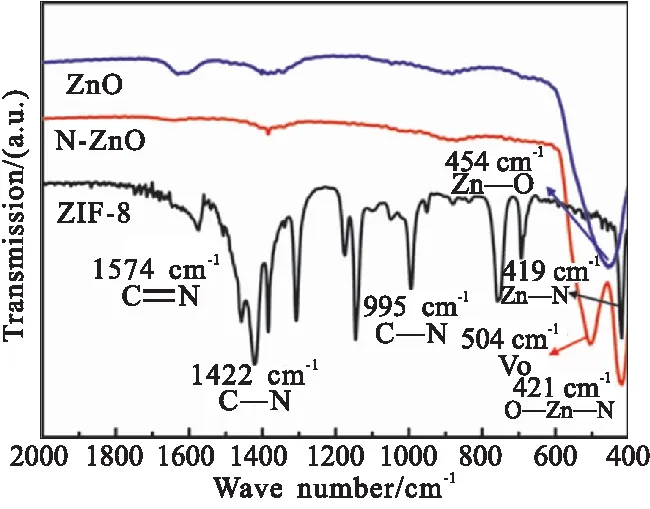
图4 ZIF-8、ZnO和N-ZnO的红外光谱Fig.4 Infrared spectra of ZIF-8,ZnO and N-ZnO
为考察以2-甲基咪唑为氮源制备N-ZnO材料的稳定性,分别在氩气和空气气氛中600 ℃下热处理3 h,其FTIR谱图如图5所示。
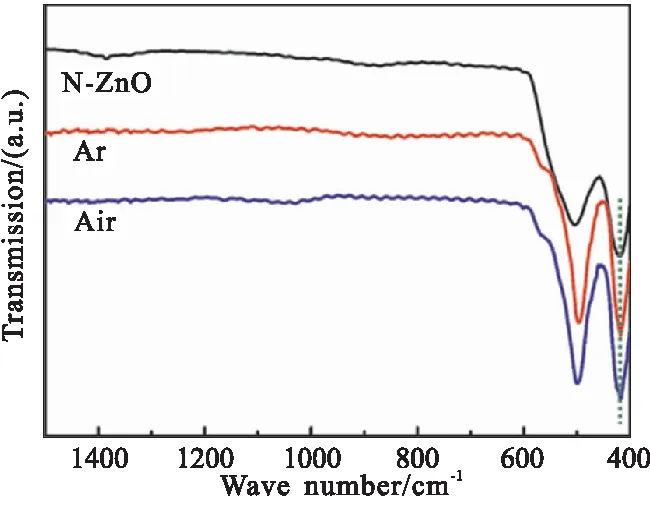
图5 N-ZnO经氩气和空气气氛中600 ℃下热处理3 h前后的红外光谱Fig.5 Infrared spectra of N-ZnO before and after heat treatment at 600 ℃ for 3 h in argon or air
由图5可看出,O—Zn—N键特征吸收峰的位置未发生位移,由文献可知ZIF-8具有高温不稳定性,空气或惰性气氛下高温烧结均会造成Zn—N的断裂,分别形成ZnO和N掺杂C材料[29-30]。由此表明,2-甲基咪唑为氮源、在双溶剂热条件下成功合成了N-ZnO,且N-ZnO经热处理后,VO与O—Zn—N键吸收峰峰强比增大,这可能是由于N掺杂改变了ZnO表面态,削弱了Zn—O键之间的键强,使得O原子更易溢出形成VO。
2.2 催化AP热分解性能的影响
为研究N-ZnO催化剂对AP热分解性质的影响,分别对纯AP、AP/ZIF-8、AP/ZnO和AP/N-ZnO混合物样品进行综合热分析,如图6所示。
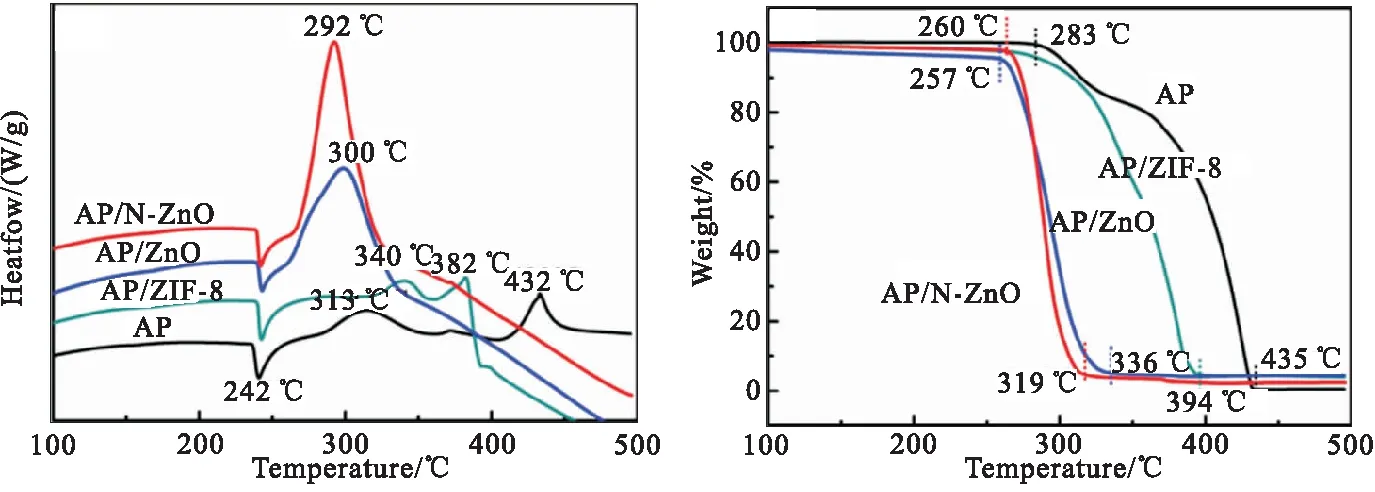
(a)DSC curves (b)TG curves
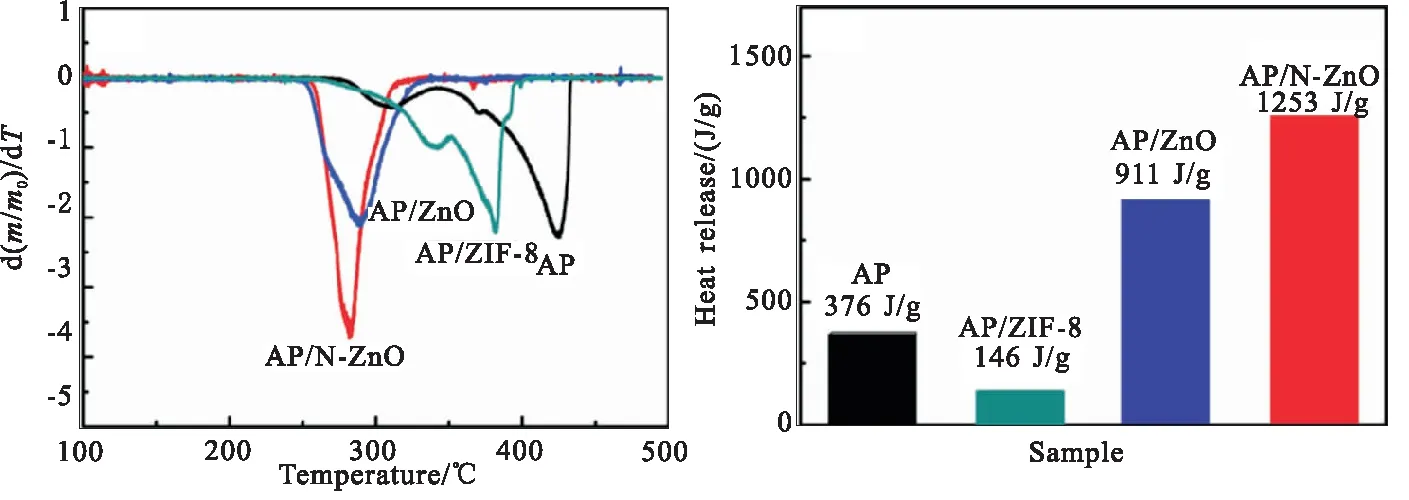
(c)DTG curves (d)Exothermic histograms图6 纯AP、AP/ZIF-8、AP/ZnO和AP/N-ZnO混合物样品的热分析图Fig.6 Thermal analysis chart of pure AP,AP/ZIF-8,AP/ZnO and AP/N-ZnO
由DSC曲线(图6(a))可看出,纯AP的受热分解可分为3个过程:在242 ℃出现的吸热峰对应AP由低温的斜方晶系可逆地转变为高温的立方晶系的晶型转变过程,在313 ℃与432 ℃出现的放热峰则对应AP的低温分解阶段与高温分解阶段[2]。当引入ZIF-8、ZnO和N-ZnO催化剂后,其对AP晶型转变过程几乎无影响,但对AP的分解过程有显著的催化效果,具体表现为AP热分解温度由432 ℃分别提前至382、300和291 ℃,分别降低了50、132和141 ℃,且在ZnO和N-ZnO作用下,AP的两个放热峰合并为一个放热峰,使放热集中。
由TG曲线还可看出,纯AP热分解过程主要发生在286~430 ℃温度范围内,分为两个分解阶段,其与DCS曲线上的两个放热峰结果一致,在低温分解阶段(286~342 ℃)的分解量约为17%,高温分解阶段(342~435 ℃)为83%左右,而在ZIF-8、ZnO和N-ZnO材料的催化作用下,AP的分解温度范围分别缩短至283~394 ℃、257~336 ℃和260~319 ℃。再者对TG曲线进行一阶微分得到的DTG曲线如图6(c)所示,ZIF-8、ZnO和N-ZnO催化剂使AP热分解过程中最大失重反应速率由-2.27 %/℃变化为-2.21、-2.11、-3.70 %/℃。同时,图6(d)比较了催化剂对AP分解放热量的影响,纯AP在低温、高温分解阶段的总放热量为376 J/g,引入ZIF-8后放热量减小至146 J/g,这可能是由于ZIF-8在AP热分解过程中发生了吸热的分解反应;而当引入ZnO、N-ZnO催化剂后,放热量分别增加至911、1253 J/g,增长率分别为1.42倍、2.33倍。
综上所述,从热分解峰温度、热分解温度范围、最大失重反应速率和放热量四个方面均表明N-ZnO对AP热分解反应具有更高的催化活性。
2.3 催化机理分析
AP热分解是由数百个链反应组成的复杂过程,但一般认为,其始于NH4+ClO4-分子间的电子转移或质子转移,离解生成NH3和HClO4,然后HClO4中Cl—O键逐级断裂,形成HClOx(x=0,1,2,3)、原子O和O2等含氧产物,最后这些含氧产物与NH3发生氧化反应,生成N2O、NO、Cl2和H2O等最终产物[31]。对于AP的催化热分解,一方面催化剂被用作电子转移或质子转移的“桥梁”来加速NH4+ClO4-分子的离解;另一方面催化剂与HClO4作用,加速AP分解。根据文献可知,当金属氧化物半导体材料(如ZnO[4,7,12]、CoO[32]和CuO[33-34]等)应用于AP的分解时,提出了一种催化机理如下所示:
在上述化学式中,HClO4被吸附在半导体纳米颗粒的表面上,通过与半导体材料的热激发固有电子结合形成氧负离子O-;随后,NH3分子被具有强大的氧化能力O-所氧化,生成氮氧化物(NyOz)和水,其中NyOz可为N2O、NO和NO2,并释放被捕获的电子回到ZnO导带中。
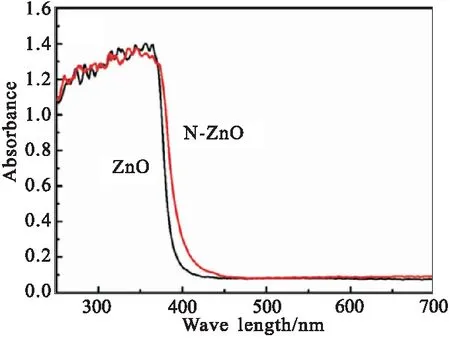
为探讨N-ZnO材料对AP热分解反应的催化机理,对N-ZnO和纯ZnO材料进行了紫外可见漫反射光谱和O 1s高分辨XPS分析。图7(a)为N-ZnO和纯ZnO材料的紫外可见漫反射光谱(UV-vis DRS),可发现,相比纯ZnO材料,N-ZnO材料的光吸收边缘呈现出向可见光区域的轻微位移。
(a)UV-Vis DRS spectra
(b)(hνα)2-hν curve图7 纯ZnO和N-ZnO的紫外可见漫反射光谱Fig.7 UV-Vis diffuse reflectance spectra of N-doped ZnO and pure ZnO
对于具有直接带隙的ZnO半导体而言,其禁带宽度和吸收系数的关系可由公式(1)来表示[35]:
αhν=B(hν-Eg)0.5
(1)
式中h为普朗克常数;α为吸收系数;ν为入射光频率;B为比例常数;Eg为半导体材料的光学禁带宽度。
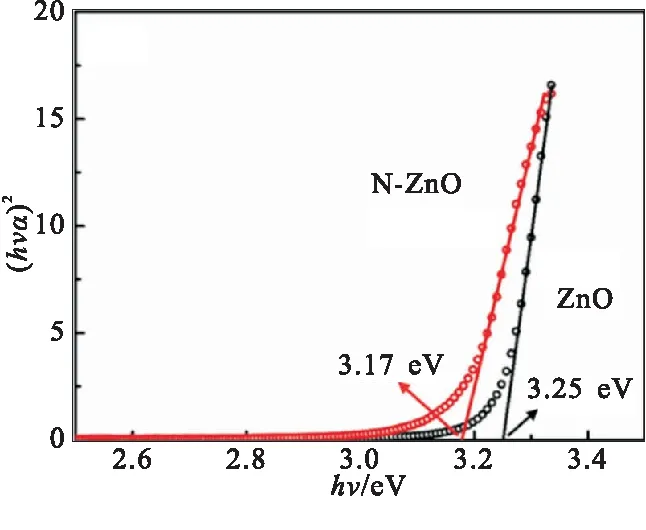
图7(b)为以 (hνα)2为纵坐标和hν为横坐标的(hνα)2-hν作曲线图,根据该曲线的线性外推结果,纯ZnO和N-ZnO的带隙分别为3.25 eV和3.17 eV,即N原子的掺杂使得ZnO的带隙减小了。
采用XPS技术分析N-ZnO和纯ZnO材料中O原子的化学状态,如图8所示。两者的O 1s经高斯拟合为三个子峰,由低结合能至高结合能分别对应于ZnO晶格氧(Zn—O键)、氧空位(VO)和表面吸附氧(—OH)[3];对比分析ZnO与N-ZnO中氧空位子峰所对应的峰面积和晶格氧子峰所对应的峰面积,发现N-ZnO的A(Vo)/A(晶格氧)值明显高于纯ZnO,由此说明N原子的掺杂使得ZnO中产生了更多的氧空位。
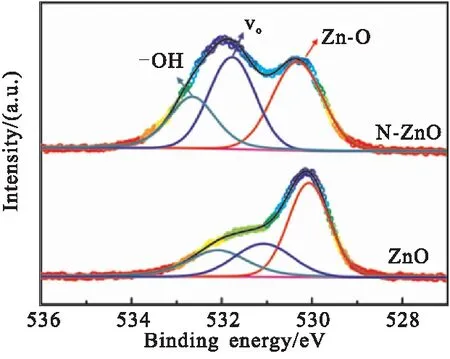
图8 N-ZnO和纯ZnO的O 1s高分辨XPS谱图Fig.8 O 1s high resolution XPS spectra of N-ZnO and pure ZnO
在AP热分解过程中,当ZnO催化剂存在情况下,由于AP初始分解产物HClO4的分子极性强于NH3分子,HClO4分子可优先吸附在ZnO表面,加速HClO4从AP表面扩散出来的速度,减少了其在AP表面的吸附,使AP的热分解阶段由两个变为一个;且当温度超过250 ℃后,其价带电子被热能激发至导带中[4,13],并转移至吸附在表面上的HClO4分子,促进Cl—O键的断裂,形成HClOx(x=0,1,2,3)和活性O-,其中O-较高的氧化能力加剧了其与NH3的氧化反应,从而改善了AP热分解性能。而对于N-ZnO催化剂,一方面掺杂N原子可在ZnO的O 2p价带上方形成了一个能量较高的N 2p价带,当N 2p价带与O 2p价带相互作用后,其禁带宽度变窄,使电子更容易跃迁至导带中,降低了AP热分解温度;另一方面ZnO表面增多的氧空位缺陷,更加有利于HClO4分子在其表面的吸附和活化,有效促进Cl—O键的断裂,且氧空位缺陷可作为电子陷阱,俘获来自ZnO导带或内部电子,在其表面形成富集电子的空间电荷区域[36],使HClO4分子能获得更多电子,产生更多O-离子,致使其与NH3之间的氧化反应更加剧烈,放出更多热量,由此提高了其对AP热分解的催化活性。
3 结论
(1)以2-甲基咪唑同时为N源及碱源,利用其在甲醇溶液中与Zn2+的配位反应,即2-甲基咪唑中的N原子可与Zn2+配位成键形成沸石咪唑类骨架化合物-8(ZIF-8),以及其在水溶液中水解反应所产生的OH-合成ZnO,通过调控两者协同竞争关系,溶剂热法一步合成了稳定的N-ZnO。
(2)与纯ZnO催化剂相比,N-ZnO催化剂表现出更加优异的催化效果,使得AP的热分解温度降低了140 ℃、热分解温度范围缩短了85 ℃、最大失重反应速率提高了1.43 %/℃、表观分解热提高了2.33倍。
(3)N原子的掺杂窄化了ZnO的带隙和增多了ZnO的氧空位缺陷,在两者的共同作用下,使得HClO4从N-ZnO催化剂表面更加容易获得更多的电子,加深其分解程度,产生更多的O-离子,同时NH3被具有高氧化能力的O-离子所氧化,分解产生更多的热量。

