miRNA-34a 对非酒精性脂肪肝细胞模型中的脂质蓄积和炎症的影响
胡亦懿 翟英姬 梅迪华 杜国平(通讯作者)
(1 南方医科大学顺德医院< 佛山市顺德区第一人民医院>VlP 医学中心 广东 佛山 528308)(2 南方医科大学顺德医院< 佛山市顺德区第一人民医院> 消化内科 广东 佛山 528308)
非酒精性脂肪性肝病(NAFLD)是最常见的慢性肝病,其特征在于脂肪变性和脂质沉积[1-2]。NAFLD 可从单纯性脂肪变性、肝内脂肪积聚,到更具侵袭性的非酒精性脂肪性肝炎(NASH),NASH 可进展为肝硬化,甚至肝细胞癌(HCC),目前,NAFLD的发病率急剧增加[3],且发病机理仍不清楚[4]。研究已表明miRNA-34a 在饮食诱导的肥胖小鼠的脂肪肝中增加,其通过靶向Sirt1参与胆固醇代谢失调,且miR-34a在NAFLD中呈现高表达[5]。但miR-34a 在NAFLD 中脂质堆积和炎症中的作用尚不清楚。本研究探讨抑制miR-34a 对NAFLD 细胞模型中的脂质蓄积和炎症的影响。
1.材料与方法
1.1 细胞培养
肝细胞HL-7702(L02)细胞系购自武汉普诺赛生命科技有限公司。细胞在含有10%胎牛血清(FBS;Gibco,CA)和1%青霉素-链霉素(北京索莱宝生物科技有限公司)的RPMI-1640 培养基(Hyclone,UT,美国)中,于37℃,5% CO2、饱和湿度条件下培养。待细胞长至70%~80%后用0.25%胰蛋白酶消化后传代。
1.2 细胞转染
miR-34a 抑制剂和阴性对照(NC 抑制剂)购自广州锐博生物,用Lipofectamine®2000(Invitgen,MA,USA)按制造商说明用50pmol/mL miR-34a 抑制剂和NC 抑制剂进行细胞转染。转染前24h,将L02 细胞以1×105个/孔的密度接种到6 孔板中,6h 后更换新鲜培养基,转染24 ~48h 后收集细胞进行后续分析。
1.3 NAFLD 细胞模型的建立
诱导NAFLD 细胞模型,L02 细胞转染后用油酸(OA;Sigma,USA)1mM 处理24h。在整个实验过程中,将L02 细胞分为空白组、油酸(OA)组、NC 抑制剂+OA(NC+OA)组和miR-34a-抑制剂+OA(抑制剂+OA)组。
1.4 油红O 染色
OA 处理24h 后,用PBS 冲洗细胞3 次,4%多聚甲醛固定10min。L02 细胞油红O 染色30min。随后,用苏木素反复染色2~3min,用1%盐酸酒精(快速)进行分化。然后在光学显微镜(Olympus Corporation)下观察。
1.5 RT-qPCR 检测
RT-qPCR 常规检测TNF-α、IL-10、IL-6 mRNA 表达。使用Bulge-Loop ™ miRNA RT-qPCR 引物和Bulge-Loop ™miRNA RTqPCR 检测试剂盒(RiboBio)在42℃ 60min 和70℃ 10min 进行RT。在95℃ 10min、95℃ 2s、60℃ 20s、70℃ 10s,40 个循环下进行基因表达水平的定量,β-actin 作为内参,记CT 值,采用2-∆∆CT分析相对表达水平。
1.6 统计分析
使用SPSS22.0 进行数据统计分析,数据表示为平均值±标准差(±s),单因素方差分析确定结果是否具有统计学意义,P<0.05 表示具有统计学意义。
2.结果
2.1 抑制miR-34a 对NAFLD 细胞模型中脂质蓄积的影响
RT-qPCR 结果显示,miR-34a 抑制剂组的miR-34a 表达量显著低于空白组(图1A)。油红O 染色结果显示油酸(OA)组和NC+OA 组的油红O 染成红色的脂滴数量均显著高于空白组,抑制剂+OA 组的油红O 染色结果显著低于NC+OA 组(图1B)。
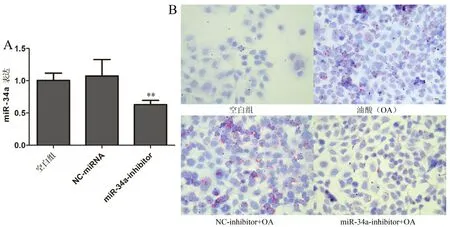
图1 miR-34a 表达及油红O 染色结果
2.2 抑制miR-34a 对NAFLD 细胞模型中炎性细胞因子的影响
结果显示,OA组较空白组TNF-α、IL-6 mRNA水平显著升高,IL-10 mRNA 水平显著降低(P<0.01);miR-34a 抑制剂+OA 组TNF-α、IL-6 mRNA 水平较NC+OA 组显著降低,IL-10 mRNA 水平较NC+OA 组显著升高(P<0.05)(图2)。
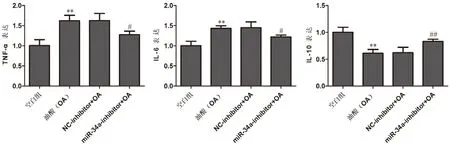
图2 细胞模型TNF-α、IL-6、IL-10 mRNA 水平
3.讨论
NAFLD 被认为是最严重的慢性肝功能障碍,NASH 是NAFLD的炎症状态,大约三分之一的NAFLD 会患上NASH,NAFLD 除了增加患肝病的风险外,还与心血管疾病的风险增加有关[6]。虽然NAFLD 的发病机制很复杂,但“两击”理论正越来越多地被接受,第一次打击涉及肝脏甘油三酯过多和胆固醇积聚。这使肝脏对第二次打击变得敏感,包括肝脏氧化应激升高和炎症,最终导致肝细胞损伤[7]。因此抑制脂质蓄积及炎症可能对NAFLD 的进一步发展具有重要作用。
mi-RNAs 调节发育和生理的各个方面,包括代谢性疾病、心血管疾病、免疫功能障碍、癌症及肝纤维化等。miR-34a 位于染色体1p36 上,已在肝细胞癌、乳腺癌、胃癌、骨肉瘤、结直肠癌、急性髓系白血病、骨髓瘤和肺癌中被发现[8]。研究报道miR-34a 在饮食诱导的肥胖小鼠的脂肪肝中增加,可通过靶向肝脏NAD 依赖的脱乙酰化酶Sirtuin 1(Sirt1)参与胆固醇代谢的失调,sirt1 是调节肝细胞凋亡、代谢性疾病和癌症的重要酶。此外,大鼠和人NAFLD 和NASH 的进展与miR-34a/sirt1/p53 信号转导通路有关,人肝组织中miR-34a 的表达随非酒精性脂肪肝的严重程度而显著增加[9]。为进一步阐明miR-34a 在NAFLD 中的作用,将miR-34a 抑制剂转染L02 细胞,获得高转染效率。然后将L02 细胞与OA 孵育,建立NAFLD 细胞模型。我们发现OA 组的脂质积累量明显高于空白组,而抑制miR-34a 后脂质积累量明显低于空白组。以上结果表明,NAFLD细胞模型建立成功,miR-34a 抑制可能在抑制脂质沉积方面起到积极作用。除了在脂质代谢中的作用外,miR-34a 在NAFLD的炎症中也起着重要作用[10]。本研究结果表明,促炎细胞因子TNF-α、IL-6 在NAFLD 细胞模型中高表达,抑炎细胞因子IL-10 在NAFLD 细胞模型低表达,提示L02 细胞处于炎性浸润状态,这些促炎细胞因子可能在NAFLD 的发生发展中起重要作用。miR-34a 抑制后TNF-α、IL-6 的表达均受到抑制,IL-10的表达促进,提示抑制miR-34a 可以有效地调节非酒精性脂肪肝细胞模型的炎症状态。
综上所述,抑制miR-34a 可以减轻非酒精性脂肪肝细胞模型中的脂质堆积和炎症反应。这些发现为非酒精性脂肪肝的治疗提供了理论依据。然而,miR-34a 抑制NAFLD 的保护机制仍有待进一步研究。

