MiR-96-5p靶向调控MTSS1表达对结肠癌细胞恶性生物学行为的影响
许春蕾 李 娜 汤旭山
结肠癌是一种常见的消化道恶性肿瘤,其发病率在男性中位于第3位,在女性中位于第4位[1]。近年来,随着人们生活方式和饮食结构的改变,结肠癌发病率正逐年上升,并且呈现出年轻化的趋势[2]。但由于结肠癌早期发病隐匿及临床症状不典型等特点导致其早期诊断与治疗仍进展有限[3]。随着肿瘤生物学的发展,人们迫切希望从基因、分子层面探索结肠癌的病因及发生机制以改善患者的预后。
MircoRNAs(miRNAs)属于内源性短链RNA,其能够与目标mRNA的3'非翻译区(3'-UTR)的互补位点特异性结合并抑制其翻译或者促进其降解,从而在转录后水平对靶基因的表达进行调控。文献曾报道多种miRNA在结肠癌中表达异常[4],如过表达的miR-17-5p可以通过下调E2F1的表达来促进肿瘤细胞的恶性增殖[5],miR-145可以通过靶向调节MAPK来抑制肿瘤细胞的生长从而起到抑癌作用[6]。最近Kandhavelu,J[7]团队对结肠癌患者的肿瘤组织和血清进行大规模miRNA的筛选,结果提示miR-96-5p在结肠癌患者中异常高表达,推测其可能是结肠癌标志基因的潜在靶点之一。查阅国内外文献发现目前关于miR-96-5p对结肠癌的作用鲜有报道,故本研究预通过实验明确miR-96-5p对结肠癌的发生、发展的影响及其相关作用机制,为全面阐明miRNA-96-5p在结肠癌中的作用奠定基础,为结肠癌的早期诊断及临床治疗提供新的思路和实验室依据。
1 材料与方法
1.1 材料
人结肠癌细胞系HCT116购自中国科学院上海细胞生物研究所;30只SPF级BALB/c免疫缺陷型雌性裸鼠购自新疆医科大学动物实验中心,4~6周龄,体重(15.6±2.4)g;本实验的所有操作均通过动物伦理学审批。胎牛血清(FBS)、DMEM/F12(Hyclone公司),Trizol、Lipo 2000、RIPA裂解液、BCA蛋白定量试剂盒(Invitrogen公司),Pcmv质粒、miR-96-5p mimics/inhibitor及无关核酸序列(上海吉玛)、Annexin-V/PI细胞凋亡试剂盒(北京博奥生物科技公司),Matrigel胶(BD公司),MTT试剂盒(Sigma公司),Transwell小室(Millipore公司)、双荧光酶检测试剂盒(Promega公司)、MTSS1抗体、GAPDH抗体(Abcam公司)。
1.2 方法
1.2.1 HCT116结肠癌细胞的培养及转染 用含有10%FBS的DMEM/F12将HCT116细胞置于37 ℃、5% 的CO2培养箱中进行培养,待细胞生长融合至70%~80%时用0.25%的胰酶进行消化,室温下800 r/min离心5 min,弃上清,PBS重悬并调整细胞密度至5×105/ml,取1 ml细胞悬液接种于6孔培养板上,同上条件于培养箱中过夜,观察待细胞充分贴壁后,去除培养基,进行瞬时转染。按照 Lipo2000试剂使用说明书分别将miR-96-5p inhibitor及microRNA无关序列(即miR-NC)按终浓度50 nmol/l转染入结肠癌HCT116细胞内,同上条件于培养箱中进行孵育,4 h后更换为含有15%FBS的DMEM/F12,并用荧光显微镜观察转染效果,拍照记录。后继续置于培养箱中继续培养48 h,进行后续实验。
1.2.2 实时荧光定量PCR(RT-PCR) 按照Trizol试剂说明书提取细胞总RNA,并按照逆转录试剂盒操作说明对RNA进行逆转录,合成cDNA,再按照SYBR Mixture说明书及预实验确定的时间与温度进行实时定量。RT-PCR反应条件为:95 ℃(10 min)预变性后,变性95 ℃(5 s)→退火60 ℃(30 s)→72 ℃(32 s),40个循环。RT-PCR引物设计为:miR-96-5p上游为5'-ACA CTC CAG CTG GGT TTG GCA CTA GCA CAT TT-3',下游为5' CTC AAC TGG TGT CGT GGA GTC GGC AAT TCA GTT GAG AGC AAA AA 3';GAPDH上游为5' AGA AGG CTG GGG CTC ATT TG 3',下游为5' AGG GGC CAT CCA CAG TCT TC 3';MTSS1上游为:5' AGCAGCCTGAACAGTGTCAA 3',下游为:5' GGGATGGTGACTTGGACTGG 3'。以GAPDH为内参,根据2-△△Ct方法进行计算分析。以上实验独立重复3次。
1.2.3 MTT实验 取转染后48 h细胞,将细胞密度调整至5×103个/ml,接种至96孔板中,每孔含200 μl 10%胎牛血清DMEN/F12培养液,置于37 ℃、5% CO2培养箱中进行培养,48 h后取出细胞,加入20 μl MTT(5 mg/ml)/孔,37 ℃孵育4 h,弃除原培养液,加入150 μl二甲基亚砜(DMSO)/孔,于室温下充分震荡10 min使形成的紫色甲瓒结晶完全溶解。置酶联免疫检测仪上选择490 nm波长测定每孔吸光度值(OD)。根据公式:(对照组OD-实验组OD)/对照组OD,计算并分析各组的细胞增殖率。每组设定5个复孔,实验单独重复 3次。
1.2.4 细胞划痕实验 预先在6孔板每个孔的底部使用marker笔划2条间隔为5 mm的横线,再将转染后细胞接种于6孔板中,每孔加入2 ml含10%的细胞培养液并使每孔细胞达2×105个,于37 ℃、5% CO2细胞培养箱进行培养12 h,待细胞密度达80%左右时使用200 μl移液器枪头在细胞培养面垂直于marker笔划线,PBS冲洗细胞3次以去除刮除掉的细胞。再向每孔加入含2%FBS的DMEN/F12培养液,于细胞培养箱中继续培养24 h后,倒置显微镜下照相,使用Image J软件测量细胞间距离进行分析。
1.2.5 Transwell实验 用不含FBS的DMEM/F12稀释Matrigel基质胶(1∶6)包被Transwell小室中的上室基底膜,加入100 μl含1%FBS的DMEM/F12细胞悬液,调整细胞密度使每孔细胞达2×105个。在Transwell小室下层加入含15%FBS的DMEM/F12培养液,置于37 ℃、5% CO2细胞培养箱中培养12 h后,取出小室用湿棉签轻轻擦拭上室基底部以去除上室残存细胞,PBS冲洗2次,无水酒精于室温下固定15 min,0.1%结晶紫室温下染色半小时,晾干后于倒置显微镜下进行拍照,每组随机选取5个视野进行细胞计数,取其平均值为穿出细胞数。以上实验独立重复3次。
1.2.6 凋亡实验 将转染后48 h的细胞,用0.25%的胰酶进行常规消化,PBS洗涤3次,800 r/min离心5 min后弃去上清液,调整细胞浓度使每样本量细胞约为5×105,加入195 μl Annexin V-FITC结合缓冲液将细胞重悬,随后加入5 μl Annexin V-FITC和10 μl碘化丙啶(PI),室温下避光孵育30 min,随后用流式细胞仪检测细胞凋亡。以上实验单独重复3次。
1.2.7 裸鼠致瘤实验 取处于对数生长期的HCT116细胞接种至直径为5 cm的细胞培养皿中。根据Lipo2000试剂说明书进行转染,利用pCMV质粒将miR-96-5p的过表达及抑制表达的microRNA转染入HCT116细胞内。本实验分为miR-96-5p过表达组,即 pCMV-miR-96-5p-mimics;miR-96-5p抑制组,即 pCMV-miR-96-5p-inhibitor;对照组为空载体转染的HCT116,即NC组。常规消化细胞后,用无血清DMEN/F12培养基重悬细胞并调整细胞密度至4×106/ml。选取4周龄的BALB/c小鼠,于每只裸鼠右上肢腋下接种转染处理的细胞悬液200 μl;接种6周后脱颈处死荷瘤小鼠,计算肿瘤体积(肿瘤体积=肿瘤最短径2×肿瘤最长径/2)并称重。
1.2.8 双荧光素酶报告基因检测 利用miRNA靶基因预测网站TargetScan(http://www.targetscan.org/),miRanda(http://www.microrna.org)对miR-96-5p的靶基因进行预测,筛选MTSS1作为其可能的靶分子。以人结肠癌细胞基因组DNA为模板,首先构建MTSS1的野生型(wt)和突变型(mut)质粒。利用Primer 5.0进行引物设计,扩增与miR-96-5p靶向序列相结合的MTSS1的3'-UTR片段。扩增产物在经过纯化、酶切和连接过程后导入双荧光素酶真核表达载体pmirGLO中,构建出野生型表达质粒。用TaKaRa点突变试剂盒扩增突变片段,随后构建MTSS1突变型表达质粒。取对数生长期的HCT116细胞,接种于96孔板上,调整细胞密度为1×104个/孔,常规培养细胞24 h后,利用Lipo2000按pmirGLO-MTSS1-wt+miRNA-96-5p 模拟物转染组、pmirGLO-MTSS1-wt+miRNA-96-5p 对照模拟基因组、pmirGLO-MTSS1-mut+miRNA-96-5p 模拟物转染组、pmirGLO-MTSS1-mut+miRNA-96-5p对照模拟基因组进行共转染,每组设5个复孔。转染24 h后,依次加入萤火虫荧光素酶与海肾荧光素酶检测试剂,利用双荧光素酶报告分析系统(Promega)进行分析。
1.2.9 Westernblot实验 收集各组细胞,加入RIPA裂解液提取细胞内总蛋白,BCA法进行蛋白定量,加入5×SDS-PAGE蛋白上样缓冲液,煮沸5 min使蛋白变性后,进行聚丙烯酰胺凝胶(SDS-PAGE)电泳,使蛋白分离,后采用湿转法将蛋白转移至PVDF膜上,5%脱脂奶粉于室温下封闭2 h,将PVDF膜与稀释后的抗MTSS1(1∶200),GAPDH(1∶1 000)一抗4 ℃条件下封闭过夜,再以 TBST溶液清洗3次,5 min/次,以辣根酶标记的二抗稀释液(1∶10 000)室温孵育1 h,以 TBST溶液清洗3次,5 min/次。最后加入显色剂,ECL发光。Image J软件测定条带灰度值,以目标蛋白与内参GAPDH的比值作为其相对含量。以上实验重复3次,结果取其平均值。
1.3 统计学方法
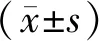
2 结果
2.1 miR-96-5p对结肠癌细胞增殖的影响
荧光显微镜观察结果提示,HCT116细胞转染率约为85%。利用RT-PCR检测miR-96-5p表达,结果提示与正常对照组相比,转染miR-96-5p inhibitor的HCT116细胞内miR-96-5p的表达显著降低(P<0.01),转染microRNA无关序列组(miR-NC)的细胞内miR-96-5p的表达无明显变化(P>0.05)。MTT实验结果提示转染miR-96-5p inhibitor后的HCT116细胞增殖能力明显下降(P<0.05)。见图1。
注:A、B:白光下及荧光下HCT116细胞转染效率(×200);C:各组细胞中miR-96-5p的表达;D:各组细胞增殖能力的变化曲线。与miR-NC组比较:*P<0.05。与正常对照组比较:## P<0.01。
2.2 miR-96-5p对结肠癌细胞迁移、浸润及凋亡的影响
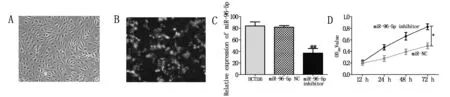
划痕实验提示转染miR-96-5p inhibitor后的HCT116细胞迁移能力明显下降(P<0.05),见图2A、B;Transwell 实验结果提示转染miR-96-5p inhibitor后的HCT116细胞浸润能力显著下降(P<0.05),见图2C、D;凋亡实验提示转染miR-96-5p inhibitor后细胞凋亡明显升高(P<0.01),见图2E、F。
注:A:各组细胞迁移距离(×200);B:各组细胞迁移结果分析;C:各组细胞浸润细胞数(×200)D:各组细胞侵袭结果分析的变化;E:各组细胞凋亡的流式结果;F:各组细胞凋亡结果分析。与miR-NC组比较:*P<0.05,**P<0.01。
2.3 miR-96-5p对裸鼠皮下成瘤的影响
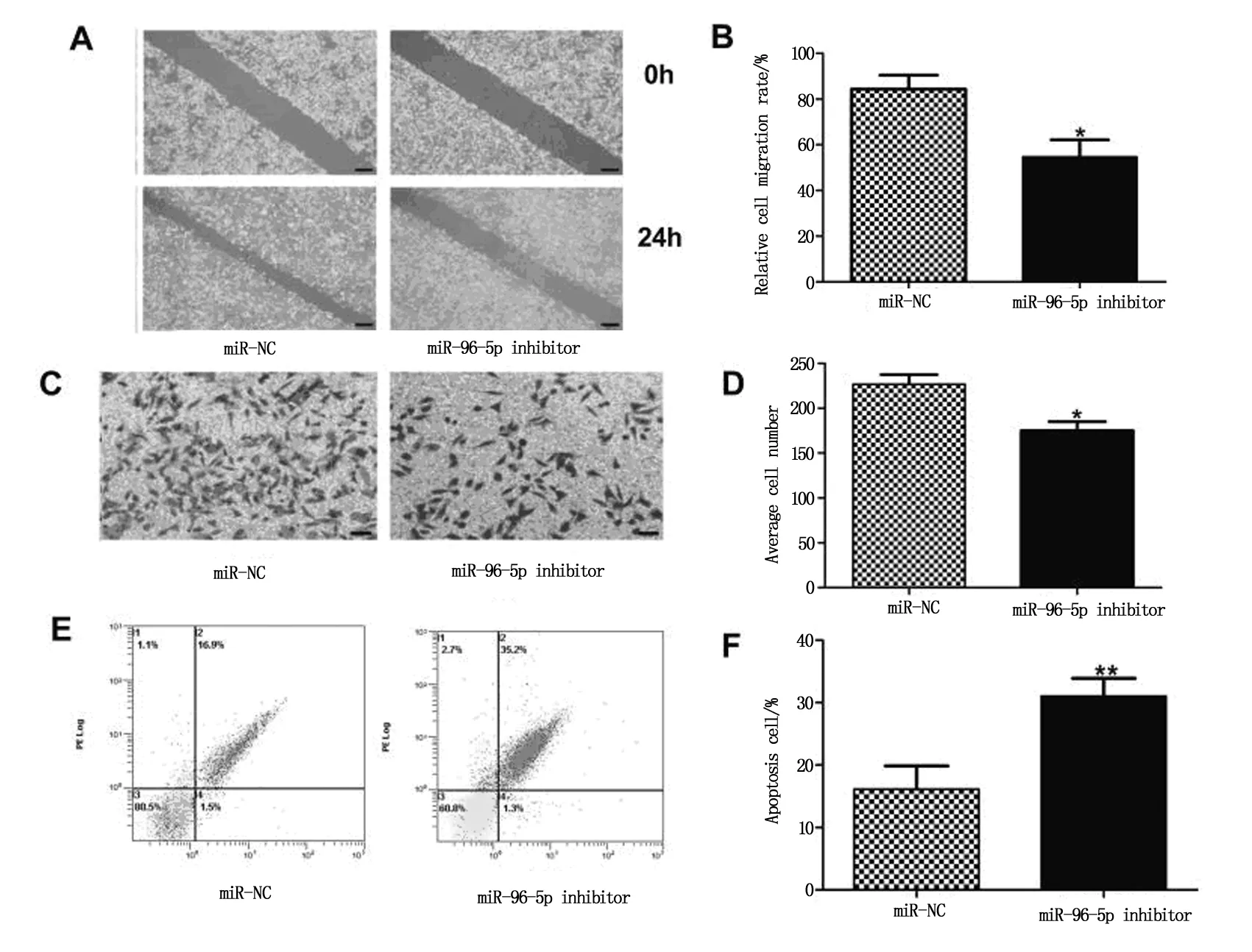
3组BALB/c小鼠经处理6周后,测量肿瘤体积与肿瘤重量结果提示与对照组(即NC组)相比,miR-96-5p 过表达组(即Pcmv-miR-96-5p mimics组)裸鼠的肿瘤体积显著增大(P<0.05),肿瘤的重量也明显增加(P<0.05);而miR-96-5p抑制组(即Pcmv-miR-96-5p inhibitor)裸鼠肿瘤的体积均明显较小(P<0.01),肿瘤的重量也明显减轻(P<0.01)。见图3。
注:A:各组小鼠的肿瘤生长情况;B:各组小鼠肿瘤的体积比较;C:各组小鼠的肿瘤重量比较。与NC组比较:*P<0.05,**P<0.01。
2.4 miR-96-5p在结肠癌细胞中与MTSS1之间的相互关系
miRNA靶基因预测软件提示MTSS1可能为miR-96-5p的目标基因,见图4A;双荧光素酶报告基因结果提示与对照模拟基因组相比,MTSS1-wt组荧光酶活性降低(P<0.05),见图4B;进一步利用Westernblot实验提示miR-96-5p可在转录后水平调控MTSS1的表达,见图4C、D。
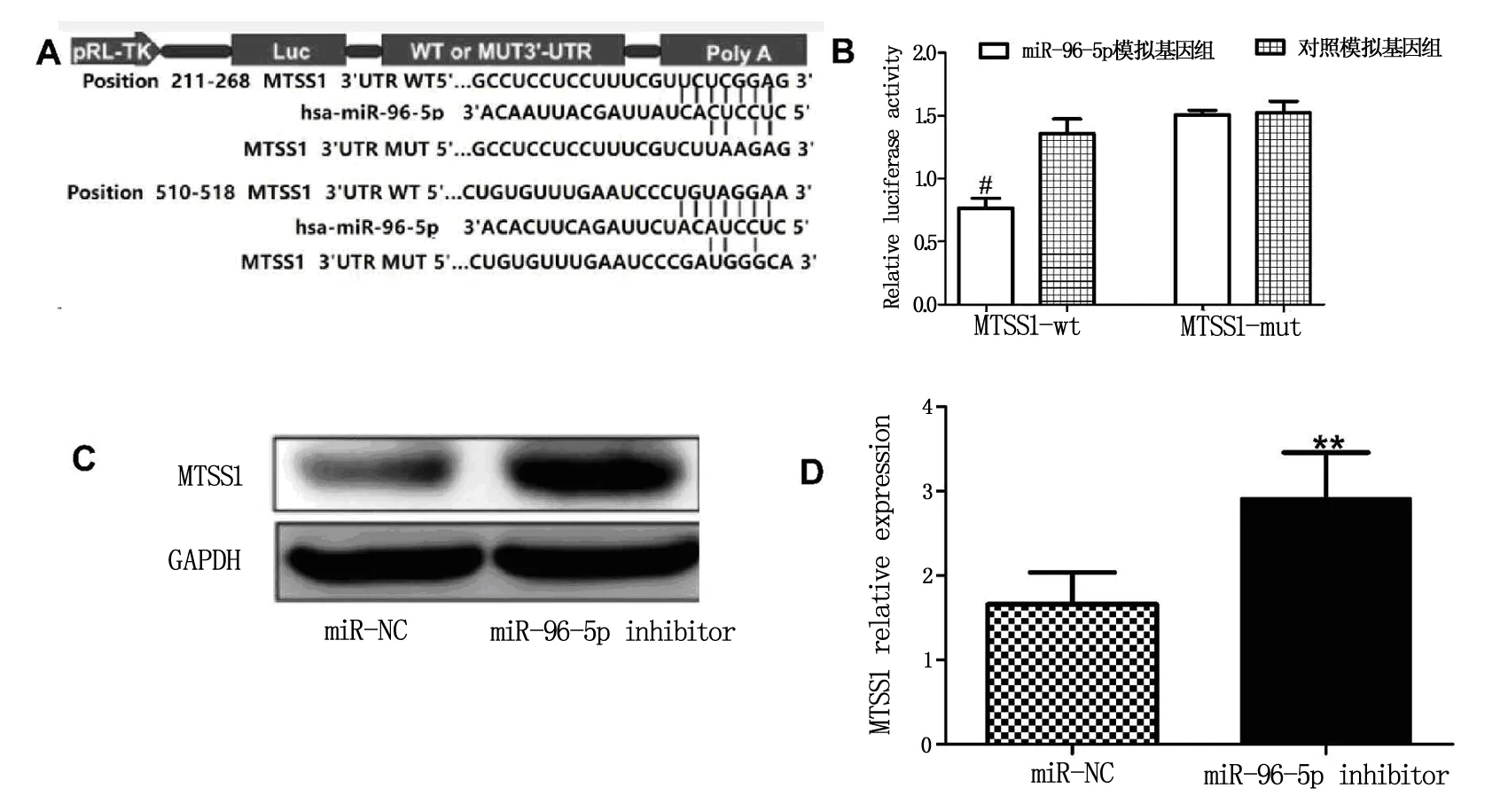
注:A:miRNA靶基因预测软件结果;B:双荧光素酶报告基因结果分析;C、D:Westernblot结果及分析。与miR-NC组比较: **P<0.01;与对照模拟基因组比较:#P<0.05。
3 讨论
结肠癌作为消化道常见恶性肿瘤,因其早期症状不典型,导致50%的结肠癌患者在发现时已经发生了其他脏器或组织的转移,而超过1/3的患者在手术治疗后将会复发[8],故结肠癌的发病机制及早期诊断的靶标也一直是科学家与临床医生研究的重点与热点问题。越来越多的证据提示miRNAs可以通过调控肿瘤细胞内与细胞浸润、增殖与凋亡等恶性生物行为的相关的靶基因,从而参与肿瘤的发生、发展与转移[9]。Wu等[10]曾报道miR-96在膀胱癌癌组织中高表达,且体外实验提示过表达的miR-96可以通过抑制CDKN1A蛋白的翻译促进肿瘤细胞的增殖并抑制其凋亡,从而推测miR-96可能是乳腺癌中的促癌miRNA。吴昊团队[11]通过实验提示肺癌患者血清与肿瘤组织中高表达miR-96,进一步实验提示miR-96可以通过阻碍抑癌基因LMO7的作用从而发挥促进肺癌细胞的增殖与迁移能力并抵抗抗癌药物顺铂的作用。而在胰腺癌中,miR-96可以通过抑制促癌基因KRAS的作用抑制肿瘤细胞的发展,从而发挥抑癌基因的作用[12]。Kandhavelu等[7]通过对结肠癌患者的血清与肿瘤组织进行miRNA高通量筛查发现miR-96-5p在肿瘤患者中高表达,这提示miR-96-5p可能参与了结肠癌的发生、发展。
为了明确miR-96-5p在结肠癌中的作用,我们通过miRNA转染技术,抑制结肠癌细胞HCT116中的miR-96-5p的基因表达,并通过免疫荧光与RT-PCR实验验证转染效率后,利用MTT、划痕实验、Transwell及凋亡实验检测miR-96-5p对肿瘤细胞增殖、迁移、侵袭和凋亡能力的影响,结果提示抑制肿瘤内miR-96-5p基因的表达后,细胞的增殖、迁徙和侵袭能力显著下降,但却明显促进了细胞的凋亡。进一步在BALB/c小鼠行皮下成瘤实验提示,过表达miR-96-5p基因可显著促进结肠癌细胞的成瘤能力,而抑制miR-96-5p基因的表达可明显削弱其的成瘤能力。以上实验提示miR-96-5p在结肠癌中起着促癌基因的作用,下调miR-96-5p的表达能够抑制肿瘤细胞增殖、侵袭及迁移能力,促进肿瘤细胞发生凋亡。为进一步明确miR-96-5p通过调控何种蛋白来发挥促癌作用,我们又通过miRNA靶基因预测软件进行分析发现,MTSS1在3'-UTR区域存在miR-96-5p的潜在结合位点,继而利用双荧光素酶报告基因及Western blot实验进行验证,结果提示miR-96-5p可以结合MTSS1的3'非编码区域来抑制后者的转录从而下调其蛋白的表达。转移抑制蛋白1(Metastasis suppressor 1,MTSS1)也被称为转移消失蛋白(Missing in Metastasis),其基因位于染色体8q24.1,在2002年由Lee等在膀胱癌中首次发现被报道[13]。有研究证实MTSS1主要定位于细胞间连接,其分子的中间区域有着类似于脚手架蛋白的结构,可以通过与细胞信号通路中的受体蛋白、转录因子和细胞间调控因子的结合,参与肌动蛋白所介导的细胞核的形成及细胞内微丝分支稳定性的维护[14]。Wang等[15]在胃癌中发现MTSSI可以通过抑制PI3K/AKT信号通路来调控PTEN的表达,从而降低肿瘤细胞迁移、浸润及上皮间质转化的能力。Taylor MD团队[16]发现MTSS1的表达可以抑制肺腺癌细胞的转移并可以延长患者生存时间。在结直肠癌中,蛋白激酶Akt2的缺失使MTSS1的基因与蛋白水平上调,抑制肿瘤的细胞增殖、粘附、迁移等生物学活动[15]。本研究结果提示在结肠癌中MTSS1与miR-96-5p的表达水平呈负相关,而下调miR-96-5p的表达,使其对MTSS1的靶向调控作用减弱,后者的表达增加,最终抑制了结肠癌细胞的增殖、迁移、浸润能力,并促进其发生凋亡。
综上所述,miR-96-5p能够靶向调控MTSS1的表达,促进结肠癌细胞的增殖、侵袭及迁移能力,并抑制细胞发生凋亡,从而促进肿瘤的发生、发展及转移。这为miR-96-5p有望成为结肠癌早期诊断与治疗生物靶基点奠定了实验室基础。

