紫外诱变结合链霉素抗性选育小诺霉素高产菌株
范一文 向慧敏 谢田甜


摘要以自然筛选的小诺霉素产生菌XDBJ-CF为诱变选育的出发菌株,经最适照射剂量60 s的紫外诱变后,在含20 μg/mL链霉素的高氏平板上培养,获得链霉素抗性突变株。突变株摇瓶初筛试验显示,高产突变株的数量大于低产突变株。从正突变株中挑选相对发酵单位130%以上的16株高产突变株进行摇瓶复筛,获得2株小诺霉素高产突变株XDBJ-CF-09-24、XDBJ-CF-09-90,其小诺霉素产量分别比出发菌株提高37.8%和46.3%,C 2b组分分别较出发菌株提高10%和20%。
关键词小诺霉素产生菌;菌株选育;紫外诱变;链霉素抗性筛选
中图分类号Q93文献标识码A文章编号0517-6611(2020)15-0109-03
doi:10.3969/j.issn.0517-6611.2020.15.030
开放科学(资源服务)标识码(OSID):
Breeding the Highyield Strain of Micronomicin by UV Irradiation Mutagenesis and Streptomycinresistant Screening
FAN Yiwen, XIANG Huimin, XIE Tiantian
(College of Biological Science and Engineering, South China University of Technology, Guangzhou, Guangdong 510006)
AbstractThe original strain XDBJCF of micronomicin is obtained from the environment. It was irradiated by UV light for 60 s, then cultured in the plates with streptomycin of 20 μg/mL. The mutants with streptomycinresistant was obtained and fermented in the flasks. The result showed that among all flasks, the amount of the mutants with high yield of micronomicin was higher than those with low yield of micronomicin. We selected the 16 mutants with fermentation unit higher than 130% to ferment. Two mutants with the high yield of micronomicin were obtained:XDBJCF0924 and XDBJCF0990. The micronomicin yields generated from two mutants, XDBJCF0924 and XDBJCF0990 were 37.8% and 46.3% higher, respectively, and the component C 2bcontent of the production was 10% and 20% higher than those from the original strain.
Key wordsMicronomicinproducing bacteria;Strain breeding;Ultraviolet radiation;Streptomycinresistant screening
基金項目华南理工大学2018年校级学生研究计划项目(B3180570)。
作者简介范一文(1968—),女,安徽芜湖人,高级实验师,从事生物制药及其药物分析实验室工作。
收稿日期2020-01-09
小诺霉素(micronomicin,MCR)是庆大霉素(GM)的C 2b组分,抗菌谱较广,耳肾毒性低,且对6-N-乙酰化酶的耐药菌仍有活性,是一种替代GM的新型氨基糖苷类抗生素。生产小诺霉素的小单孢菌生长缓慢,细胞壁的结构特殊,对物理、化学诱变剂耐受性强,诱变剂难以渗透到遗传物质上,故小诺霉素是国内所有抗生素发酵单位较低的一个品种。长期以来,小诺霉素发酵单位的提高工作一直在寻求突破,但传统的随机筛选方法存在工作量大、随机性大、周期长等缺点[1-3]。开展小诺霉素生产菌的高产诱变育种研究对于传统抗生素产业具有实际意义。
在抗生素高产菌株选育中,传统的物理、化学诱变方法因其简单、快速、有效等优点至今仍被广泛使用。但是这些方法存在作用目标不明确,有效突变率低、工作量大、筛选周期长等缺点,直接影响了诱变育种的工作效率。
应用分子育种中关于抗生素产生菌抗性基因与抗生素合成的结构基因和调控基因紧密连锁而易发生共突变理论,抗性筛选方法可提高抗生素生产菌的突变率,加快菌株的选育进程,有效提高抗生素产量[4-5]。此方法具有操作简单、周期短、安全性好等特点,成为目前菌种选育领域的一个研究热点[6-7]。其中以链霉素作为抗性筛选压力,在包括小诺霉素在内的多种抗生素产生菌选育所得到的突变株中都有较高的高效价突变株出现的频率[8]。
将传统的物理、化学诱变方法与抗生素抗性筛选相结合,有利于增加诱变育种的方向性、提高菌株的正突变率、加快菌株选育的进程[9]。
该研究采用紫外诱变结合链霉素抗性筛选诱变处理方法选育小诺霉素高产菌株,在紫外诱变加大出发菌株正突变率的同时,使用链霉素抗性筛选,进一步改良菌株,以期快速、有效地提高菌株的生产能力。
1材料与方法
1.1材料
1.1.1菌种。
小诺霉素生产菌为绛红色小单孢菌(XDBJ-CF),实验室保存。活性检测菌为短小芽孢杆菌,从广东环凯微生物科技有限公司购买。
1.1.2培养基。
斜面(分离)培养基(高氏I号合成培养基)从广东环凯微生物科技有限公司购买。
种子培养基:可溶性淀粉、葡萄糖、蛋白胨、酵母粉等。
发酵培养基:可溶性淀粉、葡萄糖、黄豆饼粉、玉米粉、鱼粉等。
活性检测培养基、抗生素检定一号培养基,从广东环凯微生物科技有限公司购买。
1.1.3试剂 。
硫酸链霉素(streptomycin sulfate),大连医药集团大连制药厂生产。
1.2方法
1.2.1单孢子悬液的制备。
取培养9 d 的绛红色小单孢菌(XDBJ-CF)新鲜斜面,用 10 mL生理盐水洗下孢子,将孢子悬液转入另一只带有玻璃珠的三角瓶中,200 r/min 37 ℃振荡20 min,无菌脱脂棉过滤,制成107个/mL单孢子悬液。
1.2.2自然选育。
利用菌种的自发突变,将绛红色小单孢菌(XDBJ-CF)的单孢子悬浮液涂布于高氏I号培养基平板上,置于 37 ℃恒温培养箱培养9 d,待长出单菌落后,随机挑取单菌落于斜面保存,经摇瓶发酵,牛津杯法测抑菌圈直径进行筛选,从中选育抗生素相对高产的小单孢菌菌株作为诱变的出发菌株。
1.2.3链霉素最低抑菌浓度的测定。
取0.1 mL单孢子悬液均匀涂布在含鏈霉素浓度分别为5、10、12、14、16、18、20、22 μg/mL的高氏平板上,37 ℃培养9 d,记录不同浓度平板上生长的菌落数。凡是在前一个低浓度平板上能长出菌落但在后一个较高浓度平板上未长出菌落的,后一浓度即为链霉素对小单孢菌的最低抑菌浓度。
1.2.4紫外诱变处理。
在黑暗条件下,打开紫外灯预热20 min,然后将1 mL浓度为107个/mL的单孢子悬液在搅拌条件下于紫外诱变箱中(紫外灯功率为15 W,照射距离30 cm)分别照射0、15、30、45、60、75、90 s,诱变后的孢子悬浮液作适当稀释后分别涂布在含有最低抑菌浓度链霉素的高氏平板上,以未经紫外照射的孢子悬液作为对照组。37 ℃避光培养9 d,分别统计各平板的菌落数,计算致死率,以确定最适紫外照射剂量。
1.2.5摇瓶筛选。
1.2.5.1摇瓶初筛。
将紫外照射后在含最低抑菌浓度的链霉素高氏平板上长出的突变株分别挑接在斜面上,37 ℃培养9 d。然后用接种环刮取1环孢子接种于装有50 mL种子液的250 mL摇瓶中,在转速240 r/min、温度37 ℃摇床上种子培养84 h;再取12 mL种子培养液接种于装有100 mL发酵液的500 mL摇瓶中,于34 ℃、220 r/min恒温摇床发酵培养144 h;发酵液用6.0 mol/L H 2SO 4酸化到pH 1~2,离心后取上清液,用磷酸缓冲液稀释后,以二剂量法检测发酵液效价和组分比。
1.2.5.2摇瓶复筛。
取初筛入选菌株再进行二级摇瓶发酵复筛,发酵条件同上。
1.2.6牛津杯法。
吸取0.6 mL菌浓度为107个/mL的短小芽孢杆菌菌悬液至平板上,用涂布器涂布均匀后静置,使其自然吹干;用镊子将无菌的牛津杯轻轻放入培养皿中;吸取一定体积的无菌过滤后的发酵液至牛津杯中;小心将培养皿移至培养箱内,37 ℃培养16 h;观察抑菌效果,测量抑菌圈直径。
1.2.7小诺霉素生物检测法。二剂量法[10]。
1.2.8小诺霉素组分比检测。采用硅胶薄层层析法检测,V(氯仿)∶V(甲醇)∶V(氨)= 2∶1∶1展层,碘显色。
2结果与分析
2.1链霉素抗性突变株的制备
2.1.1自然选育结果。
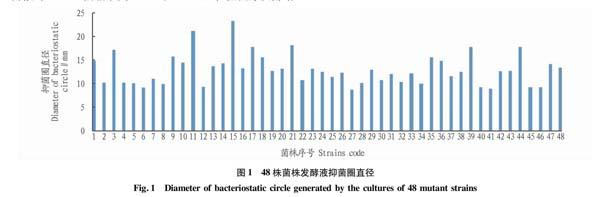
从涂布有小单孢菌XDBJ-CF单孢子悬浮液的高氏平板(37 ℃培养9 d)上随机挑48株(分别编号XDBJ-CF-X)进行摇瓶发酵,其发酵液的抗菌活性测定结果如图1所示。在所选的48株菌种中,图1中15号菌株所对应的小单孢菌XDBJ-CF-09的抗生素发酵产率最高,利用牛津杯法测得其抑菌圈直径达23.3 mm。试验将该菌作为紫外诱变的出发菌株。
2.1.2链霉素最低抑菌浓度的测定。
链霉素对XDBJ-CF-09菌株孢子最低抑菌浓度测定结果如下:5 μg/mL时菌株生长良好,10 μg/mL时菌株长势一般,12 μg/mL时菌株长势一般,14 μg/mL时菌株长势一般,16 μg/mL时菌株长势微弱,18 μg/mL时菌株长势微弱,20 μg/mL时菌株不生长,22 μg/mL时菌株不生长。
当链霉素浓度低于14 μg/mL时,菌株长势基本正常;随着链霉素浓度的增加,菌株生长受到抑制,在筛选平板上的单菌落明显减少;当链霉素浓度达20 μg/mL时,筛选平板上无单菌落形成,故链霉素对XDBJ-CF-09菌株的最小抑制浓为20 μg/mL,以此作为抗性筛选的条件。
2.1.3紫外诱变最适照射剂量选择结果。
XDBJ-CF-09菌株的单孢子悬液经过不同时间的紫外照射后进行适当稀释,涂布于含20 μg/mL链霉素高氏平板上,用黑纸包裹住,防止光复活作用。随着照射剂量加大,致死率逐渐递增,当照射时间为60 s时,致死率达82.16%,当照射时间为90 s时,致死率达100%。该研究确定致死率82.16%的照射时间为最适紫外照射剂量(图2)。
2.1.4获取链霉素抗性突变株。
经60 s紫外照射的单孢子悬液涂布在含最低抑菌浓度的链霉素高氏平板上,37 ℃避光培养9 d,长出的突变株为链霉素抗性突变株,共计201株。
2.2链霉素抗性高产突变株的筛选
将201株抗性突变株分别接入高氏斜面培养基中,37 ℃培养9 d,通过摇瓶初筛,经生物检测法检测发酵单位,以诱变出发菌株的发酵单位设定为100%,换算突变株的相对发酵单位,筛选和检测试验结果如表1。
根据表1的统计结果,分别以相对发酵单位90%~110%为发酵单位未突变型,相对单位在90%以下为发酵单位负突变型和相对单位在110%以上为正突变型,3种类型分布频率分别为33.83%、31.34%和34.83%,统计结果见图3。
由图3可知,小诺霉素发酵单位正突变型大于负突变型,其中发酵单位比诱变出发菌株提高30%以上的达到总菌株数的7.96%。
2.3突变株高产菌株小诺霉素组分比测定
根据摇瓶初筛结果,选取比诱变出发菌株发酵单位提高30%以上的高产突变株16株进行摇瓶复筛,测定小诺霉素组分比,其测定结果见表2。
由表2可知,小诺霉素组分比C 2b∶C 1a较对照(CK)菌株XDBJ-CF-09提高的有2株:XDBJ-CF-09-24和XDBJ-CF-09-90,這2个菌株的C 2b∶C 1a的组分比分别达到7∶3和6∶4,C 2b较出发菌株提高10%和20%。2个菌株小诺霉素产量分别比出发菌株提高37.8%和46.3%。
3结论
该试验在紫外诱变的基础上,利用抗生素抗性筛选技术获得链霉素抗性基因突变株201株,通过发酵筛选获得2株发酵单位较出发菌株提高30%以上,组分比中C 2b组分较出发菌株提高10%以上的小单孢菌高产突变株。试验结果显示了与相关文献[11-12]采用链霉素抗性筛选法取得正突变概率高于负突变的一致结果,表明链霉素抗性筛选方法在小诺霉素素高产菌株选育中具有应用价值。
该试验仅对XDBJ-CF-09菌株抗性突变株的高产菌株进行了摇瓶筛选,上罐发酵试验还在进行之中。
参考文献
[1] 王锦,段学辉,黎俊,等.利用抗自身代谢物特性进行小诺霉素高产菌种选育[J].南昌大学学报(工科版),2006,28(2):111-114.
[2] 管光瑜,廖崇娟,焦军,等.庆大霉素产生菌棘孢小单孢菌孢子发芽的研究[J].抗生素,1981,6(1):14-16.
[3] 刘均忠,李方林,张剑飞.小诺霉素生产菌株选育及发酵工艺改进的研究[J].山东医药工业,2001,20(4):5-7.
[4] 涂国全,钟承赞,黄林,等.通过获得链霉素抗性基因突变株筛选小诺霉素高产菌株[J].微生物学通报,2004,31(4):19-22.
[5] 刘体颜,邢玉华,戴素琴,等.达托霉素生产菌(ATCC31568)的紫外诱变和抗生素抗性筛选[J].中国抗生素杂志,2013,38(9):664-669.
[6] 戴菲,李瑾,黄运红,等.抗性筛选在抗生素高产菌选育中的应用[J].安徽农业科学,2011,39(12):7248-7249,7377.
[7] 孙玉雯,崔承彬.抗生素抗性筛选在微生物菌株选育中的作用[J].国际药学研究杂志,2008,35(3):213-217.
[8] 陶纯长,谌颉,郭美锦,等.链霉素抗性突变理性筛选avermectin 高产菌株[J].中国抗生素杂志,2002,27(9):521-523,528.
[9] 王慧媛,王泽建,黄明志,等.CO 2对脱氮假单胞菌发酵生产维生素B 12的影响[J].华东理工大学学报(自然科学版),2010,36(4):499-505.
[10] 王瑶函,胡永红,杨文革,等.N+低能离子注入与亚硝酸钠复合诱变筛选子囊霉素高产菌株的研究[J].中国酿造,2012,31(4):137-140.
[11] HOSOYA Y,OKAMOTO S,MURAMATAU H,et al.Acquisition of certain streptomycinresistant(str)mutations enhances antibiotic production in bacteria[J].Antimicrob agents chemother,1998,42(8):2041-2047.
[12] 陈宏,张祝兰,孙菲,等.链霉素抗性突变理性筛选新霉素高产菌株[J].生物技术通报,2014,31(12):173-176.

