苏博美利奴羊皮肤组织中WNT2 基因的DNA 甲基化与表达量分析
杨雪梅 ,徐新明,付雪峰,杜建文,王 丹,田月珍,田可川*,黄锡霞*
(1.新疆农业大学动物科学学院,新疆乌鲁木齐 830052;2.新疆畜牧科学院畜牧研究所新疆绒毛用羊遗传育种与繁殖重点实验室,新疆乌鲁木齐 830011)
毛发是毛囊生长发育的产物,是重要的动物产品和纺织原材料。毛囊是皮肤的衍生物,其结构和特性决定了毛发的品质及产量[1]。毛囊的生长发育是一个复杂且长期的生理过程,受多种物理因素[2]、多种分子及信号通路[3]调控,而基因表达是影响动物毛发生长发育的决定性因素之一[4]。因此,了解毛囊发育相关基因的功能有助于深入了解毛囊发育的分子调控机制。有研究表明,WNT 信号通路参与了毛囊生长发育过程中的多个重要环节,且对毛囊干细胞的调控至关重要[5]。WNT2基因是目前研究最广泛且能激活经典通路的WNT 信号之一[6],并参与了细胞增殖、分化和凋亡的调节,与癌症有密切关系[7]。WNT 信号通路中的WNT2在毛囊形态发生中起到重要作用[8]。因此,推测WNT2基因可能是绵羊羊毛性状的潜在候选基因。
表观遗传学修饰是指在基因的核苷酸序列不发生改变的情况下,通过某些机制决定基因表达,并引起细胞表型的变化,从而影响到生命活动。影响基因转录的表观遗传学调控包括DNA 甲基化、组蛋白修饰、染色质重构等[9]。DNA 甲基化是基因表达调控中的重要问题,也是遗传学和繁殖领域的重要问题。DNA 甲基化是最早被发现也是目前研究最深入的表观遗传修饰之一。有研究表明,在家畜生长发育过程中,DNA 甲基化参与许多代谢过程[10],并且DNA 甲基化在家畜中已被广泛研究。
本研究以苏博美利奴羊为研究对象,分别从表观遗传和分子遗传2 个方面来分析皮肤组织中WNT2基因的DNA 甲基化程度与表达量之间的关系,旨在探讨DNA 甲基化对羊毛性状发育调控的影响,以期填补细毛羊DNA 甲基化研究领域的空白,为细毛羊重要经济性状的相关标记辅助选择工作提供有效的表观遗传标记。
1 材料与方法
1.1 实验动物 实验动物为新疆巩乃斯种羊场所提供的健康无病、体况均匀的周岁苏博美利奴母羊,分别选取5 只平均纤维直径为16.90 µm(极细组)和5 只平均纤维直径为19.53 µm(极粗组)的周岁苏博美利奴母羊,采集其左侧肩胛部皮肤2 cm×2 cm 组织样品并用液氮冷冻保存备用。
1.2 主要试剂和仪器 TIANamp Genomic DNA Kit(DP304)、TIANquick Midi Purification Kit(DP204-02)购自天根生化科技有限公司(北京);EZ DNA Methylation-GOLD Kit(D5005)、ZymoTaqTMPreMix(E2003)购自ZYMO Research 公司;EvaGreen Express 2×qPCR MasterMix-Low Rox、5X All-In-One MasterMix (with AccuRT Genomic DNA Removal Kit)购自ABM(加拿大);pMD19-T Vector Cloning Kit(6013)、E.coli JM109 Competent Cells(9052)购自TaKaRa 公司(大连);TRIzol RNA分离试剂、Amp、胰蛋白胨、酵母提取物、DL 2000 DNA Marker、琼脂糖、6×Loading Buffer 等。
主要使用仪器有ZHJH C1112B 型超净工作台、Light Cycler2.0 荧光定量PCR 仪、NANODROP 2000型分光光度计、BIOFUGE PRIMOR 型低温离心机、DNP-9082A 型电热恒温培养箱、ZHWY-2102C 恒温培养振荡器、凝胶成像仪等。
1.3 实验方法
1.3.1 基因组DNA 提取及亚硫酸氢盐修饰 根据TIA Namp Genomic DNA Kit(DP304)说明书对10 只苏博美利奴羊个体的皮肤组织进行基因组DNA 提取,并使用1% 琼脂糖凝胶电泳检测。将检测合格的基因组DNA 按EZ DNA Methylation-GOLD Kit(D5005) 说明书进行亚硫酸氢盐修饰。
1.3.2 CpG 岛预测及引物设计 利用在线软件MethPrimer预测从NCBI 获得的绵羊WNT2基因第5 外显子及前后100 bp 序列的CpG 岛并设计BSP 引物(WNT2-bsp),并根据NCBI 上公布的绵羊WNT2基因(登录号:NM_001195319.1)与基因(登录号:NM_001190390.1)的序列,利用Primer Premier 5.0 软件进行定量引物设计,最后由上海生工生物工程有限公司合成,引物信息见表1。
1.3.3 PCR 扩增及产物纯化 对目的基因WNT2进行PCR扩增,总反应体系25 μL:ZymoTaqTMPreMix 12.5 μL,上、下游引物(10 μmol/L)各0.5 μL,DNA 模板 2 μL,用RNase-free ddH2O 补至25 μL。扩增程序为95℃预变性10 min,变性94℃ 30 s,退火53.8℃ 30 s,延伸72℃30 s,共40 个循环,72℃ 7 min,4℃ 5 min。随机选择PCR 产物取2 μL 与3 μL 的6×Loading Buffer 混匀,经2% 琼脂糖凝胶180 V 电泳25 min,以DL2000 为Marker 来标记产物片段的大小;之后使用凝胶成像仪进行照胶,若获得的产物片段与预期片段大小一致,根据TIANquick Midi Purification Kit(DP204-02)说明书对PCR 产物进行纯化。

表1 引物序列信息
1.3.4 克隆及DNA 甲基化序列分析 根据pMD19-T Vector Cloning Kit(6013)说明书,取3.5 µL 纯化产物与pMD19-T 载体连接,并转化至JM109 感受态细胞,涂布于LA 固体培养基,37℃过夜培养。每个样本挑取3 个阳性单克隆接种至LB 液体培养基中过夜培养,经菌液PCR 鉴定后送至上海生工生物工程有限公司测序。
1.3.5 总RNA 提取及反转录成cDNA 取50~100 mg 样品于液氮中研磨成粉末状,使用TRIzol 法进行总RNA的提取。使用核酸检测仪对其浓度与纯度进行检测,使用1% 琼脂糖凝胶电泳检测其完整性,根据5X All-In-One MasterMix 说明书对合格的RNA 样品进行反转录。
1.3.6WNT2基因的表达量研究 以GAPDH为内参基因,以反转录的cDNA 为模板,根据EvaGreen Express 2×qPCR MasterMix-Low Rox 说明书进行实时荧光定量PCR,总反应体系20 μL:EvaGreen Express 2× qPCR MasterMix 10 μL,上、下游引物(10 μmol/L)各0.6 μL,cDNA 1 μL,ddH2O 7.8 μL。反应程序为95℃预变性30 s,95℃ 5 s,60℃ 30 s,95℃ 5 s,共40 个循环,65℃ 5 s,95℃ 5 s。每个样品均为3 个生物信息学重复。
1.3.7 统计分析 使用SPSS19.0 软件独立样本T 检验对表达量结果进行差异比较,P<0.05 被认为有统计学意义。
2 结果与分析
2.1 CpG 岛预测 通过在线软件MethPrimer 预测分析发现苏博美利奴羊WNT2基因第5 外显子及前后100 bp的DNA 序列有1 个CpG 岛,其具体位置是220~354 bp,长度为135 bp,CpG 岛具体位置见图1。

图1 WNT2 基因的CpG 岛预测图
通过在线软件MethPrimer 预测发现WNT2基因的CpG 岛,并针对该区域设计了甲基化引物,发现目的片段在160~389 bp,产物大小在230 bp,如图2 所示,该片段共包含13 个潜在的DNA 甲基化位点,GC 含量为53.85%。

图2 WNT2 基因甲基化区域预测序列
2.2 不同细度苏博美利奴羊WNT2基因的DNA 甲基化模式分析和序列比对
2.2.1 苏博美利奴羊WNT2基因经亚硫酸氢盐修饰后的扩增结果 使用引物WNT2-bsp进行扩增,将PCR 产物经2%琼脂糖凝胶电泳检测,如图3 所示,在230 bp处获得单一的目的条带,且没有引物二聚体,符合预期片段大小,可用于后续实验。

图3 亚硫酸氢盐修饰后WNT2 基因扩增产物检测
2.2.2 苏博美利奴羊WNT2基因的序列比对 对苏博美利奴羊皮肤组织中WNT2基因第5 外显子及前后100 bp 序列进行DNA 甲基化分析,根据未甲基化的胞嘧啶经亚硫酸氢盐处理后被转化为胸腺嘧啶,而甲基化的胞嘧啶经亚硫酸氢盐处理后不被转化为胸腺嘧啶的原理,分析不同细度苏博美利奴羊WNT2基因的甲基化模式,见图4,经序列比对结果发现共有13 个CpG 位点,与Meth Primer 软件预测的结果一致。
2.2.3 不同细度苏博美利奴羊皮肤组织中WNT2基因的DNA 甲基化水平 分别对极细组和极粗组的苏博美利奴羊WNT2基因挑取3 个阳性单克隆进行测序,经序列比对,结果如图5 所示。通过计算发现极细组和极粗组的CpG 位点的DNA 甲基化水平均较高且差异不显著,分别为92.31%、88.21%。
以极细组的甲基化水平为对照,对每个CpG 位点的DNA 甲基化水平计算,结果如表2 所示,CpG4、CpG9 以及CpG10 在2 组中的甲基化水平一致,均为93%,而极粗组的CpG2、CpG3 的甲基化水平高于极细组,其余位点的甲基化水平均低于极细组。
2.3 不同细度苏博美利奴羊皮肤组织中WNT2基因的表达量研究 由图6 可知,极细组的表达量较极粗组高出1.88 倍(P<0.05),并且WNT2基因在2 组中的mRNA 表达量与甲基化水平的变化趋势一致。
WNT2基因的每个CpG 位点在不同细度苏博美利奴羊皮肤组织中的甲基化水平各不相同,其中,CpG11位点在2 组中的甲基化水平差异最大。对极细组与极粗组的10 个苏博美利奴羊个体的每一个CpG 位点与表达量进行相关性分析,通过表3 发现,CpG11 位点的甲基化水平与表达量之间呈现显著正相关(P<0.05,r=0.693)。
3 讨 论
图4 WNT2 基因甲基化区域测序峰图

图5 不同细度苏博美利奴羊皮肤组织中WNT2 基因的甲基化模式图
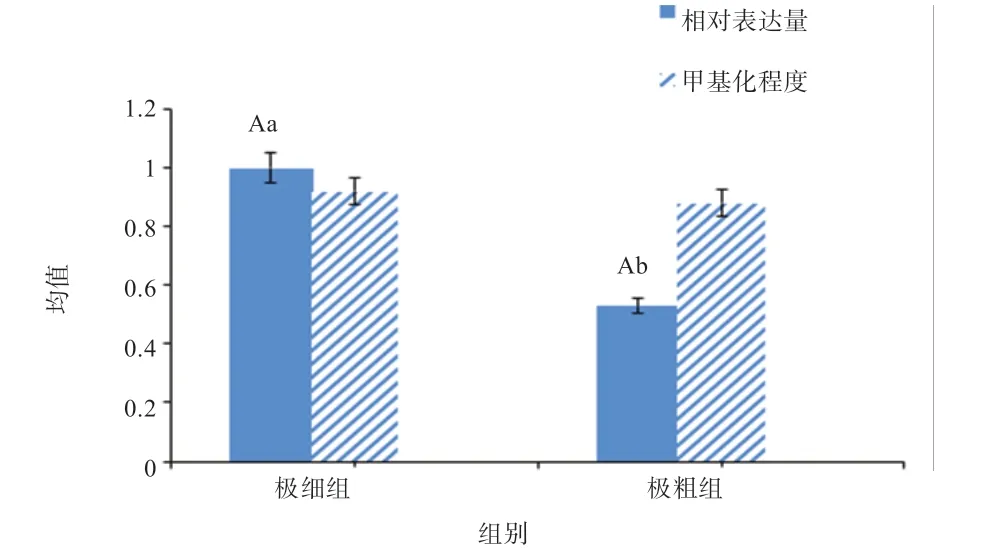
图6 不同细度苏博美利奴羊皮肤组织中WNT2 基因的表达量及甲基化程度
毛囊的发生发育对羊毛的产量与质量有重要影响,毛囊的发育过程非常复杂。WNT 家族编码大量分泌蛋白,作为信号蛋白在细胞间传递,影响细胞的分化、增殖、迁移,参与多种组织器官的发育[11]。谭强等[12]研究表明,WNT2基因的表达量随着胎儿发育逐渐增高,说明WNT2基因是调控山羊胎儿早期发育的一个关键因子。赵博昊[13]利用高通量测序技术筛选出与獭兔毛色相关的基因及信号通路,通过验证发现WNT2基因与毛色形成相关。FGF5对毛囊的发育有抑制作用,而冯新宇等[14]利用CRISPR/Cas9 系统敲除绵羊皮肤成纤维细胞WNT2基因,结果发现WNT2基因表达量极显著下调,FGF5基因表达量显著上调,说明WNT2对FGF5有抑制作用,从而导致WNT2基因敲除后抑制了毛囊的生长发育,表明WNT2基因对毛囊的生长发育具有促进作用。本研究发现WNT2基因在极细组的表达量显著高于极粗组,表明WNT2基因可能参与羊毛纤维直径的形成,对羊毛纤维直径的大小有影响。
基于对DNA 甲基化与基因表达的深入研究发现,DNA 甲基化在人类的生长发育、疾病发展过程中的作用机制逐渐被揭示,同时对动植物DNA 甲基化功能的研究,可为后续动植物的繁育工作提供改良依据。Li 等[15]展示了鸟类的全基因组DNA 甲基化图谱,并揭示了鸡的甲基化模式,发现鸡基因组中的大多数CpG 岛保持未甲基化状态。Lan 等[16]在成年山羊中发现Dnmt3b基因5'区域的第11 个CpG-二核苷酸基因座的DNA 甲基化与体重之间存在显著关联。姚力丹等[17]分析了肌肉生长抑制素(MSTN)基因在肌肉和脂肪中的DNA 甲基化模式及mRNA 表达水平,结果表明巴什拜羊肌肉和脂肪MSTN基因DNA 甲基化水平与MSTN基因表达量呈显著负相关。Bai 等[18]研究表明辽宁绒山羊毛发生长初期毛囊中HOXC8外显子1 的甲基化程度可能参与调控辽宁绒山羊羊绒纤维的生长。本研究发现WNT2基因在极细组和极粗组中的甲基化程度均较高,为进一步研究WNT2基因与羊毛纤维直径的关系提供了基础资料。

表2 不同细度苏博美利奴羊皮肤组织中WNT2 基因的CpG 位点的DNA 甲基化水平 %

表3 WNT2 基因mRNA 表达量与CpG 位点的相关性
通常情况下,启动子区域高度甲基化的基因表现出低的表达水平,而低度甲基化的基因表现出高的表达水平,说明DNA 甲基化会抑制基因的转录过程[19-21]。然而,外显子区域甲基化水平的作用机制与启动子区域有所不同。有研究表明,基因最后一个外显子的甲基化强度,以及基因的上游和下游区域的甲基化水平对转录水平的影响大于启动子的甲基化水平对转录的影响[22]。阮亦麒等[23]研究发现RARRES1基因第1 外显子的CpG9 与CpG16 的甲基化水平与RARRES1基因在香猪高产仔组的较高表达水平有关。何小龙等[24]研究发现乌珠穆沁羊GDF11基因外显子1 甲基化水平对其表达有促进作用。本研究发现WNT2基因在极粗和极细组中的表达量与甲基化水平的变化趋势一致,与前人研究[23-24]结果一致。可能是由于本研究设计引物选择了WNT2基因的第5 外显子区域,WNT2基因的第5 外显子区域是最后一个外显子,该区域的DNA 甲基化水平对转录水平的影响大于启动子区域。本研究表明,WNT2基因在2 组中的DNA 甲基化水平均较高。同时,WNT2基因在苏博美利奴羊极细组的表达量显著高于极粗组,且CpG11 的甲基化水平与mRNA 表达量之间呈现显著正相关,表明WNT2基因的DNA 甲基化水平促进WNT2基因在苏博美利奴羊皮肤组织中的表达,并且DNA 甲基化水平对WNT2基因的表达有一定影响,推测苏博美利奴羊皮肤组织中WNT2基因通过DNA 甲基化修饰从而调节基因的表达,并调控了苏博美利奴羊的羊毛纤维直径,可作为一个候选的表观遗传标记。然而,阐明WNT2基因第5 外显子的DNA 甲基化水平调控苏博美利奴羊羊毛生长的分子机制需要进一步研究。
4 结 论
本研究发现WNT2基因在极细组和极粗组中的甲基化程度均较高,且2 组DNA 甲基化程度与表达量水平的变化趋势一致,同时,CpG11 位点的甲基化水平与mRNA 表达量之间呈现显著正相关,该位点与羊毛纤维直径有关,表明WNT2基因的DNA 甲基化水平对羊毛纤维直径有一定作用,可作为一个候选的表观遗传标记。

