敖汉细毛羊Noggin 基因质粒的构建及其在成纤维细胞中表达量的研究
荣 恒,张梦瑶,柳 楠,李 晶,贺建宁*
(1.青岛农业大学动物科技学院,山东青岛 266109;2.曲阜市畜牧兽医技术服务中心,山东济宁 273100)
随着人们生活水平的提高,对羊毛的需求量不断增加,对羊毛产量、质量的研究也显得越来越重要[1]。羊毛是毛囊的衍生物,同时羊毛的产量和质量取决于毛囊的性质和结构[2]。因此,想要更好地控制羊毛的性状发育特征,需要对毛囊发育规律和结构特征进行研究[3]。Noggin基因在1992 年首次被发现,由Smith 等[4]从非洲爪蟾的胚胎中分离得到。McMahon 等[5]于1998 年发现Noggin 作为一种重要的胚胎蛋白,其在小鼠的节点、脊索和背侧体节表达,并且发现它对神经管的生长有重要作用。与此同时,Noggin基因在胚胎发育过程中对神经有重要诱导作用,主要诱导外胚层的背侧发育[6]。Noggin基因不仅在神经系统发育中发挥关键作用,还是骨骼发育[7]、卵巢发育[8]和心脏中隔形成[9]等过程的重要调控基因。Noggin 可与骨形态发生蛋白结合,阻止其与相应受体结合,直接拮抗BMP4、BMP7、BNP2等基因,从而抑制BMP 信号通路[10]。资料显示[11],BMP基因家族在毛囊发育过程中起重要的抑制作用,如BMP2基因在毛囊生长的休止期表达量最高。而Noggin基因作为BMP 基因家族的抑制剂,在很多方面的功能作用都是基于抑制BMP 基因家族的活性从而对毛囊发育发挥间接的促进作用。其次Noggin作为抑制剂诱导次级毛囊发育[12],如果Noggin基因缺失,可能出现光秃现象。
目前,关于Noggin基因的研究大多集中于调节肿瘤、癌症等方面,与细毛羊毛囊有关的较少。而对于毛囊相关的基因研究,大部分仅在分子水平上对其功能进行了验证。因此,本实验对Noggin基因在细胞中的表达量进行研究,有助于进一步了解Noggin对羊毛产生的影响。
1 材料与方法
1.1 实验动物 选取40 日龄的敖汉细毛羊健康胎羊(由青岛畜牧所奥特种羊场提供)并及时消毒处理。
1.2 实验试剂及仪器 TRIZol(Roche)试剂、蛋白裂解液、Nhel、Kpnl限制性内切酶、T4 DNA 连接酶、T载体、pcDNA3.1 质粒、DH5α感受态细胞、DMEM(基础培养基)、胰蛋白酶、标准胎牛血清、DPBS(磷酸缓冲盐溶液)、Lipofectamine 2 000、反转录试剂盒、切胶回收试剂盒、质粒提取试剂盒、培养皿等均购自青岛尚赛科贸有限公司。BB5060UV 型贺氏二氧化碳培养箱购于德国Eppendorf 公司,LG16-W 高速微量离心机、Leica DMIRB 型倒置显微镜购于青岛鑫恒一有限公司,BSW-1360V 垂直洁净工作台购于青岛赛尚科技有限公司,Redbio CFX ConnectTM荧光定量PCR 系统购自Bio-Rad 公司。
1.3 实验方法
1.3.1 PCR 扩增 RNA 提取并反转录后,根据NCBI 收录的绵羊Noggin基因组序列(登录号为NM_00117411 0.1)CDS 区外侧通过Primer 5.0 设计引物,并在上游引物和下游引物的5'末端分别添加NheI、KpnI限制性酶切位点及保护碱基(下划线序列)。完成后的引物序列为:上游引物:5'-CTAGCTAGCACAGACCTTCTGCC TCACTACC-3';下游引物:5'-CGGGTACCTTCACCG GACGATCCTTCT-3'。通过PCR 扩增后进行琼脂糖凝胶电泳检测,体系为25 μL:DNA 模板1 μL,上下游引物各1 μL,Green Mix 12.5 μL,ddH2O 9.5μL。
1.3.2 TA 克隆 DNA 通过琼脂糖凝胶电泳切胶回收,T载体连接体系为:T4 DNA 连接酶1 μL,T4 DNA 连接酶Buffer 1 μL,T 载体2 μL,目的片段6 μL;混匀置于26℃金属浴中2 h 后4℃过夜,将10 μL T 连接液加入到100 μL DH5α感受态细胞中,混匀后冰上静置15 min;42℃热激90 s 后重新冰上静置20 min;加入800 μL LB基础培养基(不含AMP 抗生素)37℃、200 r/min 震荡培养1 h,离心后去除上清,吹打混匀细胞,将细胞涂布在含AMP 抗生素的平板上,在37℃条件下培养12 h,然后挑单菌摇菌后测序。
1.3.3Noggin基因与pcDNA3.1 载体连接 利用Nhel、Kpnl限制性内切酶对TA 克隆载体及pcDNA3.1 载体同时进行双酶切,体系为:Nhel限制性内切酶1 μL,Kpnl限制性内切酶1 μL,TA 克隆载体和pcDNA3.1 10 μL,Buffer1 μL,补水至50 μL 体系;37 ℃ 3 h,通过琼脂糖凝胶电泳对Noggin基因及切开的pcDNA3.1质粒进行切胶回收,取5 μLNoggin基因液体,4 μL pcDNA3.1,加入到含有1 μL T4 DNA 连接酶及1 μL T4 DNA 连接酶Buffer 的PCR 管中22 ℃ 2 h,之后16℃反应3 h,最终转至DH5α感受态细胞,选取摇菌后的单菌落对其进行阳性率测定,经测序、质粒提取获得阳性质粒。
1.3.4 成纤维细胞的培养 用75%酒精浸洗两遍从羊场取回的40 日龄胎羊(自母羊妊娠后40 日龄的未出生羊)之后,在培养皿中用75% 的酒精再次清洗3 遍,最后用含有双抗的PBS 反复清洗3 遍。之后用剪刀剪掉头部和四肢,然后将躯干剪成1.5 mm3左右,将其放在培养皿,加胎牛血清,在CO2浓度为0.05、温度37℃的培养箱中培养4 h,再加培养液。从培养箱取出24 h 后,用PBS 冲洗干净,更换培养液,定时观察。细胞生长到95%左右进行传代培养。
1.3.5 细胞转染 在传代后2 代进行转染。用Lipofecta mine 2 000 进行瞬时转染,实验组和对照组分别加20 μL脂质体试剂和480 μL DMEM(不含双抗),混匀,静置10 min,在实验组中加入40 μL 构建好的表达载体和460 μL DMEM(不含双抗),对照组仅加入500 μL DMEM,静置20 min,然后将实验组和对照组都移到培养皿中均加入4 mL DMEM,在37℃条件下,培养6 h后换液,之后培养36 h。
1.3.6 细胞转染后的RT-PCR 扩大培养转染成功的单细胞,细胞在培养皿底部长到95% 时,每个板加TRIZol(Roche)试剂3 mL,细胞裂解后进行RNA 提取。RNA 提取完成后,测定浓度和纯度符合标准后将其反转录成cDNA。通过Primer Premier 5.0 软件设计Noggin和GAPDH基因的引物序列见表1。实时荧光定量PCR 反应程序:95℃预变性7 min;95℃变性40 s,60℃退火40 s,72℃延伸30 s,共45 个循环。样品各进行3 次重复,采用Ct(2-ΔΔCt)值法计算Noggin相对于内参基因GAPDH的表达量。利用SPSS17.0 软件中t检验对数据进行分析。

表1 引物信息
1.3.7 细胞转染后Western Blot 检测Noggin基因蛋白表达 利用蛋白质印迹法(Western Blotting)将样品分为实验组和对照组,每组3 个生物学重复。先裂解提取细胞中的蛋白质,内参基因GAPDH、目的基因Noggin分别点3 个胶孔,电泳后对蛋白质进行PVDF 转膜,用转膜电泳槽进行2~3 h,之后封闭蛋白质2 h;TBST 洗膜3 次,每次5 min;按1:2 000 的比例对一抗进行稀释,在4℃冰箱用一抗孵育PVDF 膜12 h;用TBST 洗膜3次,每次5 min。按1:2 000 的比例稀释二抗,孵育1.5 h;在暗室中曝光。用Image J 软件分析条带,结果用SPSS统计分析软件进行分析。
2 结果
2.1Noggin目的基因扩增 图1 为PCR 后凝胶电泳分析结果(2%琼脂糖凝胶),结果显示扩增条带单一明亮,大小位于699 bp 处,与已知大小一致。
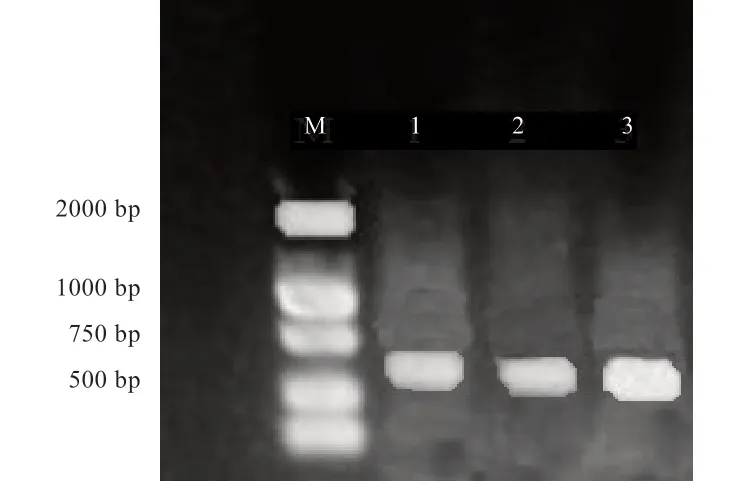
图1 Noggin 基因PCR 扩增
2.2 克隆载体的提取 对pGM-T-Noggin进行提取,结果如图2 所示,pGM-T 载体大小为3 015 bp、目的基因大小为699 bp,连接后条带位于3 714 bp 处,与已知大小相符,表明克隆载体连接并提取成功。

图2 克隆载体的鉴定
2.3 TA 克隆测序比对 图3 为测序后比对结果,碱基没有发生突变,可用于后续实验。
2.4 克隆载体、pcDNA3.1 表达载体双酶切 图4 为双酶切结果,目的基因为699 bp,pGM-T 为3 015 bp,表达载体pcDNA3.1 为5 427 bp。图4 所示条带与以上数据相符合,酶切成功。
2.5 表达载体pcDNA3.1 构建及鉴定 菌液PCR 结果如图5 所示,在699 bp 位置处有明亮清晰且单一的条带,证明pcDNA3.1-Noggin构建成功。
2.6 细胞培养 细胞生长观察结果如图6 所示,其中原代培养细胞为梭形、圆形,此外还有一些游离组织;传代培养细胞全部为成纤维细胞,形态上为梭形。
2.7 实时荧光定量PCR 检测mRNA 的表达 从转染后的成纤维细胞中提取RNA 后反转录成cDNA,以其为模板对目的基因Noggin和内参基因GAPDH片段同时进行PCR 扩增。2%琼脂糖凝胶电泳结果如图7 所示,扩增的条带单一明亮,GAPDH产物大小为125 bp、Noggin产物大小为128 bp,与已知大小均相同,可继续实时荧光定量PCR 实验。
图8 为实时荧光定量扩增曲线和熔解曲线,曲线清晰且只有一个峰值,表明在实时荧光定量PCR 过程中无二聚体且得到了特异性的扩增产物,可用来进行定量分析。利用SPSS 对2 组mRNA 的表达量进行测定和分析,结果如图9 所示,转染组极显著高于未转染组(P<0.01)。
2.8 Westren Blot 检测蛋白的表达 由图10 可知,转染的实验组条带明显比未转染的对照组粗,由Image J 软件分析灰度值,灰度值用SPSS 分析。由图11 可知,转染组Noggin 表达量极显著高于未转染的对照组,表明质粒pcDNA3.1-Noggin能高效表达Noggin基因。
3 讨 论
关于毛囊的研究以往主要集中在出生后和成年绵羊身上[13],Stenn 等[14]在成年绵羊身上对毛囊的周期性生长变化展开研究;近年来,柳楠等[15]在分子水平上研究了敖汉细毛羊羊毛性状形成的机理;王小佳等[16]在分子水平上探究了羊毛的生长部位。由于大多数前人研究都集中在分子水平上,而在细胞水平上与毛囊生长发育相关的研究甚少。因此本实验选择在细胞水平上对Noggin基因功能进行验证。
Noggin 作为一种重要的胚胎蛋白,对神经管的生长具有重要作用,在胚胎发育过程中起神经诱导作用,近年来发现它对多个系统有影响。范晓棠等[17]研究发现Noggin基因在大鼠神经系统发育过程中表达,也是骨骼发育过程中的重要调节因子。BMPs 可以促进骨生长,增加骨量,可治疗骨量减少所引起的疾病,例如骨折和骨质疏松等,但如何控制BMPs 的量则需要Noggin等因子来调节。

图3 TA 克隆测序比对

图4 克隆载体及pcDNA3.1 载体双酶切
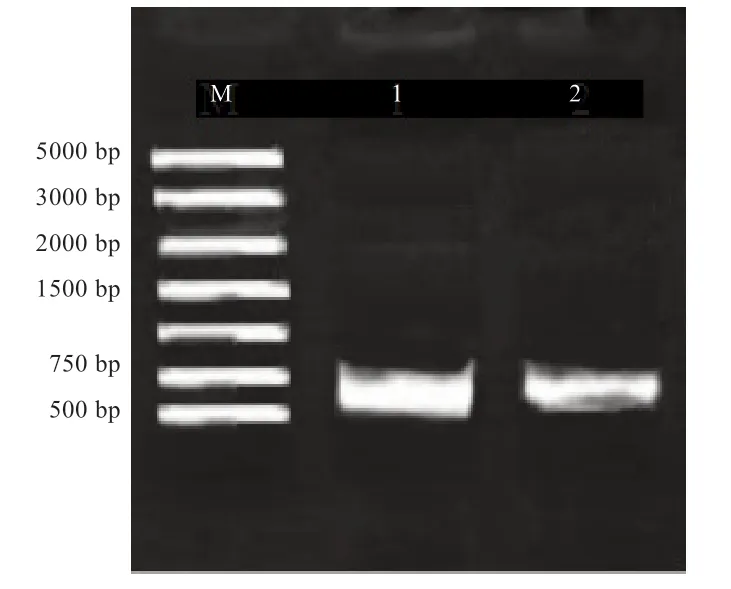
图5 表达载体pcDNA3.1 的鉴定-PCR 扩增

图6 成纤维细胞原代、传代培养

图7 内参基因GAPDH(A)目的基因Noggin 扩增产物(B)
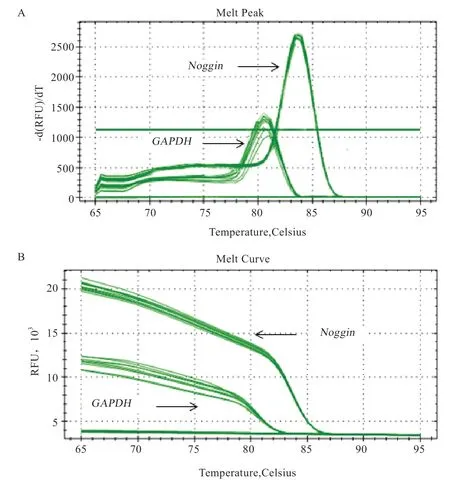
图8 Noggin 和GAPDH 熔解曲线峰值图(A)和扩增曲线图(B)

图9 Noggin 基因mRNA 相对表达量

图10 实验组和对照组蛋白表达条带

图11 Noggin 蛋白相对表达量
1999 年,Botchkarev 等[18]研究发现有2 种扰乱毛囊诱导并引起脱发的途径,BMP4 异位过表达和BMP抑制剂Noggin的靶向干扰。Noggin作为刺激HF 诱导的关键信号分子,主要通过2 种途径发挥作用,一种是与BMP4 拮抗作用,另一种是下调75 KD 神经营养因子受体。2002 年Botchkarev 提出了Noggin在雌性动物生产后 HF 生长期发挥作用。由他的研究可得知,无论是胚胎期还是出生后,Noggin都会中和BMP4 的抑制活性。在胚胎时期,Noggin就开始诱导HF[19]。Noggin对细胞内的 BMP 信号起抑制作用,BMP 信号被抑制,LEF1 信号则会表达,继而引起Wnt 信号的恢复。在这个循环过程中,毛囊干细胞中BMP 信号会随着Noggin的变化而产生相应的变化,从而导致生长周期的启动。因此,本实验通过对目的基因Noggin的克隆,并构建其表达载体。通过转染实验后对mRNA 及蛋白的表达量进行测定,结果表明,实验组表达量均极显著高于对照组。
4 结 论
本实验通过对目的基因Noggin的TA 克隆,表达载体pcDNA3.1-Noggin的构建,转染成纤维细胞后进行实时荧光定量PCR 技术和Westren Blot 技术检测Noggin基因在成纤维细胞中的表达,结果表明,实验组均极显著高于对照组,为今后Noggin功能的鉴定研究提供了基础。

