畜禽养殖废水来源的自养氨氧化菌筛选及氨氮去除效果研究
孙 宏 ,张 恒,2,王 新,李园成,汤江武*,吴逸飞,姚晓红,沈 琦,葛向阳
(1.浙江省农业科学院植物保护与微生物研究所,浙江杭州 310021;2.华中农业大学生命科学与技术学院,湖北武汉 430030)
畜禽养殖业的规模化、集约化发展带来了大量含有高浓度氨、磷污染物的养殖废水,若处置不当将导致严重的环境问题,威胁人类健康。当前畜禽养殖废水的脱氮技术主要以基于相关功能微生物的生化反应措施为主。其中,自养氨氧化菌在氮素循环中扮演了极其重要的角色,其主导的将氨氮(NH4+-N)转变为亚硝酸盐氮(NO2–-N)过程为整个生物脱氮反应的关键限速步骤,而该步骤也是一种较为可行的处理NH4+-N 的措施[1-2]。目前,国内外研究已在农田土壤、污水处理厂、植物根际、人工湿地等来源相继发现自养氨氧化菌的存在[3-4]。由于不同环境下的自养氨氧化菌的多样性及生态活性均有显著差异,因而筛选分离不同来源或针对不同处理水体的氨氧化菌仍具有显著现实意义[5]。特别是当前畜禽养殖废水由于NH4+-N 含量显著高于普通污染水体,但目前有关从养殖废水中筛选自养氨氧化菌的研究仍较少,对其处理效果也尚未明确。
本研究拟在采用变性梯度凝胶电泳技术(DGGE)监控自养氨氧化功能菌群变化的基础上,从处置畜禽养殖废水的活性污泥中筛选自养氨氧化菌,并初步评价筛选获得的菌株在养殖废水中的实际去除效果,以期为处理养殖废水、实现NH4+-N 的高效去除提供数据支持。
1 材料与方法
1.1 活性污泥与富集培养基 本试验所用活性污泥与养殖废水均采自安吉吉成牧业有限公司养殖废水综合处理工程。其中,养殖废水的NH4+-N、硝态氮(NO3–-N)、化学需氧量(COD)和pH 分别达到550 mg/L、25.4 mg/L、2190 mg/L 和7.8。
自养氨氧化菌富集培养基为基础液和(NH4)2SO4溶液(10 g/L)按9:1 的体积比配制而成。基础液为磷酸缓冲液100 mL、NaCl 0.3 g、MgSO4·7H2O 0.03 g、CaCl20.136 g、NaHCO30.5 g、CuSO4·5H2O 母液(0.187 g/L)、EDTA-Na 母液(3.958 g/L)、MnCl2·4H2O 母液(0.114 g/L)、CoSO4·6H2O 母液(0.31 g/L)、Na2MoO4母液(0.08 g/L)各1 mL,加去离子水定容至1 000 mL 后灭菌。其中,磷酸缓冲液为K2HPO441.076 g、NaH2PO42.721 g,加水定容至1 000 mL。(NH4)2SO4溶液,单独灭菌。
在液体富集培养基基础上加入1.5%琼脂粉并灭菌制备固体培养基。氨氧化富集培养基中的NH4+-N 浓度为212 mg/L。
1.2 自养氨氧化菌的富集培养 取100 mL 运行良好的液体活性污泥5 000 r/min 下离心5 min 去上清,用无菌生理盐水洗涤2 次后,定容至100 mL,取样50 mL于-20℃保存。剩余50 mL 污泥按照10%(v/v)的接种量接种至100 mL 自养氨氧化菌富集培养基中,于200 r/min、28℃下摇床培养,每隔 2 d 取样检测NH4+-N、NO3–-N、NO2–-N 浓度和pH,采用1 mol/L 的NaOH调节pH 维持在7.5,当发现体系NH4+-N 耗尽时,补加NH4+-N 至200 mg/L,当NH4+-N 再次耗尽时,取样50 mL 于-20℃下保存备提DNA,并进行10%转接到新的富集培养基中,重复上述富集转接操作4 次。
对于保存的富集转接样品采用水相提取试剂盒(PowerWater DNA Isolation Kit,MOBIO)进行DNA提取,使用带GC 夹子的amoA 基因引物(GC+amoA-1F:5 ' -C G C C G C G C G G C G G G C G G G G C G G G G G C G G G G T T TCTACTGGTGGT-3';amoA-2R:5'-CCCCTCKGSAA AGCCTTCTTC -3')[6],按照文献[7]的相应体系和扩增程序进行扩增后,放入4℃冰箱保存。amoA 基因的DGGE 电泳步骤参照张智超等[8]的报道进行,尿素变性梯度选用40%~60%,将amoA 基因PCR 产物取10 μL 上样,在60℃、120 V 下跑胶10 h,EB 染色30 min 后拍照。切割明亮条带用不带GC 夹子的amoA 引物扩增,电泳验证扩增成功后送交生工生物(上海)有限公司测序,用以评价富集培养的效果。
1.3 自养氨氧化菌的分离和鉴定 采用转接4 次后的富集培养液进行梯度稀释(10–2、10–3、10–4),涂氨氧化培养基平板培养7 d,挑取细小单菌落接种至含有20 mL 富集培养基的三角瓶中于200 r/min,30℃摇床培养3 d,使用Griess 试剂和二苯胺试剂检测是否有NO2–-N 和NO3–-N 的生成[9]。取NO2–-N 显色阳性而NO3–-N 显色阴性的菌株,进一步在富集培养基中经过3~5 次转接纯化培养,采用引物27F 和1492R 进行16S rDNA 测序鉴定[7]。测序结果递交NCBI 数据库进行Blast 程序对比,采用MEGA 7.0 软件选取同源性高的序列采用Neighbor-Joining 算法进行系统发育树的构建[7]。同时,筛选的自养氨氧化菌送省农科院检测中心进行透射电镜观察。
1.4 筛选菌株的原位硝化能力评定 接种终浓度为104CFU/mL的自养氨氧化菌至含有200 mL 灭菌养殖废水(5 倍稀释)的500 mL 三角瓶中,以不接菌的灭菌稀释废水为对照,在30℃、200 r/min 下恒温振荡培养,每天取样检测NH4+-N、NO3–-N 和NO2–-N 的含量。每组试验包含3 个重复,试验周期为5 d。氨氧化速率计算:v=(pt-p0)⁄t,式中,v为t时间内的NO2–-N 的生成速度,mg/(L·h);p0为初始NO2–-N 浓度,mg/L;pt为培养t时间后对应NO2–-N 的浓度,mg/L;t为培养或处理时间[7]。
1.5 水质检测方法 NH4+-N 检测方法采用《水质氨氮的测定-水杨酸分光光度法》(GB 7481-87);NO3–-N含量检测采用《水质硝酸盐氮的测定-紫外分光光度法》(HZ-HJ-SZ-0138);NO2–-N 的测定采用《水质亚硝酸盐氮的测定-分光光度法》(GB 7493-87);COD检测方法采用《水质化学需氧量的测定-重铬酸盐法》(GB 11914-89)。
1.6 统计分析 数据处理采用Excel 软件进行,除菌株筛选结果外,均以平均值±标准差表示。显著性分析采用SPSS 13.0 软件进行t检验,P<0.05 代表差异显著。
2 结果与分析
2.1 自养氨氧化细菌的富集培养 DGGE 及条带测序结果显示(图1、表1),自养氨氧化菌富集培养过程中,具有amoA 功能基因的微生物分布随着培养转接过程而发生变化。其中,条带A~C 所对应的亚硝化菌的浓度逐渐减低,而条带D 对应的亚硝化单胞菌属(Nitrosomonassp.)微生物的浓度在4 次富集后明显增加,成为富集液中优势菌株。
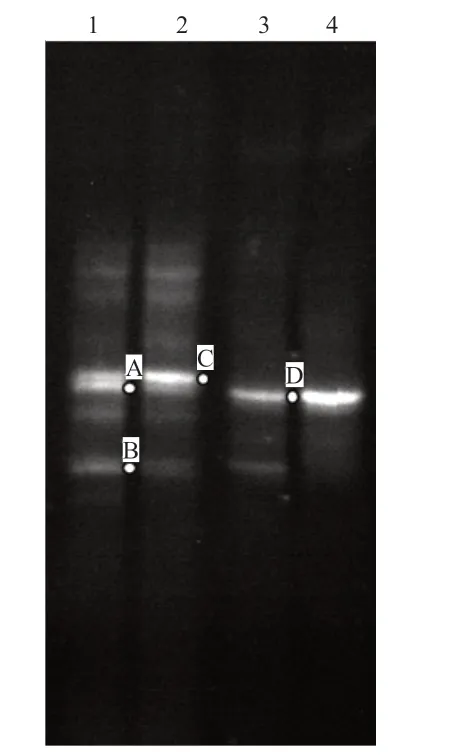
图1 自养氨氧化菌富集转接过程的DGGE 指纹图谱

表1 DGGE 条带测序结果
2.2 自养氨氧化菌的筛选和鉴定 经过富集培养后,从氨氧化平板上共挑到7 株菌落细小且为灰白或者乳白的菌落,分别命名为AH-1 至AH-7。接种到氨氧化菌富集培养基中培养,取样进行NO2–-N 和NO3–-N 显色定性分析后发现,AH-7 的NO2–-N 显色最为明显,因而选择AH-7 作为备用菌株进行鉴定。
AH-7 的电镜结果显示(图2),菌株AH-7 呈卵圆形,直径在0.5~0.75 μm,菌体细胞多呈两两聚集状态分布。菌株AH-7 的氨氧化标志基因-amoA 基因跑胶鉴定呈阳性(图3-B),其16S rDNA 扩增(图3-A)并测序后,经过Blast 对比,序列与亚硝化单胞菌(Nitrosomonas eutropha)(KU747123.1)的相似度最高,达到100%。挑选相似度高于98%的典型菌株进行多重序列比对并构建系统发育树(图4),结果菌株AH-7属于亚硝化单胞菌(N.eutropha)。

图2 菌株AH-7 在透射电镜下的细胞形态(25 000×)
2.3 自养氨氧化菌AH-7 对灭菌养殖废水中氮素含量的影响 由图5 可知,在NH4+-N 为102 mg/L 的初始浓度下,经过5 d 的培养,养殖废水中NH4+-N 浓度降至7.56 mg/L,NH4+-N 降解率达到92.59%,显著高于未接菌对照组。同时,随着NH4+-N 含量降低,接入AH-7 的培养体系内NO2–-N 可积累至87.24 mg/L(P<0.05),氨氧化速率达到16.87 mg/(L·d),显著高于对照组。此外,培养前后NO3–-N 含量未见显著变化。同时,接菌组和对照组相比,各时间点的NO3–-N 含量也均未见显著差异。
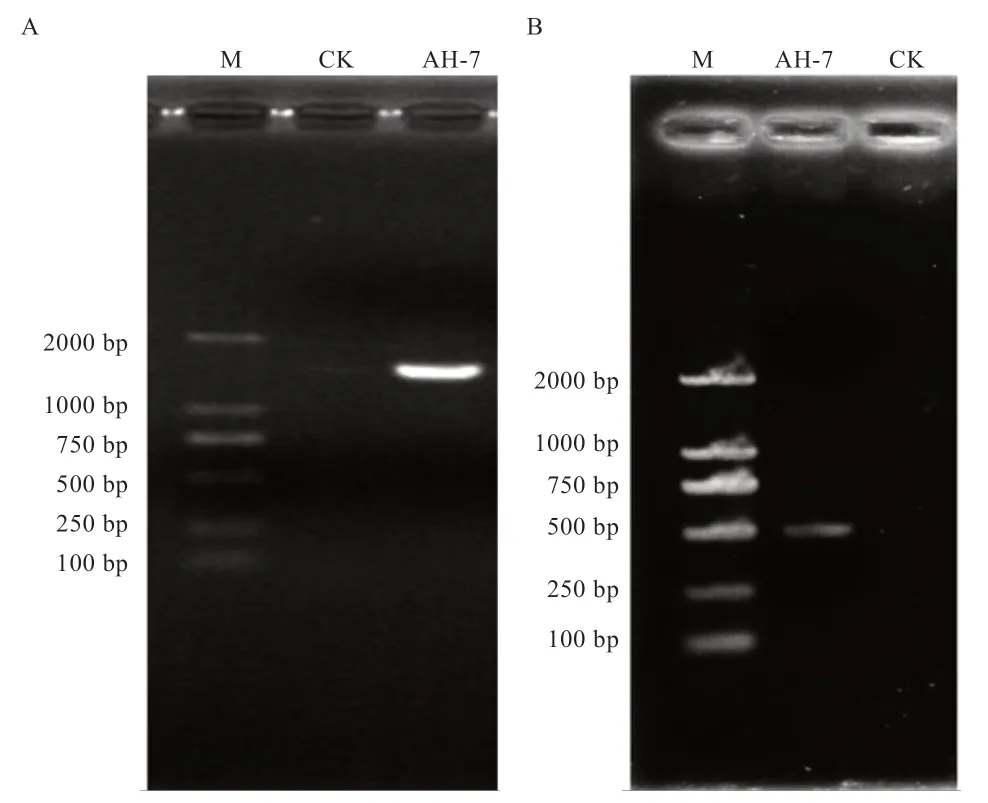
图3 菌株AH-7 的16S rDNA(1 500 bp,A)和amoA 基因(491 bp,B)的PCR 扩增电泳图

图4 菌株AH-7 的系统发育树构建

图5 菌株AH-7 对灭菌养殖废水中氮素含量的影响
3 讨论
经过自养硝化培养基的多次富集驯化,配合DGGE 对氨氧化amoA 功能基因的指示,本研究筛选获得了1 株自养氨氧化菌AH-7,并鉴定为亚硝化单胞菌(N.eutropha)。前人研究证实,由于氨氧化菌自身生长缓慢,对环境变化又十分敏感,因而该类细菌的筛选难度较高[10-11]。同时由于培养周期长,而在培养基平板上菌落小,因此往往需要经过多次富集并配合适当的分子检测手段来提高筛选效率和准确性[12]。本研究所选用的amoA 基因是编码氨氧化过程催化中关键催化酶-氨单加氧酶的基因,可直接用于指示自养氨氧化菌[13]。Abe 等[14]和Reddy等[15]采用荧光原位杂交技术对amoA 基因进行标记用以快速筛选获得自养氨氧化菌的纯培养。本实验室前期已成功采用基于16S rDNA 为基础的DGGE 技术辅助筛选NH4+-N 降解菌株[8],而本研究中直接采用amoA功能基因进行跟踪进一步提高了对目标微生物在富集过程中的指示作用,表明采用该技术可为筛选氨氧化菌提供帮助[16]。另一方面,本研究筛选到的亚硝化单胞菌属于亚硝化单胞菌属的自养氨氧化菌。该菌是目前已有报道中最为常见的氨氧化菌种,其在污水和富营养化地表水中分布广、对氨氧化的贡献也较大[17]。如魏伟伟等[18]曾报道在自然湿地底泥中富集分离到的氨氧化菌主要为亚硝化单胞菌属。国外研究表明,氨氧化菌的生长条件差异较大,在不同环境营养水平下筛选的自养氨氧化菌有显著差异[19]。Bollmann 等[16]研究表明,通过采用连续富集培养的手段,较易富集到亚硝化单胞菌属的氨氧化菌,但对其他类别的氨氧化菌的分离效果较差。Otawa 等[20]对比了11 个污水处理厂中氨氧化菌含量后发现,在高NH4+-N 浓度(大于100 mg/L)下,亚硝化单胞菌(N.eutropha)占绝对优势;而在低NH4+-N浓度下,N.oligotropha菌的数量占优势。本研究中富集液浓度达到212 mg/L,因而富集后期以亚硝化单胞菌为主,符合上述研究结论。
本研究发现AH-7 在灭菌稀释养殖废水中培养5 d后的NH4+-N 降解率达到92.59%,显著高于魏伟伟等[18]从自然湿地来源筛选的氨氧化菌的降解率(73.86%)和曾涛涛等[9]选用AOB 人工培养基培养10 d 后所报道的最高73.1%的氨氧化能力。上述NH4+-N 降解差异可能与菌株不同和初始培养条件差异均有关。如魏伟伟等[18]研究中初始NH4+-N 浓度仅为5 mg/L 左右,与其相比,本研究中所用的NH4+-N 初始浓度高于100 mg/L,因而该菌株在该浓度下具有较好的降解能力。Shrestha等[21]报道自养氨氧化菌在浓度为40~50 mg/L 的初始NH4+-N 浓度下具有最佳的降解效率。张健等[22]从对虾养殖底泥中筛选到一株氨氧化菌后研究表明,NH4+-N浓度在1~200 mg/L,氨氧化速率随氨浓度的升高而加快;但当NH4+-N 浓度超过2 000 mg/L 后,氨氧化活性将会受到明显抑制。但上述研究[22]在与本研究一致的初始NH4+-N 浓度(100 mg/L)下培养16 d 后,降解率仅为60.21%,显著低于本试验的报道,表明菌株AH-7 可能具有较好的应用开发前景。熊英等[23]研究证实单株亚硝化单胞菌在不同游离氨条件下具有不同的亲和力,从而影响NH4+-N 转化效率,并推测该差异可能与amoA 基因不同的拷贝数有关。同时,本研究中NH4+-N 的显著降低伴随着NO2–-N 含量的显著提高,进一步表明系统内主要发生了氨氧化代谢过程[24]。因此,通过投加筛选的AH-7 菌株,可增加体系的硝化效果,从而在畜禽废水NH4+-N 去除上具有很大的应用价值。另一方面,有报道亚硝化单胞菌属的微生物能在氧受限条件下,发生以NO2–-N 为受体的厌氧氨氧化反应,显著提高生物脱氮效率[25]。于濛雨等[26]采用模拟系统固定化培养氨氧化菌后发现,氨氧化菌可实现短程硝化作用,氨氧化速率可高达50 mg/(L·d)。上述结果解释了本研究中经过培养后,灭菌养殖废水中氮含量总体有所下降的情况,但有关AH-7 菌株是否有上述功能还需要进一步验证。需要注意的是,与前人采用的方法不同[9,18],本研究为了降低高浓度NH4+-N 对氨氧化菌生长的不利影响,同时兼顾后续在实际应用中与微藻的复配使用,对畜禽废水做了稀释处理用以评价AH-7 菌株的硝化效果。上述结果尚不能完整说明该菌在实际条件即未稀释废水中的应用效果。后续有关该菌的最高NH4+-N 耐受浓度的试验正在开展,以完整揭示其在实际处理中的应用前景和效果。此外,本研究为了排除养殖废水中外源微生物的影响而采用灭菌水作为试验原料对筛选的菌株进行评价,后续将进一步采用未灭菌养殖废水对其脱NH4+-N 功能进行研究,以深入揭示该菌在实际处理中的应用前景和效果。
4 结论
本试验从养殖废水污泥中分离获得1 株自养氨氧化菌AH-7,经过细胞形态观察和16S rDNA 序列鉴定为亚硝化单胞菌(N.eutropha)。在本试验条件下,该菌在灭菌废水中有较好的NH4+-N 去除作用,NH4+-N 降解率达到92.59%,氨氧化速率达到16.87 mg/(L·d)。

