赤星病烤后烟叶内生及叶际真菌分析
向立刚 ,汪汉成,郑苹,蔡刘体,余知和
1 长江大学生命科学学院,荆州 434025;
2 贵州省烟草科学研究院,贵阳 550081
烟草赤星病是由链格孢属(Alternariasp.)真菌引起的烟株生长后期主要叶部真菌性病害,在我国各个烟区均有发生,轻发病烟田发病率一般在10%以下,重发病烟田发病率可达50%,少数地块在发病严重的年份烟田发病率接近100%,每年因烟草赤星病所造成的经济损失高达数百万元。目前已知引起烟草赤星病的链格孢有Alternaria alternata、A. longipes、A. tenuissim、A. yaliinficiens和A. tabacicola等[1-4]。 该病原菌在大田期和烘烤期均会对烟叶造成严重危害。了解烟叶内生及叶际病原菌种类对指导烟草赤星病的防治具有重要意义。
叶际作为一个复杂的生态系统,其可利用的营养成分极少,且单日温湿度波动大,紫外线强度高,微生物的生存条件极为严苛[5-6]。但即使如此,植物叶际也有着丰富的微生物种群,其中包括各类有益菌和部分病原菌[7]。叶际微生物群落的稳定直接影响植物的健康。相关研究表明,病原菌的侵染与病害的发生通常会导致叶际微生物群落结构发生改变,而叶际微生态的健康与否也会间接影响植株抵御病原菌的能力。随着生物信息学和分子生物学的发展,人们对于叶际微生态的研究逐步深入,开始从微观角度揭示叶际微生物的组成与多样性,以及其与外界因素间的相互作用。罗路云等研究表明随着白粉病病情等级的增加,南瓜叶际细菌群落α 多样性指数呈现先降后升的趋势[8]。刘畅等发现感染赤星病的烟叶叶际优势细菌为泛菌属和假单胞菌属[9]。徐慧等[10]对云南烟草叶片内生及叶际真细菌的多样性研究表明,假单胞菌属,芽孢杆菌属和链格孢属为云南绝大多数地区烟草叶片内生及叶际优势菌属。高通量测序技术的出现,增加了人们对于叶际微生物的关注度,为叶片内生及叶际微生物的研究提供了全新的思路与方法。
目前人们对于烟草微生物群落的研究大都聚集于大田鲜样,如研究拮抗菌剂对烟株及土壤微生物的影响[11-14]、种植模式对烟株根际土壤微生物的影响[15-17]以及感病前后烟株不同部位微生物群落的改变[18-19]等。而缺乏对烤房内感赤星病烤后烟叶微生物群落结构的了解。陈乾丽等[20]对烤后不同霉变程度的烟叶叶际真菌群落结构与多样性研究发现,不同霉变程度的烟叶叶际真菌群落组成存在较大差异,曲霉属为不同霉变程度烟叶中的优势菌属。本文研究了健康与感赤星病烤后烟叶内生及叶际真菌群落结构与多样性差异,其结果对烘烤期烟草赤星病的防治具有一定指导意义。
1 材料与方法
1.1 样品采集
2019 年8 月于贵州省黔东南州感赤星病严重的烟田随机选取3 株明显感染赤星病的成熟期烟株(种植品种‘云烟87’),用消毒过后的剪刀在同一烟株上剪取7 级病级烟叶和0 级健康烟叶样品,病级分类参考侯烁等[21]烟草赤星病病级分类方法。分别将两类叶片做好标记放入烤房直至烘烤完成,用无菌取样袋收集样品,0 级健康组(HJ)样品编号分别为JXY1、JXY2 和JXY3,7 级赤星病组(HB)样品编号为BXY1、BXY2 和BXY3。采集样品快速带回实验室置于-80℃冰箱保存。
1.2 烟叶样品DNA 提取
称取烤后烟叶样品0.5 g,采用Qiagen 公司的植物组织DNA 提取试剂盒(Qiagen,69104)抽提烟叶样品微生物基因组总DNA,具体步骤按照操作说明进行。提取完成后,使用NanoDrop 2000 检测抽提DNA 的浓度和纯度。
1.3 扩增及测序
以提取样品DNA 为模板,采用引物ITS1F (5’-CTTGGTCATTTAGAGGAAGTAA-3’)和ITS2R (5’-GCTGCGTTCTTCATCGATGC-3’)对 真 菌18S rRNA 转录间隔区的ITS1 区进行PCR 扩增。PCR 扩增体系为20 μL:20 ng/μL 模板DNA 1 μL,5 μmol/L上、下游引物各0.8 μL,5×FastPfu 缓冲液4 μL,2.5 mmol/L dNTPs 2 μL, Fast Pfu 聚合酶0.4 μL, BSA(牛血清白蛋白)0.2 μL,灭菌ddH2O 11.8 μL。反应程序参数:98℃预变性1 min;98℃变性10 s,50℃退火30 s,72℃延伸30 s,30 个循环;最后72℃延伸5 min。PCR 扩增产物经凝胶电泳检测合格后,送至上海美吉生物医药科技有限公司采用Illumina 公司Miseq PE300 平台进行高通量测序。
1.4 测序数据处理与统计分析
原始测序序列使用Trimmomatic 软件进行质控,筛出低质量的序列;使用 Usearch (version 7.0 http://drive5.com/usearch/) 对相似度≥97% 的序列进行OTU(Operational Taxonomic Units)聚类,并在聚类过程去除单序列和嵌合体。利用RDP classifier(http://rdp.cme.msu.edu/) 参 照Unite(Release 7.2 https://unite.ut.ee/index.php)真菌数据库对每条序列进行物种分类注释。通过对样品进行 Alpha 多样性分析、物种组成及差异分析等,了解赤星病烤后烟叶真菌群落结构与多样性。反映样本真菌群落丰富度的指数包括Sobs 指数、Chao1 指数,Sobs 指数为实际观测到的OTU 数,Chao1 指数为利用chao1 算法估计样本中所含的OTU 数目,Sobs 指数、Chao1 指数越大群落丰富度越高;反映样本真菌群落多样性的指数包括Shannon 指数和Simpson 指数,Shannon 指数越大或Simpson 指数越小群落多样性越高。Coverage 指数表示测序的覆盖度,其值越高样品中序列被测出的概率越高,测序结果的真实性越高。Alpha 多样性指数采用 软 件mothur (https://mothur.org/wiki/calculators)计算。同时在各个分类水平上对所注释物种进行群落结构统计分析。
2 结果与分析
2.1 ITS 序列测序深度分析及数据质控
稀释曲线(Rarefaction curve)展示了不同样品间多样性的差异,用来检验测序结果是否合理。样本曲线延伸终点横坐标为该样本的测序数量。本试验中6 个样本的稀释曲线在测序深度为30,000 时就趋于平缓(图1),曲线趋于平缓表明测序已趋于饱和,测序深度已足够,增加测序数据无法再找到更多的OTU,因此,此次测序深度已经覆盖到样品中的绝大多数物种,测序数据量足以反映样品中真菌群落结构的真实情况。

图1 稀释曲线(OTU 水平Sobs 指数)Fig. 1 Rarefaction curve (Sobs index of OTU level)
表1 为原始序列优化处理信息表,试验中两组6个样本共得到215,781 条高质量片段序列,54,468,693个碱基,单一样本序列条数在32,640~38,424 之间,平均序列长度为253 bp。赤星病组3 个样本共得到111,156 条序列,28,510,893 个碱基,单一样本序列条数在35,764~38,424 之间,平均序列长度为257 bp;健康组3 个样本共得到104,625 条序列,25,957,800个碱基,单一样本序列数在32,640~37,225 之间,平均序列长度为245 bp。

表1 样本序列优化信息Tab. 1 Sample sequence optimization information
2.2 OTU 聚类分析
在97%的相似度水平对样品序列进行OTU 聚类,赤星病组烟叶样本共鉴定到真菌的3 个门,15 个纲,26 个目,37 个科,57 个属,73 个种,98 个OTU;健康组烟叶样本共鉴定到真菌的5 个门,22 个纲,44 个目,75 个科,140 个属,182 个种,274 个OTU(表2)。
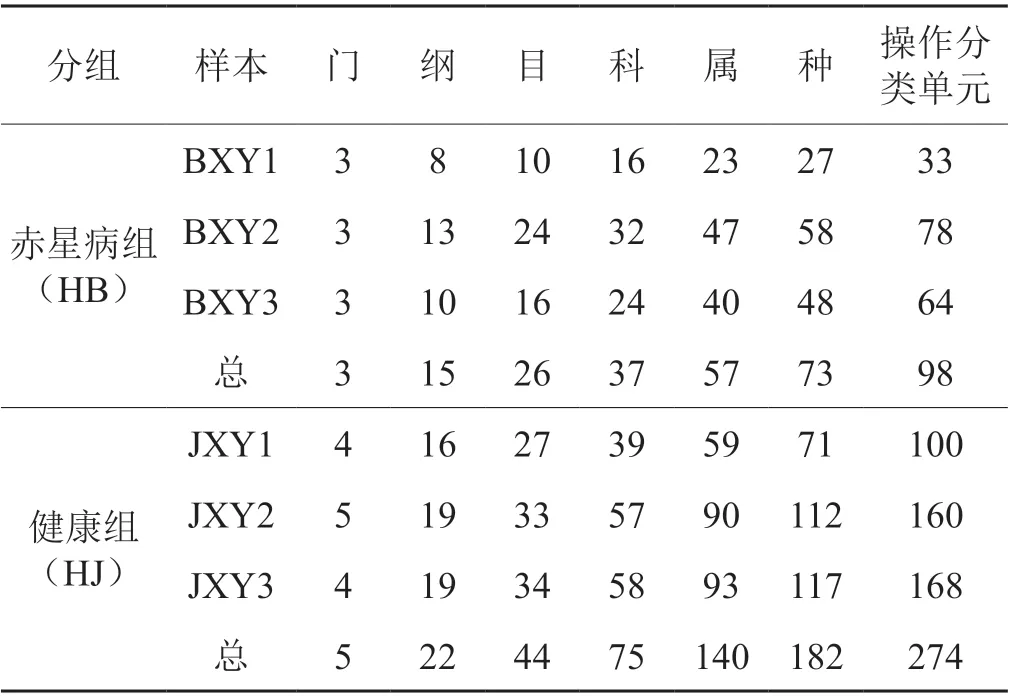
表2 烟叶样本真菌群落各级别分类单元数量Tab. 2 Number of taxonomic taxa with the fungal communities in tobacco leaves
2.3 真菌群落基本组成及多样性分析
真菌群落组成分析表明,赤星病烤后烟叶样品中链格孢属Alternaria为最优势菌属,在BXY1、BXY2和BXY3中的相对丰度分别为87.91%、77.22%和78.92%;其次为红醇母属Rhodotorula,在BXY1、BXY2和BXY3中的相对丰度分别为11.60%、21.25%和20.25%。健康烤后烟叶样品中红醇母属在JXY1和JXY2中为最优势菌属,其相对丰度分别为91.00%和86.94%,在JXY3中为优势菌属相对丰度为20.92%。JXY3中的最优势菌属为链格孢属,相对丰度为50.95%。JXY1中Unclassified_k_Fungi相对丰度占4.41%,Alternaria相对丰度为0.76%。JXY2中相对丰度大于1%的菌属有Unclassified_k_Fungi(1.94%)、Alternaria(1.88%)和Unclassified_f_Incertae_sedis_o_Pleosporales(1.29%)。JXY3中相对丰度大于1%的菌属有Unclassified_f_Incertae_sedis_o_Pleosporales(3.98%)、Unclassified_k_Fungi(1.99%)、Unclassified_f_Mycosphaerellaceae(2.94%)、Wallemia(1.29%)、unidentified_f_Incertae_sedis_o_Trichosphaeriales(1.24%)、曲霉属Aspergillus(8.81%)和Unclassified_o_Pleosporales(1.16%)。
样品Alpha 多样性指数见表3,所有样品的Coverage 指数均高于0.99,表明序列被检测出的概率高,测序结果能够代表样本中实际的真菌群落分布。丰富度指数中Sobs 指数健康组样品高于赤星病组样品,Ace 指数和Chao1 指数健康组样品高于赤星病组样品(BXY2 除外),结果表明健康组样品中真菌群落丰富度高于赤星病组样品真菌群落。多样性指数中Shannon 指数健康组样品(JXY1 除外)高于赤星病组样品,Simpson 指数健康组样品(JXY3 除外)高于赤星病组样品,表明健康组样品真菌群落多样性整体高于赤星病组样品真菌群落。

表3 不同样品真菌群落Alpha 多样性指数(OTU level)Tab. 3 Alpha diversity index of fungal communities in different samples (OTU level)
2.4 Beta 多样性分析
属水平的主成分分析(图3a)结果表明,导致样品间真菌群落结构产生差异的主成分1(PC1)和主成分2(PC2)分别占全部影响因素的96.25%和3.7%,健康组样品与赤星病组样品间真菌群落结构存在显著性差异,而健康组样品中BXY3 样品与其余两样本存在较大差异,赤星病组中3 样品间无显著性差异。ANOSIM 相似性分析(图3b)结果表明,赤星病组烟叶组内样品差异性较小,健康组烟叶组内样品差异性较大,但两组烟叶的组内差异小于两组组间的差异。

图2 不同样品真菌群落属水平的相对丰度Fig. 2 The relative abundance of fungal communities of different samples at genus level

图3 不同样品真菌群落属水平Beta 多样性分析Fig. 3 Analysis on the Beta diversity of fungal communities of different samples at genus level
2.5 LEfSe 多级物种差异判别分析
LEfSe 多级物种差异判别分析结果表明,当LDA 阈值为4 时,健康组与赤星病组烟叶真菌群落从门到属共有19 个不同分类水平上的真菌存在显著性差异。赤星病组烟叶中子囊菌门Ascomycota、座囊菌纲Dothideomycetes、假球壳目Pleosporales、格孢腔菌科Pleosporaceae 和链格孢属,健康组烟叶中Capnodiales 目、Eurotiomycetes纲、散囊菌目Eurotiales、Trichocomaceae 科、曲霉属Aspergillus、担子菌门Basidiomycota、微球黑粉菌纲Microbotryomycetes、Sporidiobolales 目和Incertae_sedis_o_Sporidiobolales 科等,是造成健康烤后烟叶与赤星病烤后烟叶真菌群落结构产生差异的主要菌群。

图4a LEfSe 物种差异分析(多级物种层级树)Fig. 4a LEfSe species difference analysis (Multistage species hierarchical tree map)

图4b LEfSe 物种差异分析(LDA 判别结果)Fig. 4b LEfSe species difference analysis (LDA discriminant results)
3 讨论
微生物群落的Alpha 多样性指数用于反映微生物群落结构的复杂程度。一般而言,微生物群落结构越复杂,微生态环境越稳定,群落的多样性指数也就越高[22]。本研究中,赤星病烤后烟叶真菌群落丰富度与多样性较健康烤后烟叶真菌群落降低,说明健康烤后烟叶中真菌群落结构优于赤星病烤后烟叶真菌群落结构。亦表明,赤星病病害的发生改变了烟叶真菌群落结构,降低了其真菌多样性,这与烟株感青枯和黑胫病后微生物多样性变化趋势一致[23-24]。
物种组成结果表明,健康与赤星病烤后烟叶中优势菌属为链格孢属和红醇母属,但在健康与赤星病烤后烟叶中相对丰度存在较大的差异,赤星病烤后烟叶中二者相对丰度之和大于90%,其余真菌属的总相对丰度不到10%。链格孢属作为烟草赤星病的重要病原菌,在赤星病烤后烟叶中为绝对优势菌属,因此病原菌数量是病害发生的主要影响因素之一。红醇母属广泛存在于自然界中,如海洋[25]、肠道[26]、烟株茎秆[27]等,部分可用于发醇,还有报道红醇母属部分菌株可导致地黄根腐病[28]。所有样本中均出现了部分Unclassified Fungi,这可能是由于数据库中包含的真菌种类有限,导致数据库外的真菌无法匹配。部分烟叶上出现了曲霉属真菌,该菌为烤房中常见的真菌,通常能够导致烟叶霉变[29]。刘畅等[30]发现大田感赤星病烟叶内生及叶际真菌的优势菌属主要为链格孢属、茎点霉属、镰刀菌属、赤霉属和枝孢霉属等。徐慧等[10]发现云南省5 个地区健康烟叶内生及叶际真菌包括链格孢属、枝孢霉属、镰刀菌属和茎点霉属等。健康烟叶中链格孢属的存在表明并非所有链格孢真菌都能导致烟叶感赤星病。茎点霉属真菌可导致烟叶发生茎点霉叶斑病,赤霉属真菌可导致小麦赤霉病、玉米穗腐病和水稻恶苗病等,部分枝孢霉属真菌则是人类致病菌。通过比较分析可看出,赤星病烤后烟叶经烤房高温烘烤后茎点霉属、镰刀菌属、赤霉属和枝孢霉属等病原菌从烟叶样品上消失或成为非优势菌属。而红醇母属真菌则在烘烤过程中成为了赤星病烤后烟叶中继链格孢之后的优势菌属和健康烤后烟叶中的绝对优势菌属,因此结合红醇母属的特性,推测其可能在烟叶烘烤过程中起到发醇烟叶产生特殊芳香气味的作用。该推测将在后续研究中加以验证。
赤星病烤后烟叶组内真菌群落结构差异性较大,健康烤后烟叶组内真菌群落结构差异较小。其可能是由于感病后病原菌的侵入削弱了烟叶本身的防御能力,环境中真菌侵入导致其真菌群落结构出现了较大程度的改变。为此,健康烤后烟叶中真菌群落结构组内差异较小。
4 结论
经高通量测序技术分析表明:1.赤星病烤后烟叶内生及叶际优势菌属为链格孢属和红醇母属;2.健康烤后烟叶内生及叶际优势菌属为红醇母属;3.健康烤后烟叶上也存在链格孢属,但其相对丰度很低;4.赤星病烤后烟叶内生及叶际真菌群落多样性低于健康烤后烟叶。然而本文仅仅对赤星病烤后烟叶进行了研究,并未对烘烤前新鲜感赤星病烟叶进行采样分析其真菌群落,今后将加强对新鲜感赤星病烟叶真菌群落的研究,已明确烘烤过程对感赤星病烟叶真菌群落的影响,进而改进烟叶烘烤的各类参数,以此控制烘烤过程中赤星病的扩展。

