盐度及钒酸钠胁迫对红毛菜光合生理的影响*
魏家慧 李晓蕾 马德英 汪文俊,3 梁洲瑞,3 李国梁 刘福利,3 孙修涛,3 王飞久
盐度及钒酸钠胁迫对红毛菜光合生理的影响*
魏家慧1,2李晓蕾2马德英2汪文俊2,3①梁洲瑞2,3李国梁1,2刘福利2,3孙修涛2,3王飞久2
(1. 上海海洋大学水产与生命学院 上海 201306;2. 中国水产科学研究院黄海水产研究所农业农村部海洋渔业可持续发展重点实验室 青岛 266071;3. 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 青岛 266071)
利用叶绿素荧光技术和液相氧电极技术,研究了盐度与钒酸钠胁迫对红毛菜(,海水种)和暗紫红毛菜(,淡水种)光合作用的影响。结果显示,红毛菜和暗紫红毛菜分别在低盐、高盐下胁迫1 h,PSⅡ原初光能转化效率(v/m)均快速下降,且下降幅度与胁迫程度正相关;第3天开始,盐度0和8对红毛菜v/m具有明显抑制效应,盐度16和24组与对照组相当;暗紫红毛菜各高盐胁迫组的v/m从第1天开始显著低于对照组,但到后期(6~7 d)与对照组间无显著差异。盐度胁迫对2种红毛菜的表观光合速率(P)影响显著,尤其到后期(3 d后),多数实验组P均显著降低。红毛菜的呼吸耗氧速率(R)在胁迫早期的变化与v/m一致,呈先下降后快速恢复到对照组水平;暗紫红毛菜随胁迫时间的延长,胁迫组R呈上升趋势,显著高于对照组。高浓度(200~500 μmol/L)钒酸钠胁迫3 d后可显著抑制红毛菜v/m,暗紫红毛菜的v/m在钒酸钠胁迫1 d后呈下降趋势,且下降幅度与钒酸纳胁迫程度正相关。整体上,随着钒酸钠浓度增加,低盐、高盐胁迫分别加重红毛菜和暗紫红毛菜的v/m和P的抑制效应。而R随胁迫程度的增加而升高,在暗紫红毛菜中尤为明显。研究表明,红毛菜和暗紫红毛菜对盐度胁迫可作出快速响应,其呼吸作用的增强及对质膜-H+-ATPase的调控,可能在应对盐度胁迫时发挥重要作用,而较长时间盐度胁迫对2种红毛菜的光合作用均产生不可逆影响。
红毛菜;盐度;钒酸钠;PSⅡ原初光能转化效率;表观光合速率;呼吸耗氧速率
红毛菜属()分布广泛,几乎遍布亚寒带及亚热带等地(Woolcott, 1998; Müller, 2003; 汪文俊等, 2008),兼具海水和淡水种类。红毛菜()为典型海水种,一般生长在风浪较大的高潮带岩石上;暗紫红毛菜()为淡水种,也是目前发现的唯一一个淡水红毛菜科(Bangiaceae)藻类(Wang, 2018)。红毛菜具有较高的营养、药用和生态价值(黄文凤等, 1998; 马家海等, 2002; 王翔宇等, 2011),已成为继海带、紫菜、龙须菜之后在福建莆田养殖的代表性经济海藻之一。
不同于潮间带其他海藻(如紫菜),红毛菜属红藻在数亿年演化过程中完成了海水种到淡水种的进化(Butterfield, 2000),证明红毛菜拥有一套特殊的盐度适应机制。前期研究发现,红毛菜在低盐胁迫初期,质膜-H+-ATPase基因的表达量呈快速上升趋势,提示该酶在红毛菜响应盐度变化过程中起着关键的调节作用(曹原, 2018; Wang, 2019)。质膜-H+-ATPase是植物细胞质膜上最重要的酶类,在植物抗逆过程中发挥积极作用。NaCl处理使耐盐小麦根质膜-H+-ATPase活性升高(Yang, 2003)。盐胁迫过程中,耐盐性芦苇愈伤组织质膜-H+-ATPase蛋白量与对照组相比明显增多(Zhao, 2004)。钒酸钠是质膜-H+-ATPase的专一抑制剂,在调控植物质膜-H+-ATPase活性方面应用较为广泛。王小治等(2010)研究发现,钒酸盐可显著抑制玉米根质膜-H+-ATPase活性。朱志明等(2017)研究表明,钒酸钠能显著抑制宁夏枸杞根系在盐胁迫下质膜-H+-ATPase的活性,从而改变细胞内外离子流向。
叶绿素荧光技术是研究植物光合作用和逆境生理的重要工具之一(Schreiber, 1995)。目前,叶绿素荧光技术在紫菜(姚春燕等, 2011; Wang, 2016; Li, 2018)、鼠尾藻()(梁洲瑞等, 2011)、铜藻() (张玉荣等, 2009)等藻类胁迫机制研究中已有较多应用。PSⅡ原初光能转化效率(v/m)反映植物在充足的暗适应后,所有PSⅡ反映中心均处于开放状态时的量子产量,是衡量植物光合完整性的指标之一(张守仁, 1999)。当植物遭遇外界胁迫时,v/m值存在不同程度的下降,表明PSⅡ反应中心受到了不同程度的损伤。液相氧电极技术可以准确测得海藻实时的表观光合速率(P)及呼吸耗氧速率(R),目前,已广泛应用于藻类光合生理领域(姚海芹等, 2016; 张曼等, 2010; 马兴宇等, 2014)。
本研究采用叶绿素荧光技术和液相氧电极技术,研究了红毛菜光合系统和质膜-H+-ATPase对盐胁迫的响应,旨在为揭示红毛菜盐胁迫响应机制、培育红毛菜抗逆优质品种奠定基础。
1 材料与方法
1.1 实验材料及培养条件
暗紫红毛菜于2019年5月采自山西阳泉娘子关(37°6′N、113°5′E),红毛菜于2018年3月采自山东 东营港(118°6′N、38°1′E)。取回后立即冲洗、晾干,以去除表面附生杂藻及污泥,灭菌海水和淡水分别作为红毛菜与暗紫红毛菜的培养液,放入光照培养箱内暂养。暂养条件:温度为15℃,光照为40 μmol/(m2·s),光周期为12 L : 12 D。培养液中添加2 mg/L NO3–-N, 1 mg/L PO43–-P。培养适应3 d后进行盐胁迫实验。
1.2 实验方法
1.2.1 盐度对光合作用的影响 盐度对红毛菜和暗紫红毛菜v/m值的影响:设置5个盐度组(括号中为相应处理的符号表示,下同):32(S32)、24(S24)、16(S16)、8(S8)和0(S0),每组3个平行。培养1 h、6 h、12 h、1 d、2 d、3 d、4 d、5 d、6 d和7 d后,测定v/m(Eggert, 2007)。测定方法:取少量红毛菜于暗盒中,对藻体进行20 min暗适应,打开IMAGING-PAM (WALZ,德国),设置测量光和光化光并选取待测位点,进行测定。
盐度对红毛菜和暗紫红毛菜表观光合速率、呼吸耗氧速率值的影响:盐度设置同上。培养6 h、1 d、3 d、5 d、7 d后,用液相氧电极(Hansatech Oxygraph,英国)测定样品的表观光合速率(P)和呼吸耗氧速率(R)。反应介质为灭菌海水和淡水,光源为500 W碘钨灯,通过控制灯的远近将光强控制在40 μmol/(m2·s)。每个条件下反应稳定5 min,每次测试时间控制在 10 min内,取较为平滑曲线计算。由氧电极自带软件得出实验数据,每个梯度设3次平行。
1.2.2 钒酸钠对v/m值的影响 设置4个钒酸钠浓度(括号中为相应处理的符号,下同):0(V0)、50(V50)、200(V200)和500 μmol/L(V500),每组实验设置3个生物学重复。培养1 h、6 h、12 h、1 d、2 d、3 d、4 d、 5 d、6 d和7 d后,测定红毛菜的v/m值。
1.2.3 盐度和钒酸钠对光合作用的影响 盐度和钒酸钠对红毛菜和暗紫红毛菜v/m值的影响:钒酸钠及盐度设置同上,分别测定不同钒酸钠浓度处理液中,各盐度胁迫下2种红毛菜的v/m,操作同上。
盐度和钒酸钠对红毛菜和暗紫红毛菜表观光合、呼吸耗氧速率值的影响:钒酸钠浓度为500 μmol/L,盐度设置及操作同上。
1.3 数据处理
采用Excel软件进行数据整理分析并绘制图形,采用SPSS 18.0软件分别进行检验、单因子方差(One-way ANOVA)分析以及Duncan多重比较,< 0.05作为差异显著水平。
2 结果
2.1 盐度对红毛菜和暗紫红毛菜光合作用的影响
2.1.1 盐度对红毛菜和暗紫红毛菜v/m的影响
从图1A可以看出,红毛菜在低盐胁迫1h时后,各胁迫组v/m与对照组(S32)相比显著下降(<0.05)。12 h时,各组间vm无显著差异。一直到第7天,S16和S24组v/m与对照组相比无显著差异,S0组v/m在12 h~7 d的胁迫期内呈直线下降趋势。在处理过程中,S8组v/m出现较大波动,1~3 d线性下降,低于对照组(<0.05),第4天时,恢复到与对照组相当,第4~5天又呈线性下降。
从图1B可以看出,暗紫红毛菜在高盐胁迫1 h时,各胁迫组v/m与对照组(S0)均呈显著差异(<0.05),且与高盐胁迫程度正相关。6 h时,胁迫组v/m快速回升,12 h时,与对照组相当。1~3 d时,各胁迫组与对照组相比,v/m均显著下降。4~5 d时,S32与S24组出现较大波动,第5天时,S32组显著低于对照组(<0.05)。第7天时,只有S24组显著低于对照组(<0.05),其余各组均与对照组无显著差异(>0.05)。
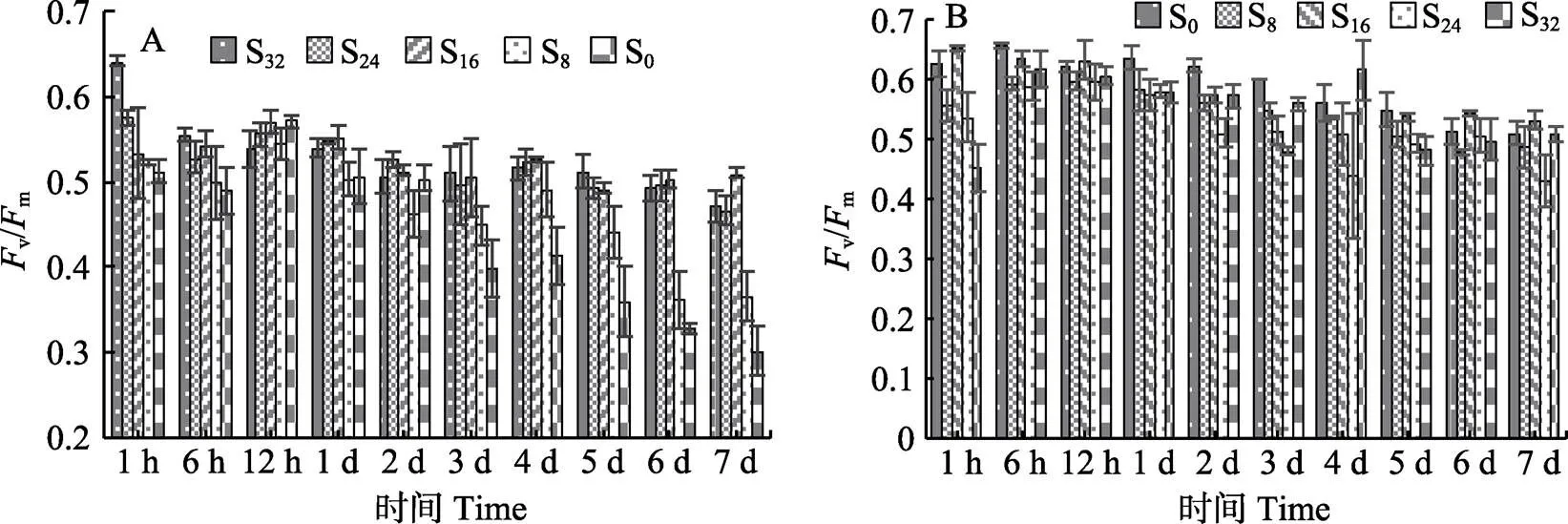
图1 不同盐度处理后的红毛菜(A)和暗紫红毛菜(B)的Fv/Fm
2.1.2 盐度对红毛菜和暗紫红毛菜表观光合速率的影响 从图2A可以看出,与对照组相比,低盐胁迫使红毛菜P显著降低(<0.05)。6 h时,各盐度组均显著低于对照组(<0.05),且S24组显著低于其他各组(< 0.05);第1天,S32、S24、S16和S8胁迫组P上升(<0.05),第3天又显著下降(<0.05);在6 h~3 d中,S0组P呈线性下降(<0.05),而后在第5天时上升,但仍低于对照组(<0.05);5~7 d时,各盐度组间P较稳定。
从图2B可以看出,暗紫红毛菜中,对照组P一直维持在较稳定水平。6 h时,S16、S24和S32胁迫组P显著低于对照组(<0.05),且组间差异不显著(0.05),S8组明显高于对照组(<0.05);1 d时,S16、S24和S32组P显著上升(<0.05);3~5 d时又降低(<0.05),后维持较稳定水平,显著低于对照组(<0.05);第7天时,S24组显著上升(<0.05),且各盐度胁迫组P显著低于对照组(<0.05)。
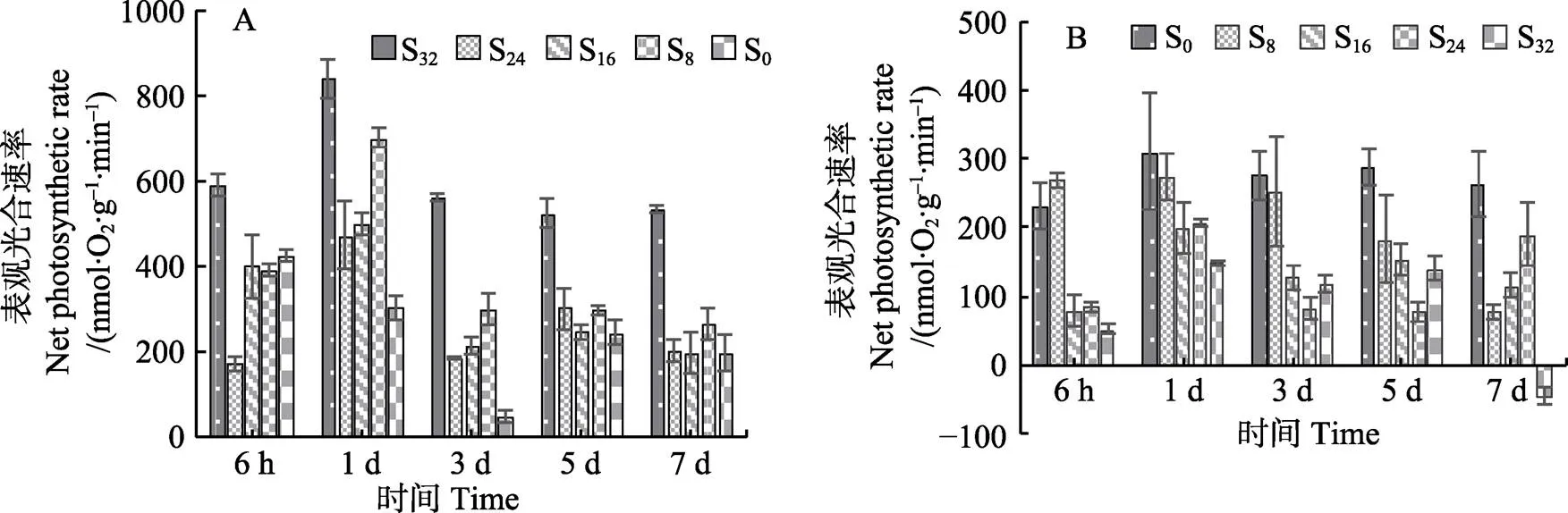
图2 盐度对红毛菜(A)和暗紫红毛菜(B)表观光合速率的影响
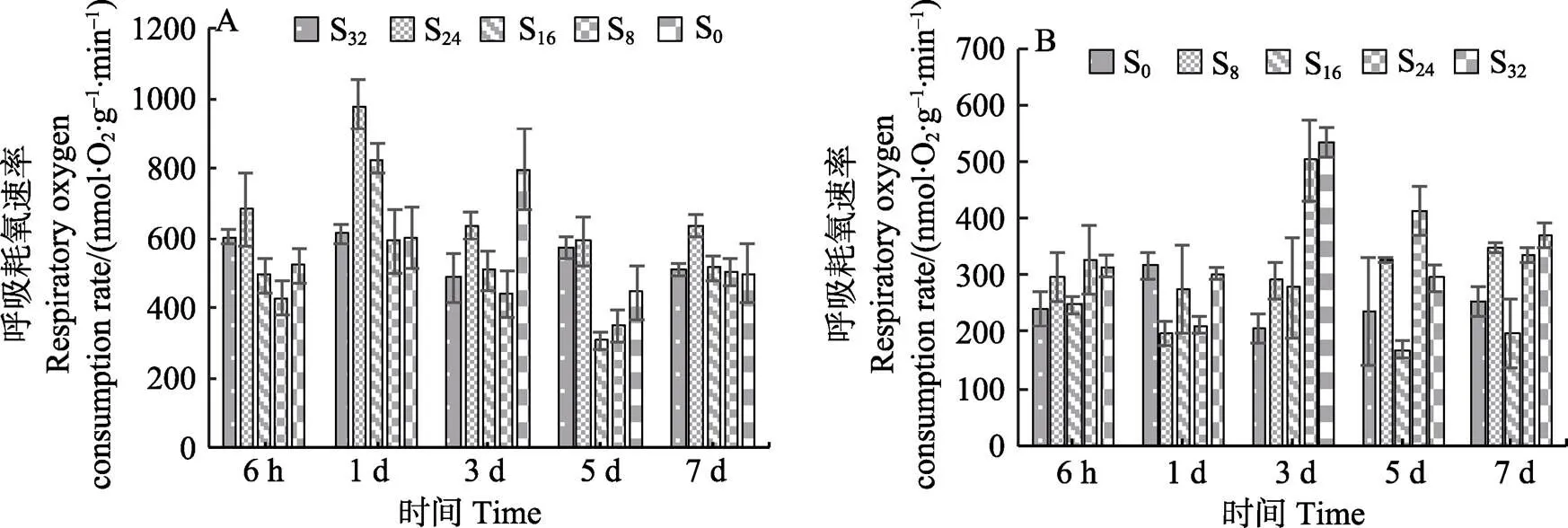
2.1.3 盐度对红毛菜和暗紫红毛菜呼吸耗氧速率的影响 从图3A可以看出,红毛菜在胁迫6 h时,S16、S8和S0组显著低于对照组(<0.05);1 d时,各盐胁迫组R上升,仅S8组显著低于对照组(<0.05);5~7 d时,各胁迫组R显著低于对照组(<0.05)。
从图3B可以看出,暗紫红毛菜在6 h~1 d时,S8、S24与S32组R显著低于对照组(<0.05),S16组与对照组相当;3 d时,S16组R降低,显著低于对照组(<0.05);3 d时,其余3组R上升;到第7天时,除S16组与对照组无显著差异外,其他胁迫组均显著高于对照组(<0.05)。
2.2 钒酸钠对红毛菜和暗紫红毛菜Fv/Fm的影响
从图4A可以看出,红毛菜藻体培养6 h,对照组(V0)相比,仅V200组v/m显著下降(<0.05),3~7 d时,V200与V500组下降显著(<0.05)。前期,V50组与对照组无显著差异,从第6天开始,V50组的v/m显著高于对照组。暗紫红毛菜(图4B)除第12小时外,各胁迫组与对照组相比,v/m均显著下降(<0.05)。早期(1~12 h),各钒酸钠组之间无显著差异,但从第5天开始,v/m下降幅度与钒酸钠浓度成正比。
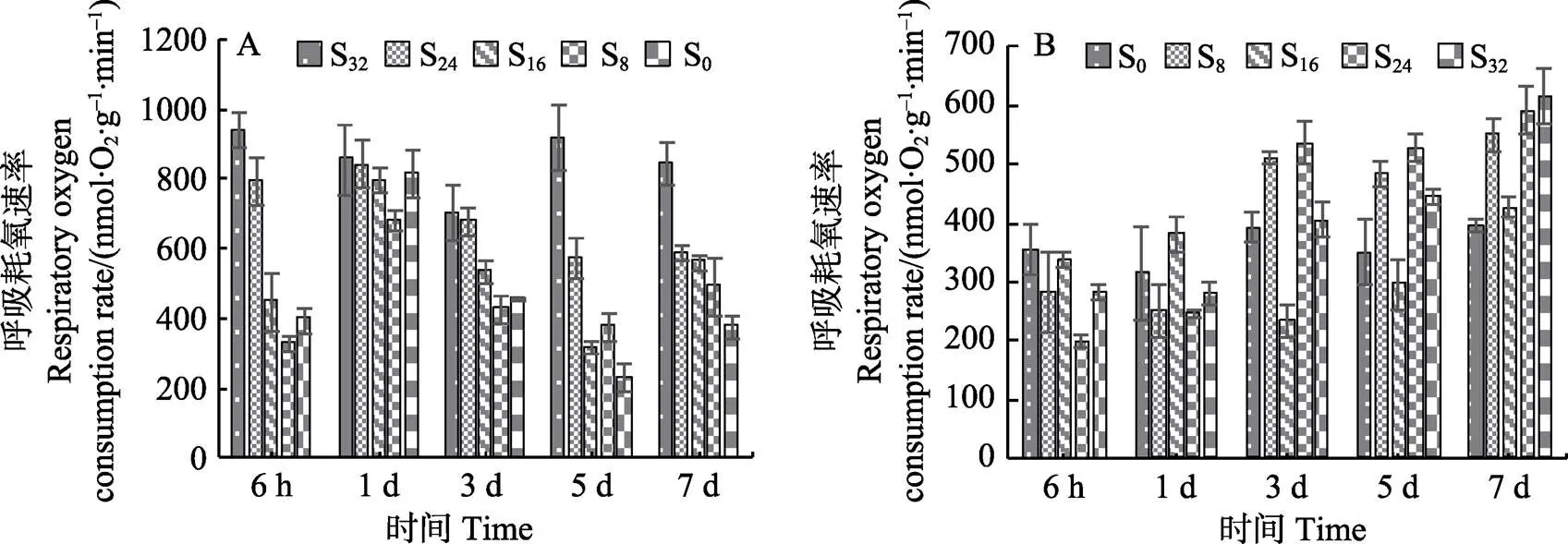
图3 盐度对红毛菜(A)和暗紫红毛菜(B)呼吸耗氧速率的影响
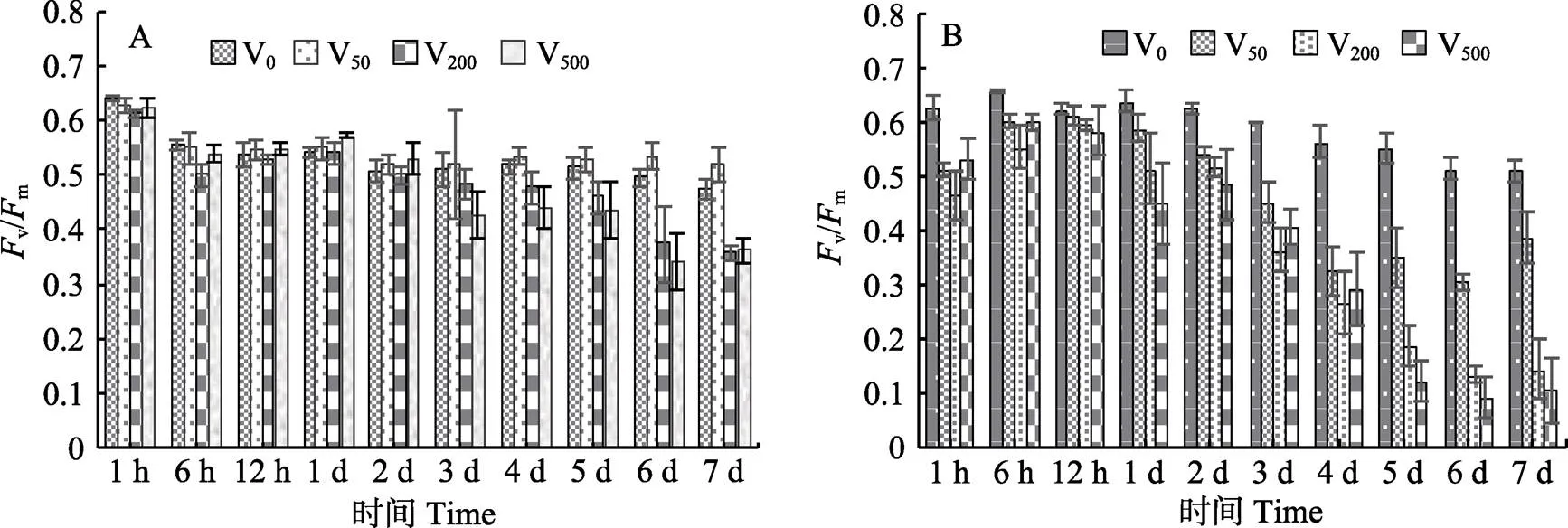
图4 不同浓度钒酸钠处理后的红毛菜(A)和暗紫毛菜(B) Fv/Fm值
2.3 盐度和钒酸钠对红毛菜和暗紫红毛菜光合作用的影响
2.3.1 盐度和钒酸钠对红毛菜和暗紫红毛菜v/m的影响 从图5A~图5D可以看出,红毛菜在低盐胁迫下,早期(1~12 h)钒酸钠组的v/m与对照组相比,差异不显著(>0.05),有些钒酸钠浓度组比对照组高(<0.05)。随低盐胁迫程度的增加,高钒酸钠浓度组对v/m影响显著(<0.05),在S24、S16和S8组胁迫下(图5A~图5C),实验后期(4~7 d),V200和V500钒酸钠胁迫组v/m下降明显,均显著低于对照组(<0.05);V50组总体上与对照组差异不显著;S0组中(图5D),随胁迫时间的延长(3~7 d),V50和V200组v/m显著高于对照组(<0.05),且与钒酸钠浓度正相关,而V500组下降趋势明显(<0.05)。
从图5E~图5H可以看出,暗紫红毛菜在1 h时,除S16组,其他高盐胁迫组、高浓度钒酸钠(V200和/或V500)组,v/m显著高于对照组。6~12 h时,高盐胁迫组v/m总体上明显上升,随后,v/m呈不同程度下降:S16和S8组中(图5E~图5F),从第3天或 第4天开始,各钒酸钠组v/m明显下降,显著低于对照组(<0.05),且高浓度钒酸钠组的下降幅度显著增大(V200≈V500 图5 不同盐度和钒酸钠处理后红毛菜(A~D)和暗紫红毛菜(E~H)的Fv/Fm 2.3.2 盐度和钒酸钠对红毛菜和暗紫红毛菜表观光合速率的影响 从图6A可以看出,红毛菜在500 μmol/L钒酸钠胁迫6 h时,S24和S16组显著低于对照组(S32) (<0.05),其他2组显著高于对照组(<0.05);第1天时,S24、S16和S8组P显著上升,高于对照组(<0.05);3~7 d时,S8组与对照组相当,甚至高于对照组;第7天时,仅S0组显著低于对照组及其他胁迫组(<0.05)。 从图6B可以看出,暗紫红毛菜在实验过程中,对照组P波动较大,呈先上升后下降的趋势。6 h时,S8组与对照组相当,其他高盐胁迫组均显著低于对照组(<0.05);1 d时,S0、S8、S16和S24组P显著上升(<0.05),1~3 d时,各胁迫组P较稳定,显著低于对照组(<0.05);第5天,各胁迫组显著高于对照组(<0.05);7 d时,S16和S32组与对照组相当,均为负值。 2.3.3 盐度和钒酸钠对红毛菜和暗紫红毛菜呼吸耗氧速率的影响 在500 μmol/L钒酸钠中,红毛菜(图7A)在6 h时,S24组R高于对照组,其他低盐组与对照组相当或略低于对照组;1 d时,S24和S16组显著高于对照组(<0.05);3 d时,S0组R上升显著,高于对照组(<0.05)。5 d时,低盐(S16、S8和S0组)胁迫组均显著下降,明显低于对照组(<0.05)。培养第7天时,除S24组高于对照组外,其他各组间差异不显著。 从图7B可以看出,暗紫红毛菜在6h时,各胁迫组R值显著高于对照组(100%淡水) (<0.05);1 d时,对照组R略有上升,除S32组外,其余胁迫组R显著低于对照组(<0.05);3 d时,S24和S32组R直线上升,显著高于对照组及其他2组(<0.05);5~7 d时,对照组R值较稳定,除S16组外,其他胁迫组均显著高于对照组(<0.05),且第7天时,胁迫组间差异不显著。 图7 盐度、钒酸钠对红毛菜(A)和暗紫红毛菜(B)呼吸耗氧速率的影响 叶绿素荧光参数可反应光合作用的强弱(Anderson, 1987),可以作为生物遭遇外界胁迫时的环境传感器(Pfannschmidt, 2003; Bräutigam, 2010)。本研究发现,红毛菜在低盐、暗紫红毛菜在高盐胁迫下,v/m均快速下降(1 h),下降幅度与胁迫程度正相关。随胁迫时间的延长,低盐胁迫(S0和S8组)对红毛菜的v/m具有明显抑制效应,其他胁迫组与对照组相当;在暗紫红毛菜中,各高盐胁迫组v/m从第1天开始显著低于对照组,但到后期(6~7 d),全海水培养与对照组(S0)相比没有差异,可见高度低盐胁迫对红毛菜光合作用影响较大,暗紫红毛菜对海水有较强适应能力。 当植物应对逆境胁迫时,最先作出反应的是质膜及其功能蛋白(Gong, 2002)。质膜-H+-ATPase在细胞离子稳态的建立和维持过程中起着巨大作用,其活性的变化是植物受伤害的原初位点。钒酸盐常被用作质膜-H+-ATPase的特异性抑制剂(Cantley, 1977、1978),其作用位点位于ATPase的磷酸酶结构域(Serrano, 1989; De Michelis, 1986)。彭建新等(2000)研究发现,钒酸钠可以显著抑制杜氏盐藻()细胞的光合放氧速率,使其生长速率明显降低(魏亮等, 2006)。同时,钒酸盐可显著降低甜土植物()与盐生植物()的v/m(Percey, 2016)。质膜-H+-ATPase基因在红毛菜遭受胁迫时,表达量明显上升(曹原, 2018)。本研究中,S0组的红毛菜与S32处理组的暗紫红毛菜,在钒酸钠胁迫下,v/m值的变化与其他组明显不同(图1)。从研究结果来看,50~200 μmol/L钒酸钠提高了红毛菜对低盐胁迫的耐受性,钒酸钠本身是一种钠盐,而Na+是藻类应对盐胁迫时的关键离子(Balnokin, 1997; Serrano, 1999),在淡水中加入适量钒酸钠,提高了环境中的Na+浓度,从而缓解了低盐胁迫效应。同理,向淡水中添加钒酸钠增加了Na+浓度,导致暗紫红毛菜在对照组(S0)中的v/m随钒酸钠浓度的增加直线下降。而在高盐胁迫下的暗紫红毛菜,启动了一系列高盐胁迫响应机制,此时,加入中等程度的钒酸钠,对其在高盐环境下的影响反而不显著。 基于盐胁迫下红毛菜v/m以及盐胁迫下海水红毛菜质膜-H+-ATPase基因的表达特征,进一步检测了采用质膜-H+-ATPase的特异性抑制剂钒酸钠处理后,红毛菜的光合作用与呼吸作用的变化情况。结果显示,红毛菜在低盐胁迫下,P与R总体低于对照组,可能是盐胁迫导致植物叶绿素降解,从而降低叶绿体对光能的吸收,影响光能在2个光系统间的合理分配,从而降低光合速率(Aro, 1993; 惠红霞等, 2004)。实验后期,红毛菜各胁迫组P与R较为恒定,组间差异不显著;暗紫红毛菜各胁迫组R在1~7 d中均有不同程度的上升(图3)。可能原因是呼吸作用为植物生命活动提供能量,而植物通过调节自身生理状态来适应或抵抗盐胁迫等一系列过程需要消耗大量能量,因此,盐胁迫下暗紫红毛菜的呼吸强度增加。 在添加500 μmol/L钒酸钠后,2种红毛菜P与R在实验前期均出现不同幅度上升,随后,各组有不同程度下降,与v/m结果类似。红毛菜在中等程度盐胁迫下,早期P甚至高于对照组,可能是因为Na+缓解了红毛菜的低盐胁迫效应;随胁迫时间的延长,各胁迫组P显著下降,第7天时,仅S0组显著低于其他各组。R则波动较大(图7),实验后期,各组总体处于同一水平。而暗紫红毛菜在500 μmol/L钒酸钠胁迫下,对照组P从第5天开始直线下降,胁迫组R在第3天时,上升幅度与低盐胁迫程度基本呈正相关,后期P与R均出现胁迫组高出对照组现象。说明红毛菜在正常环境中,钒酸钠抑制了质膜-H+-ATPase活性,从而降低了藻体光合呼吸速率。当红毛菜或暗紫红毛菜应对低盐或高盐胁迫时,出现少数胁迫组P或R升高现象,原因可能是逆境促使质膜-H+-ATPase基因表达上调,质膜-H+-ATPase活性上升,超出钒酸钠可调控范围,对此有待进一步研究证实。 Anderson JM, Evans PK, Goodchild DJ. Immunological cross‐ reactivity between the light‐harvesting chlorophyll a/b‐ proteins of a marine green alga and spinach. Physiologia Plantarum, 1987, 70(4): 597–602 Aro EM, McCaffery S, Anderson JM. Photoinhibition and D1 protein degeradation in peas acclimated to different growth irradiances. Plant Physiology, 1993, 103(3): 835–843 Balnokin Y, Popova L, Gimmler H. Further evidence for an ATP- driven sodium pump in the marine alga(). Journal of Plant Physiology, 1997, 150(3): 264–270 Bräutigam K, Dietzel L, Kleine T,. Dynamic plastid redox signals integrate gene expression and metabolism to induce distinct metabolic states in photosynthetic acclimation in Arabidopsis. Plant Cell, 2010, 21(1): 2715–32 Butterfield NJ.n. gen. n. sp.: Implications for the evolution of sex, multicellularity, and the Mesoproterozoic/Neoproterozoic radiation of eukaryotes. Paleobiology, 2000, 26(3): 386–404 Cantley LCJ, Cantley LG, Josephson L. A characterization of vanadate interactions with the (Na, K)-ATPase.Mechanistic and regulatory implications. Journal of Biological Chemistry, 1978, 253(20): 7361–7368 Cantley LCJ, Josephson L, Warner R,. Vanadate is a potent (Na, K) -ATPase inhibitor found in ATP derived from muscle. Journal of Biological Chemistry, 1977, 252(21): 7421–7423 Cao Y. Study on genetic breeding and functional gene in Bangiaceae. Master′s Thesis of Shanghai Ocean University, 2018 [曹原. 红毛菜科红藻的遗传育种与功能基因研究.上海海洋大学硕士研究生学位论文, 2018] De Michelis MI, Spanswick RM. H-pumping driven by the vanadate-sensitive ATPase in membrane vesicles from corn roots. Plant Physiology, 1986, 81(2): 542–547 Eggert A, Nitschke U, West JA,Acclimation of the intertidal red alga Bangiopsis subsimplex (Stylonematophyceae) to salinity changes. Journal of Experimental Marine Biology and Ecology, 2007, 343(2): 176–186 Gong YH, Gao JF. Recent approach of functional proteins in plant plasma membrane (PM) under drought stress. Acta Botanica Boreali-Occidentalia Sinica, 2002, 22(3): 682–692 Huang WF, Huang JM, Dong FQ,. Value and characteristics of the nutrient elements. Marine Fisheries Research, 1998, 19(2): 57–61 [黄文凤, 黄建明, 董飞强, 等. 红毛菜的营养成分特征和价值. 海洋水产研究, 1998, 19(2): 57–61] Hui HX, Xu X, Li SMPossible mechanism of inhibition on photosynthesis of Lycium barbarum under salt stress. Chinese Journal of Ecology, 2004, 23(1): 5–9 [惠红霞, 许兴, 李守明. 盐胁迫抑制枸杞光合作用的可能机理. 生态学杂志, 2004, 23(1): 5–9] Li XL, Wang WJ, Liu FL,Periodical drying or no drying during aquaculture affects the desiccation tolerance of a sublittoralstrain. Journal of Applied Phycology, 2018, 30(1): 1–9 Liang ZR, Wang FJ, Sun XT,Effects of light intensity, temperature and salinity on newborn branches ofevaluated with chlorophyll fluorescence assay. Marine Sciences, 2011, 35(12): 21–27 [梁洲瑞, 王飞久, 孙修涛, 等. 利用叶绿素荧光技术揭示光照、温度和盐度对鼠尾藻嫩芽的影响. 海洋科学, 2011, 35(12): 21–27] Ma JH, Li SJ, Ji HH,. An analysis of amino acids and fatty acids in. Chinese Journal of Marine Drugs, 2002, 21(5): 40–42 [马家海, 李水军, 纪焕红, 等. 红毛菜的氨基酸和脂肪酸分析. 中国海洋药物, 2002, 21(5): 40–42] Ma XY, Liu FL, Liang ZR,. Effects of pH and salinity stress on photosynthesis and antioxidant system of. Journal of Shanghai Fisheries University, 2014, 23(2): 208–214 [马兴宇, 刘福利, 梁洲瑞,等. pH与盐度胁迫对鼠尾藻光合作用及抗氧化系统的影响. 上海海洋大学学报, 2014, 23(2): 208–214] Müller KM, Cole KM, Sheath RG. Systematics of(Bangiales, Rhodophyta) in North America. II. Biogeographical trends in karyology: Chromosome numbers and linkage with gene sequence phylogenetic trees. Phycologia, 2003, 42(3): 209–219 Pfannschmidt T. Chloroplast redox signals: How photosynthesis controls its own genes. Trends in Plant Science, 2003, 8(1): 33–41 Percey WJ, Mcminn A, Bose J,. Salinity effects on chloroplast PSⅡ performance in glycophytes and halophytes1. Functional Plant Biology, 2016,43(11): 1003–1015 Peng JX, Wang GQ, Qian YQ,Studies on photosynthetic properties ofcells. Acta Hydrobiologica Sinica, 2000, 24(1): 42–47 [彭建新, 王国强, 钱月琴, 等. 盐生杜氏藻细胞光合特性的研究. 水生生物学报, 2000, 24(1): 42–47] Schreiber U, Bilger W, Neubauer C. Chlorophyll fluorescence as a nonintrusive indicator for rapid assessment of in vivo photosynthesis. Ecological Studies, 1995, 100:49–70 Serrano R, Mulet JM, Rios G,. A glimpse of the mechanismsof ion homeostasis during salt stress. Journal of Experimental Botany, 1999, 50 (Special issue): 1023–1036 Serrano R. Structure and function of plasma membrane ATPase. Annual Review of Plant Physiology and Plant Molecular Biology, 1989, 40: 61–94 Wang WJ, Shen ZG, Sun XT,. Photosynthetic response of(Bangiales, Rhodophyta) towards dehydration and hyposalinity. Biologia, 2018, 73(4): 1–5 Wang WJ, Shen ZG, Sun XT,De novo transcriptomics analysis revealed a global reprogramming towards dehydration and hyposalinity in, gametophytes (Rhodophyta). Journal of Applied Phycology, 2019, 31(1): 637-651 Wang WJ, Sun XT, Liu FL,. Effect of abiotic stress on the gameophyte ofvar.(Bangiales, Rhodophyta). Journal of Applied Phycology, 2016, 28(1): 469–479 Wang WJ, Wang GC, Xu P,. Biology ofⅠ. Life history and sexual reproduction. Marine Sciences, 2008, 32(4): 92–97 [汪文俊, 王广策, 许璞, 等. 红毛菜生物学研究进展Ⅰ. 生活史和有性生殖研究. 海洋科学, 2008, 32(4): 92–97] Wang XY, Zhan DM, Li MZ,. Preliminary studies on the nitrogen and phosphorus absorption capability of macroalgae. Marine Fisheries Research, 2011, 32(4): 67–71 [王翔宇, 詹冬梅, 李美真, 等. 大型海藻吸收氮磷营养盐能力的初步研究. 渔业科学进展, 2011, 32(4): 67–71] Wei L, Deng TT, Liu Y,. The Effects on Na+-export mechanisms in plasma membrane ofcaused by LiCl and orthvanadate. Journal of Sichuan University (Natural Science), 2006, 43(3): 677–681 [魏亮, 邓婷婷, 刘谊, 等. 钒酸钠和氯化锂对盐藻质膜排钠系统的影响. 四川大学学报(自然科学版), 2006, 43(3): 677–681] Woolcott GW, King RJ.and(Bangiaceae, Rhodophyta) in warm temperate waters of eastern Australia: Morphological and molecular analyses. Phycological Research, 1998, 46(2): 111–123 Wang XZ, Qian XQ, Shan YH,. Inhibitory effect of vanadateon plasma membrane H+-ATPase activity of corn roots. Journal of Yangzhou University (Agricultural and Life Science), 2010, 31(1): 65–69 [王小治, 钱晓晴, 单玉华, 等. 钒酸盐对玉米根质膜H+-ATPase的抑制机理研究. 扬州大学学报(农业与生命科学版), 2010, 31(1): 65–69] Yao HQ, Liang ZR, Liu FL,. Preliminary studies on the photosynthetic and respiration rate of young sporophyte of a newvariety “Haitian No.1” using liquid-phase oxygen measurement system. Progress in Fishery Sciences, 2016, 37(1): 140–147 [姚海芹, 梁洲瑞, 刘福利, 等. 利用液相氧电极技术研究“海天1号”海带()幼孢子体光合及呼吸速率. 渔业科学进展, 2016, 37(1): 140–147] Yao CY, Jiang HX, Zhu JY,. Effects of temperature stress on chlorophyll fluorescence characteristics of conchocelis in. Jiangsu Agricultural Sciences, 2011(1): 277–282 [姚春燕, 姜红霞, 朱建一, 等. 温度胁迫对紫菜丝状体叶绿素荧光特性的影响. 江苏农业科学, 2011(1): 277–282] Yang YL, Zhang F, Zhang LXEffect of NaCl on the activity of the plasma membrane ATPase from wheat roots. Acta Botanica Boreali-Occidentalia Sinica, 2003, 23(3): 401–405 Zhang SR. A discussion on Chlorophyll fluorescence kinetics parameters and their significance. Chinese Bulletin of Botany, 1999, 16(4):444–448 [张守仁. 叶绿素荧光动力学参数的意义及讨论. 植物学通报, 1999, 16(4): 444–448] Zhang M, Zeng B, Zhang Y,. Temperature affects the relation between photosynthetic electron transport and oxygen evolution of algae. Acta Ecologica Sinica, 2010, 30(24): 7087–7091 [张曼, 曾波, 张怡, 等. 温度变化对藻类光合电子传递与光合放氧关系的影响. 生态学报, 2010, 30(24): 7087–7091] Zhang YR, Liu F, Shan TF,. Stress resistance of young seedlings ofto a variety of temperatures, irradiances and salinities revealed by chlorophyll fluorescence measurements. South China Fisheries Science, 2009, 5(2): 1–9 [张玉荣, 刘峰, 单体锋, 等. 利用叶绿素荧光技术揭示人工培育的铜藻幼苗对胁迫温度、光照和盐度的反应. 南方水产科学, 2009, 5(2): 1–9] Zhao LQ, Zhang F, Guo JK,. Nitric oxide functions as a signal in salt resistance in the calluses from two ecotypes of reed. Plant Physiology, 2004, 134(2): 849–857 Zhu ZM, Mao GL, Xu X,. Effect of salt stress and inhibitor on uptake and transportation of Na+and K+in the root of NingxiaL. Agricultural Research in the Arid Areas, 2017, 35(6): 140–145 [朱志明, 毛桂莲, 许兴, 等. 盐胁迫下宁夏枸杞根系Na+、K+平衡及抑制剂对其影响的研究. 干旱地区农业研究, 2017, 35(6): 140–145] Effects of Salinity and Na3VO4Stress on Photosynthetic Physiology of WEI Jiahui1,2, LI Xiaolei2, MA Deying2, WANG Wenjun2,3①, LIANG Zhourui2,3, LI Guoliang1,2, LIU Fuli2,3, SUN Xiutao2,3, WANG Feijiu2 (1. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306; 2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture and Rural Affairs, Qingdao 266071; 3. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266071) The effect of salinity and Na3VO4on photosynthesis ofandwas investigated, respectively, to investigate the photosynthetic physiology of, using chorophyll Ⅱ fluorescence and photosynthetic oxygen evolution measurements. The main results were as follows: The conversion efficiency of primary light energy of PSⅡ (v/m) ofdeclined rapidly in salinity conditions lower than natural seawater while that ofdeclined in salinity higher than freshwater, and the decrease was positively related to the level of stress. Thev/mofwas significantly inhibited under salinity 0 and 8 after 3 days of hyposaline treatment. No significant difference was seen among the different hyposalinity-stressed groups of. Thev/mofunder hypersaline stress was significantly lower than that of the control from the first day, and recovered to control levels after 6 or 7 days of hypersaline treatment. Saline stress had significant effects on net photosynthetic rate (P) in bothspecies. Respiratory oxygen consumption rate (R) decreased at the early stage and then rapidly recovered to the level of the control on the first day. After 1 day,Rof the hyposalinity-stressedgroups was significantly lower than the control. As the hypersalinity continued,Rof the stressedincreased and became significantly higher than the control. After 3 days, thev/mofdecreased significantly under treatment with 200~500 μmol/L Na3VO4. The decrease ofv/minwith Na3VO4treatment was positively correlated with Na3VO4concentration. In general, with an increase in Na3VO4concentration, the salinity stress had significant inhibitory effect on thev/mandPof.Rof bothandincreased with stress, an effect that was more obvious in. The present results reveal that both marine and freshwaterrespond quickly to saline stress. The enhancement ofRand regulation of plasma membrane-H+-ATPase may play an important role in response to saline stress. Long-term saline stress had irreversible harmful effects on photosynthesis in. ; Salinity; Sodium orthovanadate; Conversion efficiency of primary light energy of PS Ⅱ; Net photosynthetic rate; Respiratory oxygen consumption rate WANG Wenjun, E-mail: wjwang@ysfri.ac.cn S968.43 A 2095-9869(2020)05-0017-09 10.19663/j.issn2095-9869.20190628003 http://www.yykxjz.cn/ 魏家慧, 李晓蕾, 马德英, 汪文俊, 梁洲瑞, 李国梁, 刘福利, 孙修涛, 王飞久. 盐度及钒酸钠胁迫对红毛菜光合生理的影响. 渔业科学进展, 2020, 41(5): 141–149 Wei JH, Li XL, Ma DY, Wang WJ, Liang ZR, Li GL, Liu FL, Sun XT, Wang FJ. Effects of salinity and Na3VO4stress on photosynthetic physiology of. Progress in Fishery Sciences, 2020, 41(5): 141–149 * 国家自然科学基金项目(31672630)、国家重点研发计划(2018YFD0901500)、山东省农业良种工程(南种北繁)项目(2017LZN013)和现代农业产业技术体系(CARS-50)共同资助[This work was supported by National Natural Science Foundation of China (31672630), National Key Research and Development Program of China (2018YFD0901500), Shandong Agricultural Good Seed (South to North) Project (2017LZN013), and China Agriculture Research System (CARS-50)]. 魏家慧,E-mail: 997427166@qq.com 汪文俊,研究员,E-mail: wjwang@ysfri.ac.cn 2019-06-28, 2019-07-29 (编辑 陈 辉)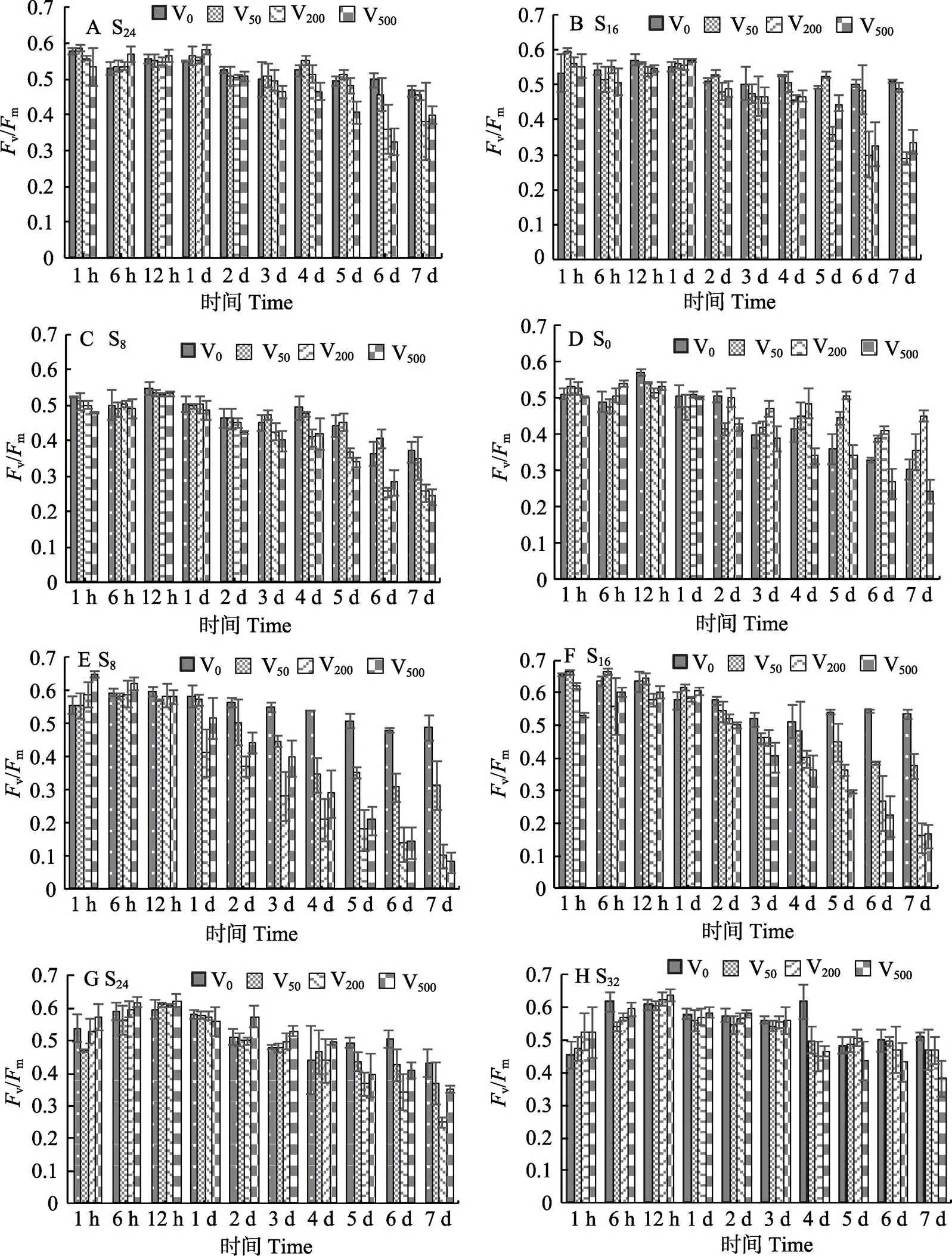
3 讨论

