一种大量提取猕猴桃不同组织高质量总RNA的方法
刘林娅,杨 那,代 玥,罗 彩,陈 婷,黄亚成
(六盘水师范学院 生物科学与技术学院,贵州 六盘水 553000)
猕猴桃(ActinidiachinensisPlanch.)隶属猕猴桃科(Actinidiaceae)猕猴桃属(ActinidiaLindl.),目前全世界共有54个种、21个变种[1]。从20世纪初被人工驯化栽培至今,猕猴桃的商业化种植栽培已在全世界展开,其中我国目前已成为栽培面积最大的国家[2]。猕猴桃果实风味独特,富含丰富的维生素C、氨基酸、膳食纤维和多种矿物质,是近几年世界上发展迅速的高档水果之一[3]。此外,猕猴桃除了具有较高的营养价值外,还具有重要的保健功能[4],如:能通便和清理肠胃;降血脂;防治心血管病;预防癌症等。因此,近些年猕猴桃越来越受到人们的广泛关注。
随着现代分子生物学手段的发展,高通量测序[5]、mRNA纯化[6]、cDNA文库构建[6]和Northern blot[7]等技术已被应用到猕猴桃的研究中,而这些技术能够开展的前提就是能够得到纯度高、质量好且量多的总RNA。目前,植物中各组织总RNA的提取方法主要有以下几种:(1)试剂盒提取方法。该方法在提取RNA时一般用时较短,且能得到较高质量的RNA[8]。但是此方法一次提取的费用较高,且提取量较少,不能满足某些需要大量RNA的实验。(2)CTAB(十六烷基三甲基溴化铵)法。该法对于大多数的植物能够得到较高质量的RNA[9],但对于多糖多酚的植物组织,如果不加以改进,则很难适用。(3)热硼酸法。硼酸钠能够很好地结合酚类物质和沉淀糖类,获得较高质量的RNA[10],但不适用于蛋白含量多、成分复杂的植物组织。(4)SDS(十二烷基磺酸钠)法。此方法对于橡胶树胶乳中总RNA的提取效果好[11],但是其细胞裂解能力一般,对于多糖多酚的植物或者细胞壁较厚的组织细胞就很难获得较高质量的RNA。(5)Trizol法。该方法适于提取拟南芥[12]等植物幼嫩组织的总RNA,但对树皮、根等组织的提取效果较差,且得到的RNA质量一般也较差。此外,提取RNA的方法还有异硫氰酸胍法[13]、高盐高pH法[14]、热酚法[15]等等。不过,很难有一种方法适合所有植物组织的总RNA提取。因此根据不同植物组织的特点在现有的提取方法上改良出更优的方法,从而获得大量、高质量的总RNA满足实验需要很有必要。
猕猴桃属于富含多糖、蛋白质、矿物质、维生素C、色素和多酚类物质的植物材料,这对于总RNA的提取无疑带来了大量的困难。为了能够快速获得大量、高质量的猕猴桃RNA,本研究对CTAB法进行了改良、优化,利用改良的CTAB法对猕猴桃的7种组织(果实、雄花、雌花、叶片、种子、皮、根)进行了总RNA的提取,并与试剂盒提取法进行了比较,结果证实此方法适用于猕猴桃不同组织总RNA的提取,能够得到大量、高质量的总RNA,可以满足分子生物学实验要求。
1 材料与方法
1.1 实验材料
本实验所用的猕猴桃品种为中华猕猴桃“红阳”,种植在贵州省六盘水市米箩乡猕猴桃基地。分别采集猕猴桃的果实、雄花、雌花、叶片、种子、皮和根,用锡箔纸包裹存入液氮中,运回实验室保存于-80 ℃冰箱内,备用。
1.2 试剂
CTAB(十六烷基三甲基溴化铵)、PVPP(交联聚乙烯吡咯烷酮)、PVP(聚乙烯吡咯烷酮)、DTT(二硫苏糖醇)、硼酸钠、EDTA(乙二胺四乙酸)、β-巯基乙醇、LiCl(氯化锂)、Tris(三羟甲基氨基甲烷)、NaAc(醋酸钠)购于北京索莱宝科技有限公司;无氯仿多糖多酚植物RNA提取试剂盒购自北京百泰克生物技术有限公司(RP3501);Recombinant DNase I(RNase-free)(2270A)和逆转录试剂盒PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)(RR047A)购自大连宝生物工程有限公司; TransTaq®DNA Polymerase High Fidelity(HiFi)购自北京全式金生物技术有限公司(AP131-11);其他所用生化试剂均为国产分析纯。引物在上海捷瑞生物工程有限公司合成;测序在上海生物工程技术有限公司完成。
1.3 实验方法
1.3.1 用改良的CTAB法提取猕猴桃各组织的总RNA 提取液配方:2%(w/v)CTAB, 100 mmol/L Tris-Cl(pH 8.0), 20 mmol/L EDTA(pH 8.0),100 mmol/L硼酸钠,2.8 mol/L NaCl, 1%(w/v)PVP, 1%(v/v)β-巯基乙醇(现用现加)。
将液氮中保存的植物样品置于研钵,加入一定量的石英砂、DTT、PVPP,用液氮研磨成粉末,备用。称取2 g研磨好的样品,加入5 mL预热过的提取液和50 μL β-巯基乙醇,在65 ℃下水浴15 min左右(期间振荡混匀4~5次)。然后加入等体积的酚/氯仿/异戊醇(25∶24∶1),颠倒混匀,在4 ℃下以12000 r/min离心20 min。取上清,加入等体积的氯仿/异戊醇(24∶1),颠倒混匀,在4 ℃下以12000 r/min离心20 min。取上清,加入1/3体积的8 mol/L LiCl,在-20 ℃下放置6 h以上。在4 ℃下以12000 r/min离心20 min,然后倒掉上清,加入200 μL RNase-free的ddH2O溶解沉淀,转移到1.5 mL的离心管,加入1/10体积 3 mol/L NaAc(pH 5.2)和2.5倍体积的无水乙醇,充分混匀,在-20 ℃下放置2~4 h。在4 ℃下以12000 r/min离心 20 min,倒掉上清,沉淀用750 μL的75%乙醇漂洗2次,放于超净工作台上晾干,然后溶于60 μL RNase-free ddH2O中。
1.3.2 用试剂盒法提取猕猴桃各组织的总RNA 参照北京百泰克生物技术有限公司无氯仿多糖多酚植物RNA试剂盒说明书进行猕猴桃各组织总RNA的提取。
1.3.3 总RNA中DNA的去除 使用大连宝生物工程有限公司的Recombinant DNase I(RNase-free)进行总RNA中DNA的去除,具体操作参照该公司的操作说明书。
1.4 RNA的完整性、纯度和浓度检测
采用2%的琼脂糖凝胶电泳检测总RNA的完整性,在160 V电压下电泳20 min后进行凝胶成像。RNA的纯度和浓度用NanoDrop 2000超微量核酸蛋白测定仪进行测定,直接读取总RNA浓度、OD260/OD280值和OD260/OD230值。
1.5 RT-PCR验证
使用大连宝生物工程有限公司的逆转录试剂盒进行cDNA第一链的合成,按照该公司的说明书进行操作。搜索本实验室的猕猴桃转录组数据库,获得猕猴桃18S rRNA基因序列,设计引物(正向引物:5’-TGTGAAACTGCGAATGGCTC-3’;反向引物:5’-ATTTGAATGATGCGTCGCC-3’),以用两种方法提取的RNA逆转录后的cDNA为扩增模板进行基因的扩增。反应体系:10×PCR Buffer 2.5 μL、2.5 mmol/L dNTP 2 μL、cDNA模板1.5 μL、10 μmol/L的正向引物和反向引物各1 μL、Taq DNA Polymerase 0.2 μL(5 U/μL)、ddH2O 16.8 μL,共25 μL。反应程序:95 ℃预变性5 min;95 ℃变性30 s, 60 ℃退火30 s,72 ℃延伸30 s,共25个循环;72 ℃延伸8 min。PCR扩增产物用1.5%的琼脂糖凝胶电泳进行检测。
2 结果与分析
2.1 RNA完整性的检测结果
采用本实验室改良的CTAB法和无氯仿多糖多酚植物RNA提取试剂盒两种方法分别提取了猕猴桃果实、雄花、雌花、叶片、种子、皮和根共7个组织的总RNA。如图1和图2所示,采用改良的CTAB法和试剂盒法都能在猕猴桃的7个组织中提取到总RNA,能看到有18S和28S两条清晰条带,其中28S条带的亮度是18S条带亮度的2倍左右,且两条带之间没有明显的拖尾现象。这表明这两种方法都适用于猕猴桃不同组织中总RNA的提取,都能获得完整性较高的总RNA。

1:果实;2:雄花;3:雌花;4:叶片;5:种子;6:皮;7:根。下同。
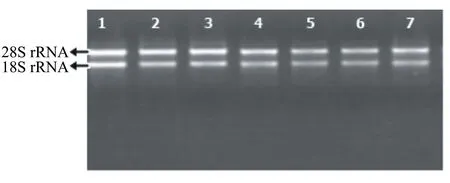
图2 用试剂盒法提取的总RNA电泳图
2.2 RNA的纯度和浓度检测结果
利用NanoDrop2000超微量分光光度计对提取好的猕猴桃各组织的总RNA进行检测。由表1可知,所有RNA的OD260/OD280值在1.8~2.0之间,OD260/OD230值均大于2.0。这表明,不管是本实验室改良的CTAB法还是试剂盒法,提取得到的猕猴桃不同组织中的总RNA含有的杂质较少,纯度较高。比较用改良CTAB法和试剂盒法提取的总RNA的浓度,改良CTAB法的得率远远高于试剂盒法,说明该方法实现了对猕猴桃不同组织总RNA的大量提取。结合上述的电泳结果,说明采用本实验室的提取方法可以获得大量、高质量的猕猴桃各组织的总RNA。
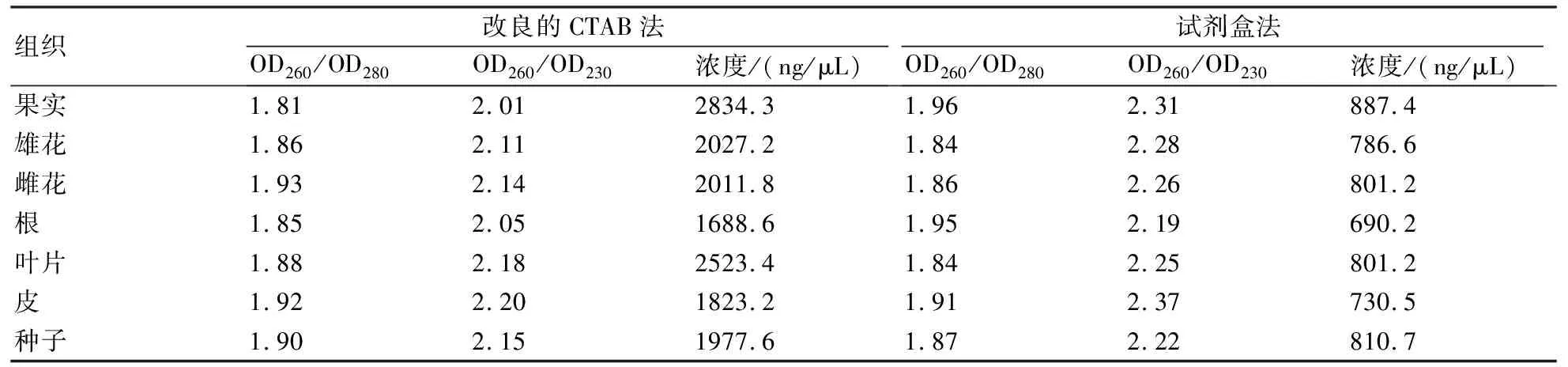
表1 采用两种方法提取猕猴桃7种组织的总RNA的纯度和浓度
2.3 改良CTAB法和试剂盒法的RT-PCR验证结果
利用购自大连宝生物工程有限公司的逆转录试剂盒对两种方法提取得到的猕猴桃各组织的总RNA进行逆转录,获得了cDNA的第一条链。进一步选取内参基因18S rRNA设计特异性引物,以逆转录得到的cDNA第一链为模板,进行RT-PCR,检测提取得到的总RNA的质量。图3的电泳图显示,采用两种方法分别提取的猕猴桃7个组织的总RNA都能扩增得到与目的条带大小相符的单一条带。对所有扩增条带进行测序,测序结果与18s rRNA的序列均一致。这表明,采用两种方法提取得到的总RNA的质量较高,这两种方法适于猕猴桃不同组织总RNA的提取。

8:DL1000;7、9:果实;6、10:雄花;5、11:雌花;4、12:叶片;3、13:种子;2、14:皮;1、15:根。
3 讨论
众所周知,提取富含多糖多酚的植物组织材料中的RNA难度一般较大。这主要是由于多糖类物质会形成胶状物质,很难通过离心得到上清溶液,且其理化性质与RNA极其相似,常常会与RNA共沉淀导致很难去除[16]。而细胞中的多酚类物质在细胞破碎后会迅速被氧化生成醌类物质,与RNA不可逆地结合,导致RNA褐化而难以溶解[17]。猕猴桃的果实富含多糖、多酚类、蛋白质、矿物质、维生素C、色素和其他次生代谢物,属于较难提取到大量、高质量RNA的植物组织材料。据已有的研究报道,猕猴桃果实中总RNA的提取方法主要有改良的CTAB法[9]、总核酸提取法[18]、异硫氰酸胍提取法[13]、改良的SDS法[19]和试剂盒法[8]。但是相对而言,除了采用试剂盒法能够得到质量较高的总RNA外,其他已有方法的提取效果都不够好。而且,之前这些方法主要用于猕猴桃果实RNA的提取,并没有一种方法适用于猕猴桃所有组织材料RNA的提取。因此本实验室结合了现有的RNA提取方法,以CTAB法为基础进行改良,获得了一种能够大量提取猕猴桃不同组织总RNA的方法。
本方法采用液氮加石英砂的方法研磨植物组织材料,能大大提高细胞的破碎效率。同时,在研磨的时候加入DTT和PVPP, DTT作为强还原剂能够保证多酚类物质在研磨和贮存的过程中不被氧化;不可溶的吸附剂PVPP能在一定程度上吸附花色苷、黄酮和多酚类物质。因此加入这两种物质能在一定程度上降低多酚类、花色苷等物质对RNA提取的影响。CTAB作为一种阳离子表面活性剂,可以在高盐的环境下结合多糖、多酚和蛋白质,常被用于各种多糖多酚植物RNA的提取。结合猕猴桃组织材料的特点,本实验室以CTAB法为基础,在以下方面进行了改良:(1)在提取液中,提高了氯化钠的浓度,以促进CTAB对多糖、多酚类、蛋白质等物质的结合能力;(2)在提取液中加入了较高浓度的PVP和β-巯基乙醇。β-巯基乙醇作为抗氧化剂可以抑制多酚类物质的氧化,从而提高RNA的产率和纯度。此外,PVP还能有效地去除色素、脂类等物质;(3)在提取液中加入了硼酸钠。硼酸一方面可以与酚类物质结合从而抑制其氧化,另一方面还可以沉淀多糖类物质,从而提高RNA产率和纯度[10];(4)在RNA的沉淀过程中,采用了两步沉淀法。首先用8 mol/L LiCl沉淀6 h以上,高浓度的LiCl可以选择性沉淀RNA,从而可以在一定程度上减少DNA、糖类和其他杂质的污染。其次,用2.5倍体积的无水乙醇加3 mol/L NaAc(pH 5.2)进行第二次沉淀。低pH的NaAc可以使沉淀的效果更好,从而提高RNA的得率。利用该方法提取得到的RNA只要再用DNase I进行DNA的去除便可以满足绝大多数分子生物学实验的要求。通过与市场上专门用来提取多糖多酚类植物组织RNA的试剂盒法比较,该方法确实能在猕猴桃各种组织中提取到大量、高质量的总RNA。相对于试剂盒法,虽然本方法耗时较长,但是获得的RNA量更多,而且成本也更低。
4 结论
改良的CTAB法和试剂盒法均能用于猕猴桃各组织中总RNA的提取,在具体的实验中可以根据实际情况进行选择。改良的CTAB法对其他富含多糖多酚类植物组织中总RNA的提取具有较好的参考价值。

