Cyanex272萃取分离锰与镁钙试验研究
张 栋,张贵清,曾 理,武新生,关文娟,李青刚,曹佐英,巫圣喜
(1.中南大学 冶金与环境学院,湖南 长沙 410083;2.冶金分离科学与工程重点实验室,湖南 长沙 410083)
锰系正极材料具有价格和环境优势,在锂离子电池正极材料领域的应用前景十分广阔[1-2]。正极材料中杂质离子的存在会对锂离子电池的高温形貌和循环性能有严重影响[3]。硫酸锰是锂离子电池最重要的锰源材料[4],其中的钙、镁杂质质量分数必须严格控制在5×10-5以下(HG/T4823—2015)。在电池级硫酸锰制备过程中,实现锰与钙、镁等杂质离子之间的深度分离具有非常重要意义。
目前,从硫酸锰溶液中深度去除钙、镁的工业方法[5]主要有氟化物沉淀法、浓缩结晶法和电解法。经氟化物沉淀法处理后的硫酸锰溶液,其钙、镁杂质含量可以满足电池级硫酸锰生产要求[6-8],但该法存在产生含氟废渣和废水及腐蚀设备等问题[9];当溶液中钙、镁杂质含量较高时,浓缩结晶法须反复多次结晶[10-11],且锰回收率不高。电解法是通过电解沉积获得金属锰,然后用硫酸溶解金属锰获得高纯度硫酸锰产品,生产过程复杂、能耗大,生产成本较高。
溶剂萃取法具有流程短、效率高、能耗低等优势,被认为是最具前景的从硫酸锰溶液中深度去除钙、镁杂质的方法。常用萃取剂主要有P204,P507等。萃取机制是萃取剂中的共轭碱与金属阳离子配位[12-17],但萃取分离锰与钙、镁后,硫酸锰中的钙、镁含量难以满足电池级硫酸锰生产要求。P204萃取金属离子的pH50顺序是Ca2+>Mn2+>Mg2+,用P204萃取不能同时实现锰与镁、钙的分离;而且钙、锰分离系数小,即使采用两段萃取也难以实现钙、锰分离。P507萃取金属离子的pH50顺序为Mn2+≈Ca2+>Mg2+,钙、锰分离也较困难。采用P204/4PC协同萃取体系可以选择性萃取锰,实现锰与镁、钙之间的深度分离[18],但这种混合萃取剂增加了体系的复杂性,尚未实现工业应用。
Cyanex272萃取剂在萃取分离钴、镍及稀土和有色金属中得到广泛应用,是一种成熟的工业萃取剂[19]。其对锰的萃取能力大于对钙和镁的萃取能力[20],但有关选择性萃取锰实现锰与镁、钙的深度分离、获得满足电池级硫酸锰生产要求的溶液的工艺研究尚未见报道。试验研究了用Cyanex272从含钙、镁的硫酸锰溶液中选择性萃取锰,并实现锰与镁、钙的深度分离。
1 试验部分
1.1 试验原料与试剂
试验用含钙、镁杂质的硫酸锰溶液的主要组成见表1。

表1 料液的主要组成 g/L
Cyanex272,一种酸性含磷萃取剂,二(2,4,4-三甲基戊基次膦酸),由上海氰特化工有限公司提供,纯度85%;磺化煤油,用作稀释剂;浓氨水,用作皂化剂;98%浓硫酸,用于配制反萃取剂。
MnSO4·H2O、CaSO4·2H2O、MgSO4·7H2O,用于配制料液。
所有试剂均为分析纯。
1.2 试验设备
萃取、洗涤、反萃取均在梨形分液漏斗中于恒温水浴振荡器(SXL-70)中进行,振荡频率200 r/min,其他主要设备有HI9125S数字pH计、电子天平。
1.3 试验原理
通过理论计算,量取一定体积浓氨水与配制的有机相充分振荡混合。酸性萃取剂用通式HR表示,皂化反应式为
将皂化Cyanex272有机相与模拟料液加入分液漏斗,恒速振荡一定时间后,静置分层,分别得到负载有机相和萃余液。皂化有机相的萃取反应式为
负载锰的有机相用硫酸溶液反萃取,得到硫酸锰反萃取液。反萃取过程可表示为
1.4 分析方法
溶液中锰浓度用乙二胺四乙酸二钠滴定法测定[21],钙、镁浓度用ICP-OES(ICAP7400 Raidal)测定;有机相中各元素浓度根据萃取前、后水相浓度和体积变化计算。
串级试验中,有机相中金属离子浓度通过对有机相进行多次反萃取,然后经ICP测定反萃取液中金属离子浓度后累加所得。
萃取率、分配比、分离系数、除杂率分别按式(1)~(4)计算。
(1)
(2)
(3)
(4)
式中:E—金属萃取率,%;D—分配比;β(A/B)—A与B的分离系数;ρO、ρA—萃取平衡后有机相、水相中金属离子质量浓度,g/L;cO、cA—萃取平衡后有机相、水相中金属离子浓度,mol/L;VO、VA—萃取平衡后有机相、水相体积,mL;η—去除率,%;ρ1、ρ1'—模拟试验前料液中杂质及锰离子质量浓度,g/L;ρ2、ρ2'—试验后反萃取液中杂质及锰离子质量浓度,g/L。
2 试验结果与讨论
2.1 Cyanex272萃取分离锰
2.1.1 有机相中Cyanex272浓度对萃取的影响
料液中Mn2+、Mg2+、Ca2+质量浓度分别为28.13、1.26、0.47 g/L,相比VO/VA=1/1、温度25 ℃,混合时间15 min,有机相皂化率50%,体系平衡pH=4.01,萃取剂浓度对金属离子萃取分离效果的影响试验结果如图1所示。可以看出:随Cyanex272浓度升高,Mn2+萃取率升高,而Mg2+、Ca2+萃取率基本保持稳定,均低于7%;分离系数β(Mn2+/Mg2+)、β(Mn2+/Ca2+)显著增大。试验中发现,Cyanex272浓度高于0.75 mol/L后,Mn2+萃取率继续提高,但有机相黏度明显增大,两相分离速度显著降低。试验选择Cyanex272浓度为0.75 mol/L。

—■—Mn2+;—●—Mg2+;—▲—Ca2+;—○—β(Mn2+/Mg2+);—△—β(Mn2+/Ca2+)。图1 Cyanex272浓度对金属离子萃取分离效果的影响
2.1.2 水相平衡pH对萃取的影响
体系平衡pH通过控制有机相皂化率来实现。萃取剂浓度0.75 mol/L,料液中Mn2+、Mg2+、Ca2+质量浓度分别为28.54、1.31、0.52 g/L,相比VO/VA=1/1,温度25 ℃,混合时间15 min,水相萃取平衡pH对金属离子萃取分离效果的影响试验结果如图2所示。

—■—Mn2+;—●—Mg2+;—▲—Ca2+;—○—β(Mn2+/Mg2+);—△—β(Mn2+/Ca2+)。图2 水相平衡pH对金属离子萃取分离效果的影响
由图2看出:水相平衡pH小于4.60时,Mn2+萃取率随pH升高而急剧升高,但Mg2+、Ca2+萃取率均稳定在较低水平(<7%);随平衡pH继续升高,Mn2+萃取率增速放缓,Mg2+、Ca2+萃取率升高明显;平衡pH=5.28时,Ca2+、Mg2+萃取率分别为16.3%和11.8%,说明有机相中Ca2+、Mg2+共萃量明显升高。值得注意的是,β(Mn2+/Mg2+)、β(Mn2+/Ca2+)均呈先升高后降低趋势,在水相平衡pH为4.60时达最大,分别为26和14,这说明该条件下Mn2+与Mg2+、Ca2+的分离效果最好。因此,控制水相萃取平衡pH以4.60左右为宜。
2.1.3 萃取时间对萃取的影响
萃取剂浓度0.75 mol/L,料液中Mn2+、Mg2+、Ca2+质量分别为28.54、1.31、0.52 g/L,相比VO/VA=1/1,温度25 ℃,有机相皂化率60%,平衡pH=4.42,萃取时间对萃取分离效果的影响试验结果如图3所示。
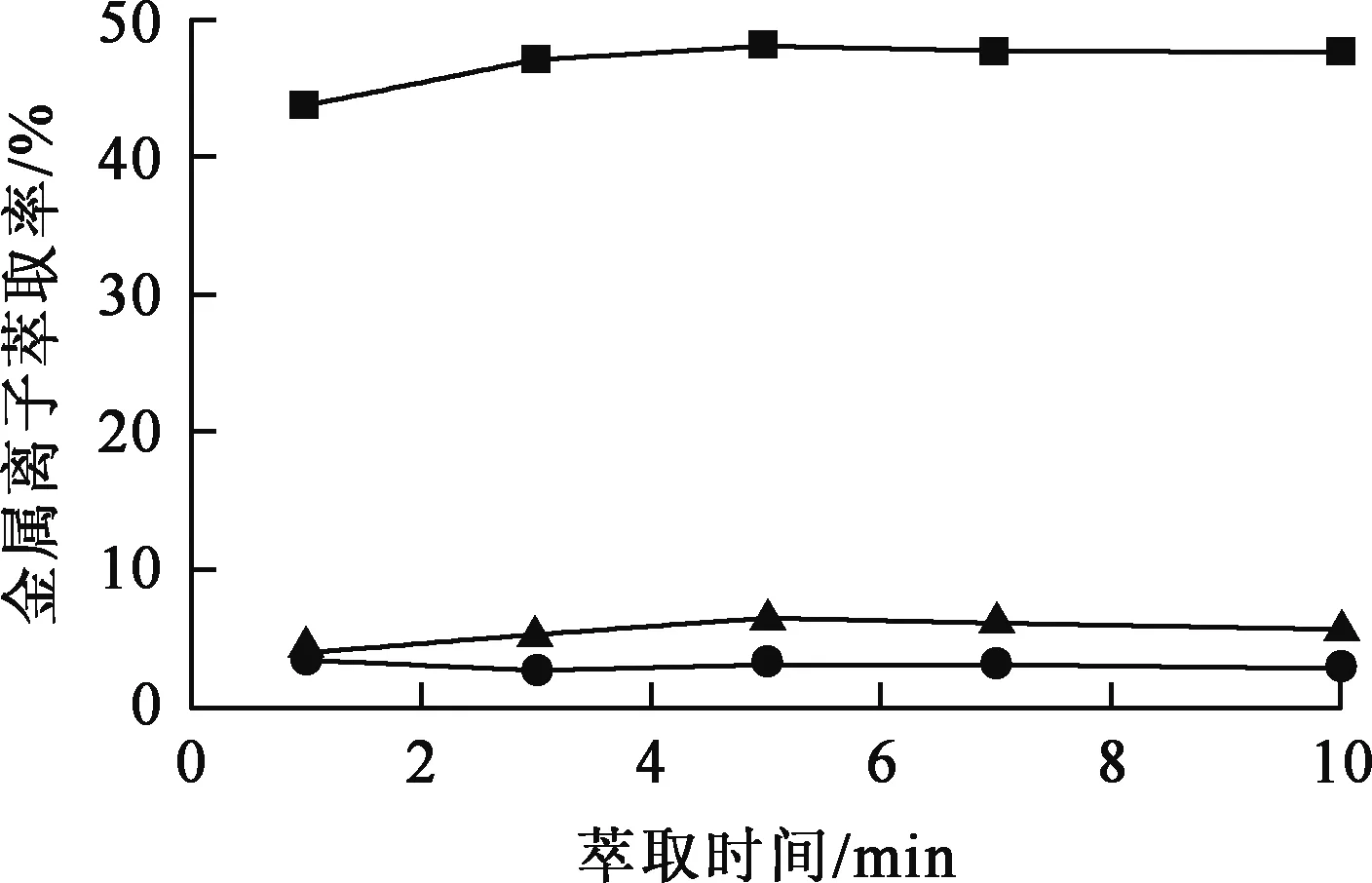
—■—Mn2+;—●—Mg2+;—▲—Ca2+。图3 萃取时间对金属离子萃取分离效果的影响
由图3看出:萃取反应速度很快,5 min即达平衡;Mn2+萃取率在反应时间低于5 min时缓慢升高,5 min后基本保持不变;随反应时间延长,Ca2+、Mg2+萃取率变化不明显。为了保证萃取反应充分,后续试验萃取时间选用10 min。
2.1.4 萃取等温线
料液中Mn2+质量浓度为29.30 g/L,有机相中萃取剂浓度0.75 mol/L,温度25 ℃,相比VO/VA=2/1,料液为新配溶液,两相接触时间10 min, 水相平衡pH为4.60,采用饱和法绘制萃取等温线[14],结果如图4所示。

图4 Mn2+的萃取等温线
由图4看出:有机相对Mn2+的饱和萃取量为14 g/L。根据等温线,应用McCabe-Thiele图解法预测逆流萃取所需级数:在操作线斜率1/R=1/3时,4级逆流萃取后Mn2+萃取率可达99%。
2.2 负载有机相的洗涤
2.2.1 洗涤剂浓度的影响
为避免引入其他杂质,以去离子水或稀硫酸为洗涤剂,对负载有机相进行洗涤。负载有机相中Mn2+、Mg2+、Ca2+质量浓度分别为11.5、0.004、 0.015 g/L,温度25 ℃,洗涤相比VO/VA=5/1,混合时间15 min,洗涤结果如图5所示。

—■—Mn2+;—●—Mg2+;—▲—Ca2+。图5 洗涤剂对负载有机相中金属离子洗脱率的影响
由图5看出:用去离子水洗涤,Ca2+洗脱率为92%,Mg2+洗脱率为46.91%,这表明绝大部分Ca2+和部分Mg2+是物理夹带进有机相的,此时Mn2+洗脱率仅1%;用稀硫酸溶液(0.15 mol/L)洗涤,Mg2+洗脱率为60.74%,但Mn2+洗脱率也会增大至9.85%。考虑到负载有机相中Mn2+含量高,Ca2+、Mg2+含量低,为保证锰回收率,选用去离子水作洗涤剂洗涤负载有机相。
2.2.2 洗涤时间的影响
洗涤剂为去离子水,负载有机相中,Mn2+、Mg2+、Ca2+质量浓度分别为11.5、0.004、0.015 g/L,温度25 ℃,洗涤相比VO/VA=5/1,洗涤时间对负载有机相中杂质离子洗脱率的影响试验结果如图6所示。

—●—Mg2+;—▲—Ca2+。图6 洗涤时间对负载有机相中杂质离子洗脱率的影响
由图6看出:随洗涤时间延长,Ca2+、Mg2+洗脱率升高,在洗涤10 min时达平衡,之后保持不变。因此,适宜的洗涤时间选择为10 min。
2.3 硫酸反萃取
2.3.1 反萃取剂浓度对锰反萃取率的影响
负载有机相中Mn2+质量浓度10.6 g/L,温度25 ℃,反萃取相比VO/VA=10/1,混合时间15 min, 用硫酸作反萃取剂,硫酸浓度对锰反萃取率的影响试验结果如图7所示。

图7 硫酸浓度对锰反萃取率的影响
由图7看出:硫酸浓度低于2.5 mol/L条件下,Mn2+反萃取率随硫酸浓度增大逐渐升高至96%;硫酸浓度高于2.5 mol/L时,Mn2+反萃取率基本保持不变。因此,反萃取剂硫酸浓度以2.5 mol/L为宜。
2.3.2 反萃取等温线
采用改变相比法绘制锰反萃取等温线,结果如图8所示。负载有机相通过串级萃取获得,Mn2+质量浓度11.5 g/L。反萃取剂为2.5 mol/L硫酸溶液,温度25 ℃。由McCabe-Thiele图解法可知,在相比VO/VA=10/1条件下,经过3级反萃取,Mn2+反萃取率达99%以上。

图8 Mn2+的反萃取等温线
2.4 模拟全流程串级萃取
有机相中Cyanex272浓度0.75 mol/L,模拟料液中Mn2+、Mg2+、Ca2+质量浓度分别为35.07、1.22、0.22 g/L,负载有机相洗涤剂为去离子水,反萃取剂为2.5 mol/L硫酸溶液。萃取段相比VO/VA=3/1,洗涤段相比VO/VA=5/1,反萃取段相比VO/VA=10/1。通过矩阵式模拟法启动串级萃取工艺全流程试验:共4级萃取,1级洗涤,3级反萃取。试验过程中两相分相效果良好,结果见表2。

表2 模拟串级萃取工艺全流程试验结果
由表2看出:经4级逆流串级萃取,萃余液中Mn2+质量浓度低于0.2 g/L,Mn2+萃取率在99.42% 以上,萃取效果明显优于单级萃取;反萃取液中,Mn2+可富集到110 g/L以上,Mn2+反萃取率可达99%。萃取、洗涤和反萃取过程中,有机相中无萃合物析出现象,全流程Mg2+、Ca2+去除率分别达99.52%和99.68%,反萃取液中杂质含量满足电池级硫酸锰生产要求。
3 结论
Cyanex272能够实现选择性萃取锰,实现锰与钙、镁的高效分离。当有机相中Cyanex272浓度为0.75 mol/L时,对锰的饱和萃取量可达14 g/L。 用去离子水可洗脱物理夹带于有机相中的钙、镁杂质。适宜浓度的硫酸溶液可高效反萃取锰,实现锰离子的高倍富集。
经4级逆流萃取、1级洗涤、3级反萃取,锰萃取率大于99.42%, 反萃取液中锰质量浓度达110 g/L 以上,全过程镁、钙去除率达99.52%和99.68%,反萃取液可满足电池级硫酸锰生产对钙、镁含量要求。

