不同砷污染程度下香蒲生长与砷富集特征
陈 天,包宁颖,杜崇宣,刘云根,2,*
(1.西南林业大学 生态与环境学院,云南 昆明 650224; 2.西南林业大学 水科学与工程中心,云南 昆明 650224)
湿地是全球三大生态系统之一,被称为“地球之肾”[1]。湿地生态系统处于水陆交替带,生物多样性丰富,具有涵养净化水源、调节气候等多重生态功能,在全球生态系统中具有海洋、森林两大生态系统不可代替的地位[2]。湿地具有为区域水环境安全阻截和净化污染物、稳定比邻生态系统的重要生态功能,因此,湿地同时也是稳定性相对脆弱的生态系统。湿地污染类型很多,其中富营养化和重金属污染是最严重的2个污染类型[3-4]。研究发现,目前大量湿地存在不同程度的重金属污染情况:阳宗海湿地底泥中砷(As)含量超标,对周边农业生态造成严重威胁;衡水湖湿地底泥中极高的汞含量已经成为生态系统潜在危害的主要风险;扎龙湿地多种重金属浓度极高,并随食物链传递后通过生物放大作用对食物链最高营养等级的鸟类生存造成影响[5-7]。As是一种致癌的有毒类重金属元素,我国于2013年被世界卫生组织(WHO)列为全球As污染最严重的国家之一,其中西南地区有色金属矿产丰富,地表区域水安全受到As污染的风险更加严重。相较传统的As污染修复方法,湿地生态修复具有净化能力强、抗逆性高和运行成本低等优势[8-10]。植物是湿地的核心组成部分,在外源污染吸收、底泥环境优化、微生物群落构建等方面有不可取代的作用[11]。在As胁迫作用下植物会启动抗逆机制对机体产生保护,产生代谢物与As缔合以解毒而加快生化代谢,同时激活的代谢系统也加速了重金属的进入,反过来抑制植物的代谢活动[12]。
香蒲是一种多年生抗逆性强的大型挺水植物,生物量大、覆盖率高,具有发达的大型根系组织,能耐高浓度的Cd、Pb、Zn等重金属污染,同时对生活和工业废水中磷、氮、有机物等污染物质也有很强的吸附富集能力,被北美国家广泛引种用作湿地生态修复建群种[13-15]。目前,针对以香蒲为建群种专项修复As污染湿地,探究香蒲应用于生物修复As污染湿地潜力的研究较少。本研究以香蒲为材料,采取室内模拟的方式,分析不同物候期香蒲在不同程度As污染下的生物量、光合系统和抗氧化酶系统等指标,以及各组织中的As积累特征,研究香蒲生态修复As污染湿地的潜力。
1 材料与方法
1.1 材料
香蒲植株购自昆明市花卉市场,为当年生香蒲萌发苗。植物幼苗时选择生物量与株高基本一致、生长状态相近的香蒲。模拟湿地生境底泥的土壤采集于昆明市呼马山(24°52′N,102°49′E,海拔1 930.05 m)。将土壤采回自然阴干后磨细,过60目筛。分析方法依据《土壤农业化学分析方法》;土壤总磷测定使用《土壤总磷的测定-钼锑抗分光光度法》(HJ 632—2011);测定时土壤总As用HCl-HNO3-HClO4消解,采用AFS-810双道原子荧光光度计(北京吉天仪器有限公司)测定。试验前土壤理化性质:pH 5.73,溶解氧6.49 mg·L-1,氧化还原电位169.22 mV,电导率36.67 μS·cm-1,总As 8.35 mg·kg-1,总磷181.79 mg·kg-1。
1.2 方法
试验在西南林业大学水科学与工程中心进行,采取室内培养的方式。通过添加Na2HAsO4·7H2O的方式模拟湿地野外As污染湿地环境。依据课题组前期成果[16],试验设置0 mg·kg-1(记为As0)、50 mg·kg-1(记为As50)、150 mg·kg-1(记为As150)、600 mg·kg-1(记为As600) 4 种底泥As梯度,操作如下。
使用黑色聚乙烯塑胶桶作为湿地模拟装置,每桶装入15 kg干土和10 L的水,称取Na2HAsO4·7H2O制成水溶液加入处理好的土壤,充分搅拌后黑暗放置9周进入老化阶段。每个实验处理用湿地模拟装置桶重复3次,按采样节点设置3批,每个装置同等间距移栽6株香蒲幼苗,每个实验梯度共种植54株。土壤老化结束后在装置桶内壁做水位高度标记线进行补水,试验期间保障水肥条件一致,保持试验装置处于相同淹水状态。
香蒲幼苗于2018年4月10日移栽,于2018年10月18日结束培养。根据当地香蒲生育期和日常观察管理将培养期划分为生长期、成熟期和萎黄期,分别于6月18日(生长期)、8月18日(成熟期)和10月18日(萎黄期)收获植物和底泥用于检测,每次采样各处理分别采3桶,收获18株植物。
1.3 样品采集与测定
叶绿素快速荧光参数测定:植物采样前3 d选取天气温度适宜、阳光晴好的一天,10:00测量香蒲叶片快速叶绿素荧光参数。每种处理选取生长状况一致的3株香蒲,用叶夹处理,将香蒲内生第3片叶暗适应30 min后,使用美国Opti-Science公司生产的OS5p+便携式脉调制脉冲叶绿素荧光仪测定。
植物与底泥的收获与处理:将底泥与香蒲小心分离,取出包括根在内的1株完整株香蒲,用水冲洗表面,再用去离子水将香蒲洗净后用滤纸擦干,测定香蒲株高、鲜生物量等指标.取出植物后用铲刀将底泥从装置桶内挖出,混合根际土和非根际土放于牛皮纸上阴干。将香蒲地上部与地下部分离,105 ℃杀青30 min,70 ℃烘干至质量恒定后将所有样品烘干粉碎,土壤阴干后研磨过60目筛。植物部分采用HNO3-HClO4混酸消解法测定总As,各态As采用Wenzel等[17]报道的连续提取方法,样品处理后使用AFS-810双道原子荧光光度计进行测定。
酶液制备:2018年6月18日上午采集香蒲叶片,每株均取新梢中部的成熟叶片,将叶片编号并置于4 ℃冷藏保存。每处理取0.1 g鲜叶片于预冷的研钵中,加入0.05 mol·L-1冷磷酸缓冲液(pH=7.8) 5 mL和少量石英砂,冰浴研磨,至匀浆后用0.05 mol·L-1冷磷酸缓冲液(pH值7.8) 5 mL冲洗,并转运至离心管,14 000×g4 ℃离心15 min,上清液即为酶提取液,将酶液转运至试管,4 ℃冷藏保存,作为备用[18]。
酶粗提取液制备完成后采用北京索莱宝科技有限公司生产的试剂盒处理,试剂盒型号分别为BC0175超氧化物歧化酶(SOD)活性检测试剂盒、BC0025 丙二醛(MDA)含量检测试剂盒和BC1175谷胱甘肽(GSH)含量检测试剂盒,使用赛默飞世尔(上海)仪器有限公司生产的Multiskan FC型酶标仪检测。
1.3.1 耐性指数
香蒲根系对重金属的耐性指数(IT,%)表示香蒲根系在As污染生境中的耐受状况。
VIT=Li/Lt×100%。
(1)
式(1)中:VIT表示IT的值;Li为各处理组地下部的平均长度,单位为cm;Lt为对照组地下部的平均长度,单位为cm。.
1.3.2 生物富集系数与转运系数
生物富集系数(BCF)与转运系数(TF)可以体现香蒲对As的富集特征。
VBCF=cs×cr/cT;
(2)
VTF=cs/cr。
(3)
式(2)、(3)中:VBCF和VTF分别表示BCF和TF的值;cs为香蒲地上部As含量,cT为试验土壤样品总As含量,cr为香蒲地下部As含量,单位均为mg·kg-1。
1.3.3 去除率与固定率
利用香蒲对As的去除率(ER,%)和固定率(RR,%)表示香蒲对土壤中As的去除与稳定效果。
VER=SΔAs/SAs×100;
(4)
VRR=SΔAs/SAs-i×100。
(5)
式(4)、(5)中:VER和VRR分别为ER和RR的值;SΔAs为试验土壤中As总量的降低量,SAs为试验土壤中As的实测含量,SAs-i为试验土壤中残渣态As的增加量,单位均为mg。
1.3.4 提取量
用香蒲对土壤中As的提取量(EA,μg)表征香蒲对土壤As的提取效果。
VEA=ms×cs。
(6)
式中:VEA为EA的值;ms为地上部生物量总干重,单位为g;cs为香蒲地上部As含量,单位为mg·kg-1。
1.3.5 单位面积迁移量
单位面积香蒲迁移As的总量(MPUA)表征香蒲对As的吸收效能。
m=s×md×Q;
(7)
MPUA=m×c/s。
(8)
式(7)(8)中:m为处理区植物总质量,单位为kg;s为处理区实际面积,单位为hm2;md为处理区种植的平均单株植物干重,单位为kg;Q为香蒲最佳种植密度,单位为株·hm-2(按照香蒲栽培技术处理,最佳行间距均设置为50 cm[16],计算得到的香蒲最佳种植密度为40 400株·hm-2左右);MPUA为单位面积迁移总量,单位为g·hm-2;c为植物体内As含量,单位为mg·kg-1。
1.4 数据处理
实验数据使用Excel 2018和SPSS 19.0处理,用Origin 2018绘图。
2 结果与分析
2.1 不同As污染程度中香蒲的生长特征
不同As污染程度中香蒲的生长特征如表1所示。生长期、成熟期和萎黄期,不同处理的香蒲生物量干重分别为12.35~19.12 g、50.23~72.23 g和52.14~79.23 g。不同物候期的香蒲生物量干重均随底泥中As含量的增加呈现先上升后下降的趋势,含50~150 mg·kg-1As的底泥对香蒲生物量积累的促进作用显著,而底泥中As为600 mg·kg-1时会抑制香蒲生物量干重的积累,3个物候期中As600处理香蒲生物量干重较As0处理减少了13%左右。根据香蒲的根长可以计算出不同物候期香蒲对As的根系耐性指数。结果表明,香蒲根系对As的耐性与生物量累积特征表现一致,成熟期的香蒲根系耐性指数较大。

表1 不同As污染程度中香蒲的生长特征Table 1 Growth characteristics of Typha angustifolia in different arsenic pollution levels
除基本的植物生长指标外,香蒲在形态学上对不同程度As胁迫也有不同的生理响应。当底泥中的As达到600 mg·kg-1时,生长期的香蒲地上部叶尖较其他2个处理颜色黄,地上部株高较矮,同时地下部根系主根粗壮,侧根断损较多;成熟期,As600处理的香蒲较As0、As50和As150处理结出种子柱头的时间提前了13~18 d;香蒲生长到萎黄期时,4种处理的香蒲外观形态上差异变小,都表现出植株停止生长或生长缓慢,地上部叶子枯萎变黄、种子柱头干枯,地下部根系侧根减少、断损,主根萎缩,含水量减少。
2.2 不同As污染程度下香蒲的生理特征
图1为不同As污染程度中香蒲的生理特征。香蒲处于生长期时,随着底泥中As胁迫程度的增加,叶片PSⅡ光合反应系统最大光化学潜力(Fv/Fm)和GSH活性逐渐下降,在As600处理中达最小值。成熟期的香蒲对As胁迫适应能力逐渐增加,Fv/Fm和GSH活性在As150处理下最高,并显著高于As0处理,但底泥中As达到600 mg·kg-1时,Fv/Fm显著低于As0处理。萎黄期,与As0处理相比,As150处理的香蒲叶片Fv/Fm最大,GSH活性随底泥中As含量增加而不断下降,As600处理显著抑制了GSH活性。
在香蒲的整个生命周期里,随着As胁迫程度的增加,香蒲叶片中超氧化物歧化酶(SOD)活性和丙二醛(MDA)含量逐渐升高。As胁迫处理中,生长期香蒲叶片SOD活性显著大于成熟期和萎黄期,成熟期叶片GSH活性较高,叶片中MDA的累积量随着生育进程推进逐渐增加。

数据以鲜质量计。柱上无相同小写字母表示差异显著(P<0.05)。下同。Data was detected based on fresh weight. Data on the bars marked without the same lowercase letter indicated significant differences at P<0.05. The same as below.图1 不同As污染程度下香蒲的生理特征Fig.1 Physiological characteristics of Typha angustifolia in different arsenic pollution levels
2.3 不同As污染程度下香蒲的As累积特征
由图2可以看出,香蒲地上部和地下部对As的富集都有显著的剂量依赖效应,香蒲对As的富集浓度与底泥As添加量之间的相关性达到0.995,在Pearson相关性双侧检验中达到0.01水平。整体来看,香蒲地下部的As富集浓度一直显著高于地上部,且随生育期的推进,香蒲对As的富集有增加趋势。从生长期到萎黄期,底泥中As为0 mg·kg-1时,香蒲地上部的As含量为14.98~43.64 mg·kg-1,地下部的As含量为31.16~39.60 mg·kg-1时;底泥中As为50 mg·kg-1时,香蒲地上部的As含量为10.99~54.11 mg·kg-1,地下部的As含量为51.49~130.82 mg·kg-1;底泥中As为150 mg·kg-1时,香蒲地上部的As含量为26.02~68.27 mg·kg-1,地下部的As含量为290.85~393.94 mg·kg-1;底泥中As为600 mg·kg-1时,香蒲地上部的As含量为77.87~165.42 mg·kg-1,地下部的As含量为849.95~931.58 mg·kg-1。
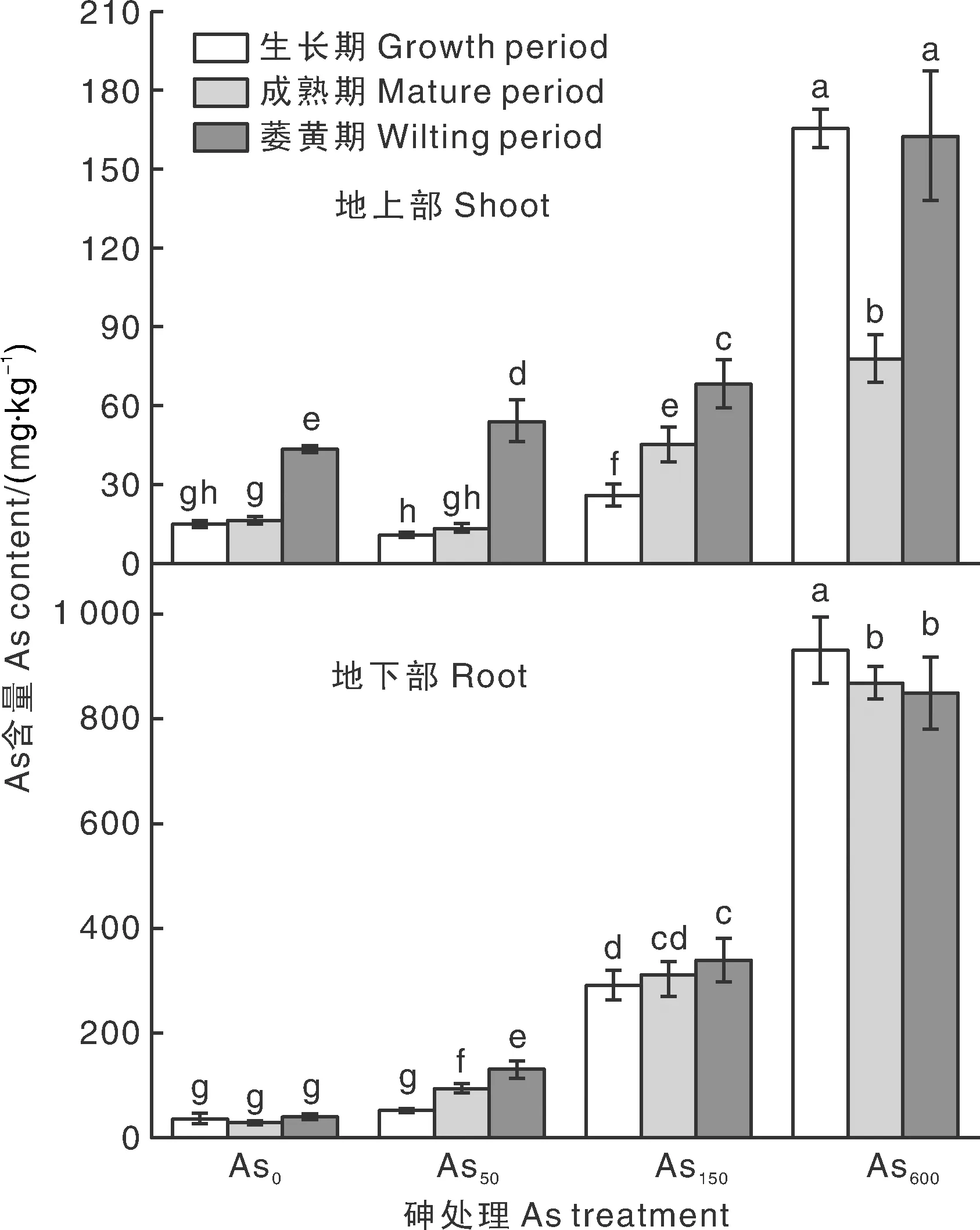
图2 不同As胁迫程度下香蒲中的As含量Fig.2 Arsenic concentration of Typha angustifolia under different arsenic stress levels
由表2可得,不同物候期的香蒲对As的富集特征差异较大,整体来看香蒲地下部对As的生物富集系数(BCF)大于地上部,植株间转运系数(TF)为0.09~1.10。随着底泥中As含量的增加,香蒲对As的生物富集系数和植株间转运系数呈不断增大的趋势,萎黄期的香蒲对As的植株间转运系数最大。

表2 不同As胁迫程度下香蒲As的富集特征Table 2 Enrichment characteristics of arsenic in Typha angustifolia under different arsenic stress levels
2.4 不同As污染程度下香蒲对As的迁移特征
由表3可知,随香蒲培养时间的延长,底泥和水体中As含量不断降低,底泥中整体减少速率大于水体,香蒲各生育期,底泥中As含量整体减少速率为生长期-成熟期>移栽-生长期>成熟期-萎黄期。随着香蒲生育期的推进,底泥中各形态As含量也在不断变化,总体趋势为F1+F2的As含量不断降低,而F5的As含量不断增加。
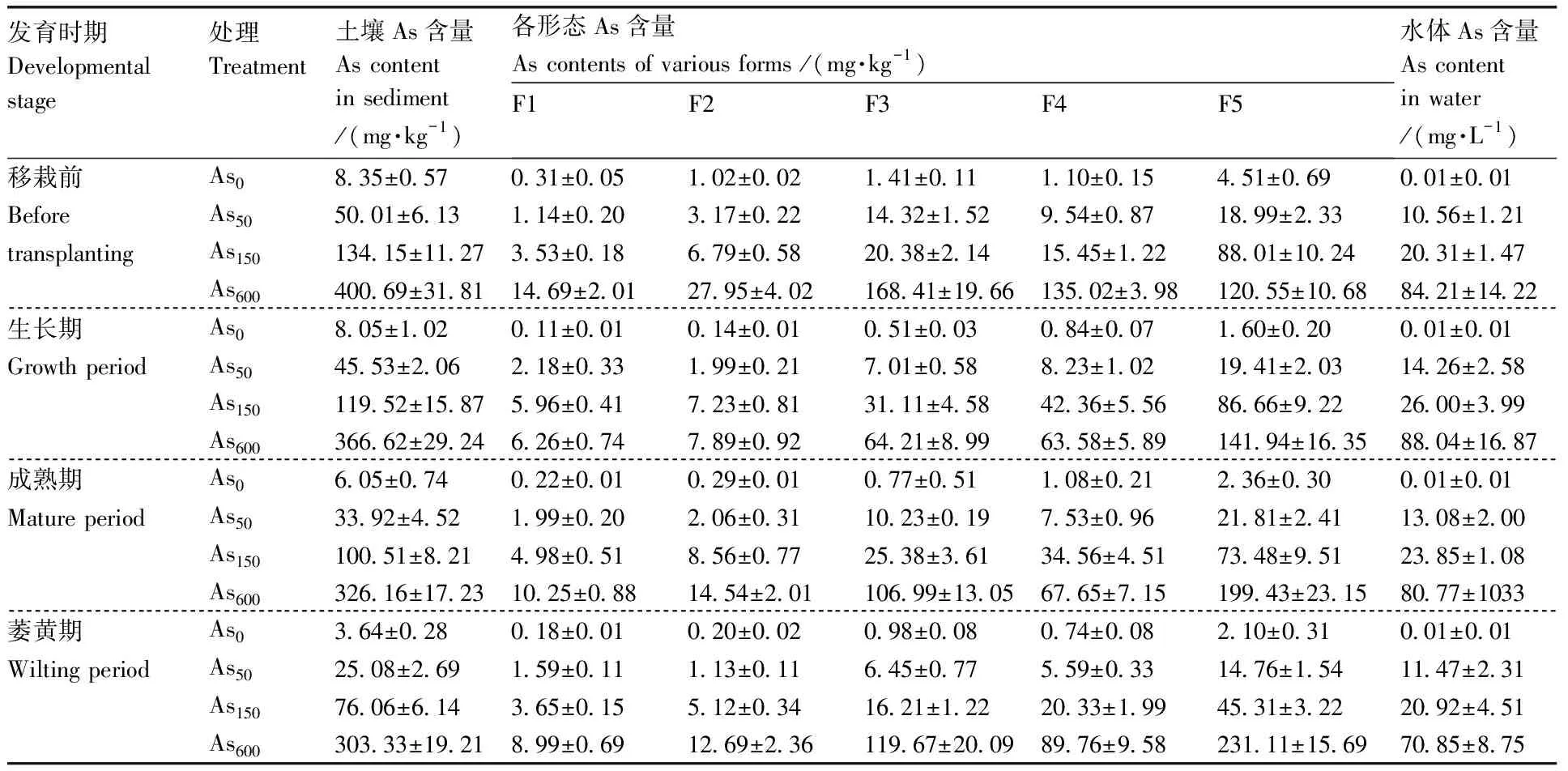
表3 湿地环境中As的含量Table 3 Arsenic concentrations in tested soil and water samples
如表4所示,香蒲对底泥中As的固定率整体大于去除率。在不同生育期,香蒲对底泥中As的去除率随着底泥As含量增加有一定的上升,在As600处理中会下降,但依然高于As0处理。横向比较整个香蒲生育期,成熟期的香蒲对底泥中As的去除效果最好,生长期对底泥中As的固定效果较好,且底泥中As含量越高,香蒲对As的固定效果越差。

表4 不同As污染程度下香蒲对As的迁移特征Table 4 Arsenic migration characteristics of Typha angustifolia under different arsenic pollution levels
香蒲对底泥中As的提取量与底泥中As含量也存在显著的相关性,相关性指数为0.996**(在Pearson相关性双侧检验中达到0.01水平显著正相关),并且随培养时间的延长,香蒲对底泥中As的提取量不断增加,萎黄期各个处理的香蒲对As提取量均达到最高,但生长期-成熟期对As的提取量增长速率显著大于成熟期-萎黄期。香蒲单位面积As迁移总量(MPUA)不仅与香蒲的As富集浓度相关,还与不同处理的香蒲生物量有关。结合香蒲的生物量计算,香蒲单位种植面积As迁移总量的变化规律与香蒲对底泥中As的提取量一致,在萎黄期各处理的香蒲单位面积As迁移总量达到最高,但生长期-成熟期的单位面积As迁移总量增长速率显著大于成熟期-萎黄期。
3 结论与讨论
非生物胁迫会对植物的生物量造成严重影响,所以生物量可以作为衡量植物在胁迫环境下适应能力的重要指标,香蒲成熟期之后生物量的积累效率较前一生长阶段大大降低,这是由于萎黄期香蒲各项生理生化代谢能力均大幅降低。一般来讲,生境中的As含量决定了它对植物产生的毒害程度。试验中发现,底泥中As含量低于150 mg·kg-1时,对香蒲的生物量累积起到正向促进的作用,这种少量As促进植物生长的现象在很多植物中均存在,但As对其他植物的正向促进含量阈值远远小于香蒲[19]。当生境中的As为150~600 mg·kg-1时,As对香蒲生长的促进作用转变为抑制作用,As对香蒲显示出严重的毒害作用。植物根系是植物最先接触到生境中胁迫物质的器官,非耐受植物受到胁迫时根长会显著降低,植物根系耐性指数下降[20]。萎黄期高浓度As胁迫(150 ~600 mg·kg-1)下香蒲耐性指数较其他处理有所降低,但下降速率低于生长期和成熟期,说明随着培养时间的延长香蒲对As毒害的适应力也在增强,同时也有生境底泥As浓度不断降低的原因。As600处理的香蒲较其他处理提前2周左右结出种子柱头,说明严重As胁迫下香蒲采取提前开花结果的策略应对逆境[21]。本试验中,在香蒲不同生育期,As600处理的香蒲叶片Fv/Fm低于其他处理,这是由于As的摄入会引起植物体内矿质元素和水分运输的通道阻塞,影响正常运输,从而导致植物叶片中光合色素的分解,进一步使植物光合作用降低所致[22]。
As毒害会造成植物体内活性氧自由基的过量累积和生物膜脂发生过氧化反应,从而损伤细胞的膜结构并造成细胞生理生化代谢紊乱。香蒲在As胁迫下细胞内的细胞器和脂膜NADPH氧化都会产生活性氧,而且脂膜NADPH氧化程度越高,会生成越多的MDA[23]。底泥中As含量的增加刺激了香蒲叶片中SOD活性的升高,SOD是细胞活性氧清除过程中非常重要的一种抗氧化酶。研究表明,在阈值内,逆境胁迫时植物SOD活性会增强以提高植物的适应力,所以As胁迫的加剧刺激了香蒲叶片SOD活性的上升,一方面是因为香蒲在As胁迫下开启了应对超氧化物伤害的应急防御机制,另一方面体现了底泥As含量增加对香蒲产生了胁迫,随着As含量增加,胁迫程度加剧[24]。GSH是植物体内普遍存在的一种还原性物质,是重要的抗氧化剂,同时也是植物重金属络合物前体物质;因此,GSH活性是重金属胁迫下观测植物生理应答的重要指标[25]。底泥中As含量为0~150 mg·kg-1时,对香蒲叶片中GSH活性无显著影响,说明在此浓度下,GSH对As的作用不敏感;底泥中As含量为600 mg·kg-1时,GSH活性较其他处理显著降低,但SOD保持较高活性,说明此时香蒲抗氧化酶系统以SOD为主。随香蒲生育期的推进,香蒲叶片中SOD和GSH活性整体降低,这是由于处于生长期的植物代谢速率较快,同时光合速率与光合产物的积累较高,植物到达萎黄期时生长停滞,物质运输通道老化和生理生化反应减弱导致[26]。对不同处理下香蒲整个生育期中MDA累积量进行分析,不难发现,底泥中As含量增加与MDA累积量之间存在正反馈,由于MDA本身是脂膜NADPH氧化的产物,植物无法依靠自身代谢将其清除,所以随着培养时间的延长,MDA累积量不断上升,且萎黄期的上升速率最高。
香蒲地下部As富集显示出强烈的剂量依赖特性,而香蒲在底泥As处理从As0过渡到As150时,香蒲地上部As富集量并没有很显著的剂量依赖效应,说明香蒲地上部对As的富集受底泥中As含量和植物间转运系数等因素的影响[27],也说明在这个处理区间香蒲富集的As主要储存于地下部,这与试验中香蒲植株对As的转运能力结果一致,随着培养时间的延长,储存于香蒲地下部的As开始更多地向地上部转运,植株间转运能力增大。目前已经有多种植物用于As污染土壤的生态修复,一般选育As超富集植物可以依据3种标准:(1) 根据植物As富集能力计算,植物地下部或地上部As富集浓度达到1 000 mg·kg-1以上;(2) 根据生物富集系数标准判断,即富集系数大于1.0,某些超富集植物对特种重金属元素的生物富集系数可以达到50~100;(3) 依据植株间转运系数划分,转运系数超过1,即植物地上部重金属积累量大于地下部,植物将体内富集的重金属更多的储存于地上部[28]。试验中香蒲地下部As富集浓度整体大于地上部,转运系数小于1;但在不同底泥As处理下,香蒲地下部和地上部对As的生物富集系数均显示出一定程度的超富集特性,从富集浓度判断,香蒲地下部还达不到As富集植物的标准,但可以被选育作为具有超富集潜力的耐As植物。
整个培养期间,香蒲对底泥中As的固定率整体大于去除率。香蒲对底泥中As的去除通过自身对As的吸收来实现。香蒲生长于被As污染的底泥之中,为保护自身免受As的毒害,香蒲根尖产生可以与As结合的黏液阻止As进入体内,而这些黏液主要成分是糖类物质,主要官能团为羰基和羟基,As在湿地底泥中多以还原态(3价砷)存在,可以与醛糖类物质结合,减少香蒲根系吸收水分和矿物质的同时增加对As的吸收[29]。加之香蒲具有发达的根系,根系周围存在大量微生物,和活性很高的土壤酶一起构成香蒲活跃的根系环境,香蒲根系分泌大量分泌物,影响了As的赋存形态,使底泥中的As处于相对稳定的状态[30],因此,出现香蒲对底泥中As的固定率整体大于去除率的现象。各处理中香蒲体内无论是地上部还是地下部的As含量均一直增加,同时香蒲生物量也在不断增加,所以香蒲体内累积的As总量一直在上升。由于植物几乎无法通过代谢将As排出体外,因此随培养时间的延长,香蒲对底泥As的提取量和As单位面积迁移量不断增加,导致生境中余下的As含量不断降低。成熟期到萎黄期的香蒲对As的提取量和As单位面积迁移量增长速率远小于生长期到成熟期,底泥中As含量减少速率也随时间降低。
随着培养时间的延长,香蒲根部富集的As更多地向地上部转移,香蒲从生长期到成熟期的As修复能力很强,且香蒲是一种多年生大型挺水植物,抗逆、分生能力很强,所以在实际生态修复建设中,增加成熟期香蒲的采集频率是提高生物修复效果的有效手段之一[31]。香蒲能耐较高浓度的As胁迫,可以在As含量为150 mg·kg-1的湿地底泥中生长良好,也能耐受600 mg·kg-1的湿地底泥As胁迫,并在极端As胁迫作用下完成生命周期,适宜在面临严重As污染风险的湿地作为植物群落的建群种和先锋植物。

