鲜切处理对猕猴桃中γ-氨基丁酸富集的影响
侯 莹,祁雪鹤,任 慧,洪诗雨,池宗豫,王鸿飞,许 凤
(宁波大学食品与药学学院,浙江宁波 315211)
γ-氨基丁酸(γ-aminobutyric acid,GABA)作为一种四碳非蛋白氨基酸,以游离态的形式广泛地存在于脊椎动物、植物和微生物中[1]。GABA在动物中作为一种抑制性神经递质,具有降血压,防止动脉硬化等多种生理功效[2]。在正常生长的植物组织中,GABA的含量通常在0.3~32.5 μmol·g-1[3]。当在缺氧、鲜切处理、盐胁迫等逆境条件下,植物中的GABA含量会迅速积累[4-5]。前期研究发现,不同切割强度对鲜切胡萝卜中GABA的影响差异较大,且外源CaCl2处理能有效地诱导鲜切胡萝卜GABA的富集[6]。高等植物中GABA主要是由L-谷氨酸在谷氨酸脱羧酶(Glutamate decarboxylase,GAD)的作用下发生不可逆的脱羧反应而形成,随后GABA又在氨基丁酸转氨酶(GABA transaminase,GABA-T)的作用下,生成琥珀酸半醛(Succinic semialdehyde,SSA),SSA在琥珀酸半醛脱氢酶(Succinic semialdehyde decarboxylase,SSADH)的作用下,形成琥珀酸,最后进入三羧酸循环(Tricarboxylic acid cycle,TCA),这一代谢反应被称为GABA支路[7-8]。此外,有研究表明高等植物中的GABA也可以由多胺(polyamine,PAs)降解产物转化产生[9]。多胺降解途径是以腐胺(putrescine,Put)、精胺(spermine,Spm)、亚精胺(spermidine,Spd)在二胺氧化酶(Diamine oxidase,DAO)和多胺氧化酶(Polyamine oxidase,PAO)的催化下生成4-氨基丁醛,然后再经氨基醛脱氢酶(Aminoaldehyde decarboxylase,AMADH)的作用下生成GABA。
鲜切果蔬又名最小加工果蔬,微加工果蔬,轻度加工果蔬,即新鲜果蔬进行分级整理、清洗、切分、保鲜、包装等处理,并使产品保持生鲜状态的制品。因其具有新鲜、方便、卫生和快捷等优点受到消费者的青睐,逐渐成为城市果蔬消费的主流[10]。猕猴桃(Actinidiachinensis)含有丰富的营养物质,并且口感酸甜美味,易于去皮以及切分,适用于鲜切加工[11]。目前,大多数研究主要集中在如何控制猕猴桃产品品质和病原微生物的生长来延长其货架期,有关于鲜切猕猴桃GABA的代谢研究却鲜有报道。
本论文选取猕猴桃为研究材料,研究鲜切处理对其GABA的影响,明确在鲜切处理下猕猴桃中GABA富集机理,对改善产品的营养和功能品质具有重要的理论和实践应用价值。
1 材料与方法
1.1 材料与仪器
徐香猕猴桃 购自安徽省宿州市大土山果园,挑选完全成熟,大小均一,表面无机械损伤及病虫害的猕猴桃作为实验材料;GABA标准品 Sigma-Aldrich公司;氯化镧 分析级,上海阿拉丁生化科技股份有限公司;苯酚 分析级,国药集团化学试剂有限公司;甲醇 色谱纯,Sigma-Aldrich公司;腐胺、精胺 亚精胺标准品 分析纯(T≥98%),上海源叶生物科技有限公司;其他试剂 均为国药分析纯。
PAL-1型数显测糖仪 辽宁赛亚斯科技有限公司;AFX-2001-U超纯水机 上海纯浦实业有限公司;SYNAPT G2超高效液相色谱仪 美国water公司;745型紫外分光光度计 上海美谱达科技有限公司;BPZ11D分析天平 德国赛多利斯公司。
1.2 实验方法
1.2.1 原料处理 将果实新鲜、大小均匀、无鲜切处理、成熟度几乎一致的猕猴桃用200 μL/L次氯酸钠溶液浸泡消毒2 min,纯水清洗后平铺于实验操作台上沥干表明水分。对猕猴桃进行不同方式的鲜切处理,切片(半径4~6 cm,厚度2~3 mm),切丁(以切好的原片为基础,切成2.5 cm×2.5 cm×2.5 cm的猕猴桃丁),将切好的猕猴桃置于鲜切盒(材质:塑料;尺寸:15 cm×10 cm×4 cm),每个鲜切组12盒样品,每盒约100 g左右。未进行切割处理的完整猕猴桃作为对照,对照组共有12颗猕猴桃。于4 ℃,相对湿度90%条件下贮藏,分别于0、3、6、9 h取样,贮藏期间鲜切组随机取3盒样品取样,对照组随机取三颗猕猴桃为样品,并于液氮中快速冷冻,置于-40 ℃冰箱中待用,同时取鲜样用于品质指标的测定。
1.2.2 GABA含量的测定 GABA含量的测定参照Hu[12]等的方法并做一定修改。取0.5 g的冷冻样品在3 mL的浓度为 0.05 mol/L的氯化镧溶液中进行提取,在室温下摇晃15 min后用12000 r/min离心5 min。取2 mL上清液加入2 mol/L氢氧化钾(200 μL),振荡5 min后用12000 r/min离心5 min。取0.4 mL上清液依次加入800 μL硼酸盐缓冲液(pH9.0)、体积分数6%苯酚和5%次氯酸钠,充分混匀后沸水浴10 min,并立即冰浴5 min。然后加入体积分数为60%的乙醇,混匀后采用紫外分光光度在645 nm测定吸光度。结果以mg/g FW来表示。
1.2.3 谷氨酸含量的测定 谷氨酸含量测定的方法参照参考Al-Quraan等[13]的方法并加以修改。取0.5 g的样品在0.05 mol/L的氯化镧溶液中进行冰浴研磨,将0.02 mL的冷冻样品提取物加入0.2 mL的反应溶液中。反应溶液含有0.2 mL Tris-HCl(0.1 mol/L,pH8.3)、0.1 mLβ-NAD+(7.5 mmol/L)和1 U/mL谷氨酸脱氢酶悬液。在30 ℃孵育60 min后,记录340 nm处吸光度的变化。谷氨酸水平以NADH标准曲线为基础,每生成1 mmol NADH则消耗1 mmol谷氨酸,结果用mmol/kg FW来表示。
1.2.4 GAD活性的测定 GAD活性的测定参照Liao等[14]的方法并加以修改:将0.5 g冷冻样品在3 mL含5 mmol/Lβ-巯基乙醇、0.5 mmol/L磷酸吡哆醛、2 mmol/L EDTA和100 g/L甘油的100 mmol/L 磷酸钾缓冲液(pH5.8)中匀浆。提取的匀浆在10000 r/min、4 ℃下离心20 min,上清液即为粗酶液。将0.5 mL 酶提液加入含10 g/L 谷氨酸的0.2 mL磷酸钾缓冲液(100 mmol/L,pH5.8)中,40 ℃水浴2 h,在水浴中煮沸终止反应。每小时反应溶液中1 μmol/L GABA的生成为GAD活性的一个单位。
1.2.5 GABA-T活性的测定 GABA-T活性的测定参照Wang等[6]的方法并加以修改:取0.5 g冰冻组织样品在3 mL含有10%甘油、1 mmol/L二硫苏糖醇(DTT)、5 mmol/L EDTA、0.5 mmol/L磷酸吡哆醛(PLP)、1 mmol/L苯甲磺酰氟(PMSF)的100 mmol/L Tris-HCl(pH9.1)中均质,在12000 r/min下,4 ℃离心20 min,得粗酶液。反应体系由50 mmol/L三氯化氢(pH8.2),0.75 mmol/L EDTA,1.5 mmol/L DTT,0.1 mmol/L PLP,16 mmol/L GABA。10%(v/v)甘油,4 mmol/L 丙酮酸和0.5 mmol/L 酶提取物组成。在30 ℃孵育60 min后,加入0.1 ml 100 mmol/L磺基水杨酸(SSA),使反应中止。GABA-T活性被定义为每小时催化生成1 μg丙氨酸为一个酶活单位。
1.2.6 多胺含量的测定 多胺的测定参照Zhu等[15]的方法并加以修改:取猕猴桃冷冻样品1.0 g加入3 mL提前预冷的高氯酸溶液(5%,v/v)进行冰浴研磨,将研磨后样品冰浴1 h,在4 ℃,15000 r/min下离心30 min。取2 mL上清液转移至5 mL离心管中,加入2 mol/L NaOH(2 mL),再加入10 μL苯甲酰氯,涡漩20 s后在37 ℃水浴30 min。再加入饱和NaCl溶液(4 mL),混匀后用乙醚(2 mL)进行充分地萃取,在3000 r/min条件下离心5 min,取1 mL醚相用氮吹仪吹干,用色谱级甲醇(500 μL)溶解,最后得到待测定的多胺样品。采用高效液相色谱进行多胺含量的测定。色谱柱为反相C18柱(150×3.9 mm,4 μm),柱温30 ℃;流动相为甲醇和水(比例为10∶40,v/v);检测波长230 nm;流速0.7 mL/min,进样量10 μL。
1.2.7 DAO、PAO和AMADH活性的测定 DAO和PAO的活性测定参照Gao等[16]的方法并加以修改:冷冻样品(2.0 g)在5.0 mL 100 mmol/L磷酸钾缓冲液(pH6.5)中均质,在12000 r/min、4 ℃下离心20 min,上清液即为粗酶液。反应体系中含有2.0 mL 100 mmol/L磷酸钾缓冲液(pH6.5),0.2 mL 4-氨基安替比林/N,N-二甲基苯胺显色溶液,0.1 mL辣根过氧化物酶(250 U/mL),0.5 mL酶提取液。分别加入0.5 mL Put溶液(20 mmol/L)和0.5 mL Spd+Spm混合溶液(各20 mmol/L)启动反应,进行DAO和PAO活性测定。在555 nm处吸光度值每变化0.001被定义为酶活的一个单位。
AMADH的方法测定基于Petrivalsky等人[17]的方法,并做了一些修改。将冷冻样本在含5 mmol/L DTT、1 mmol/L EDTA和10%蔗糖的100 mmol/L磷酸钾缓冲液(pH8.0)中匀浆。在4 ℃、12000 r/min离心30 min,上清液即为粗酶液。反应体系中含有100 mmol/L磷酸钾缓冲液(pH8.0),1 mmol/L NAD+和1 mmol/L ABAL,加入0.5 mL粗酶液启动反应。在340 nm测定吸光值,每分钟的吸光度变化0.001,被定义为该酶活性的一个单位。
1.2.8 菌落总数测定 菌落总数参照GB 4789.2-2016《食品安全国家标准食品微生物学检验菌落总数测定》测定。
1.2.9 可滴定酸的测定 可滴定酸的测定参照刘小阳等[18]的方法:取50 g鲜样研磨后离心,取3 mL上清液加5 mL蒸馏水,再滴加3~4滴酚酞溶液,用0.1% NaOH溶液进行滴定,至出现淡红色,记下NaOH溶液的用量。重复测定3次。
1.2.10 可溶性固形物含量测定 可溶性固形物的含量测定参照郭丹等[19]的方法:取一定量的新鲜样品研磨,匀浆过滤测定,采用PAL-1型数显测糖仪测定可溶性固形物含量,重复3次。
1.2.11 维生素C的测定 维生素C的测定参照何靖柳等[20]的方法:取5 g新鲜样品加入适宜的2%草酸研磨,离心后取1 mL上清液用已经标定好的1,2-二氯酚靛酚滴定,至出现粉红色且在15 s内不褪色为止,记下染料的用量。重复测定三次。
1.3 数据处理
采用Origin Pro 9.0和SPSS 21.0软件进行数据处理分析,用邓肯氏多重比较方法进行差异显著性检验,P<0.05为差异显著。以上指标均取3个平行样,重复测定3次。
2 结果与分析
2.1 不同损伤强度对猕猴桃中GABA含量的影响
由图1可知,经过鲜切处理的猕猴桃中GABA的含量高于未经处理的猕猴桃,与切片组相比,切丁组的GABA含量更高,且GABA含量在贮藏期间呈先上升后下降趋势,在贮藏时间为6 h时切丁组中的GABA含量达到了峰值。这可能是由于鲜切处理严重破坏了猕猴桃细胞膜结构,使细胞质中的钙离子和氢离子含量增加,激活了GABA代谢的相关酶活性,进而促进了GABA的积累[21]。同时初步确定在鲜切处理胁迫条件下猕猴桃中GABA富集的最佳鲜切形式为切丁,最佳贮藏时间为6 h,故取切丁组进行下一步实验。

图1 损伤强度对猕猴桃中GABA含量的影响
2.2 鲜切处理对谷氨酸含量、GAD活性以及GABA-T活性的影响
2.2.1 鲜切处理对谷氨酸含量的影响 由图2可知,对照组和切丁组的谷氨酸含量在总体上呈下降的趋势,可能在较低的贮藏温度下对猕猴桃存在着低温胁迫,提高了GAD活性,使猕猴桃中谷氨酸转化成GABA[5]。贮藏过程中,切丁组谷氨酸含量在前6 h显著低于对照组(P<0.05)。谷氨酸是GABA支路中合成GABA的前体,这可能是切丁处理激活GABA支路促使谷氨酸转化合成GABA[22]。

图2 鲜切处理对猕猴桃中谷氨酸含量的影响及NADH标准曲线
2.2.2 鲜切处理对GAD和GABA-T活性的影响 由图3A可知,对照组的GAD活性在前3 h并无显著性差异,在6 h迅速升高,可能是较低的贮藏温度下对猕猴桃存在着低温胁迫,激活了对照组中GAD活性[4]。切丁组中的GAD活性在贮藏期间并无显著性差异,且切丁组的GAD活性显著高于对照组(P<0.05)。结果表明,鲜切处理能提高猕猴桃中GAD活性,促进谷氨酸向GABA转化,使得GABA的积累,也进一步解释了切丁猕猴桃中谷氨酸含量降低的原因。对照组的GABA-T活性在贮藏期间无显著变化,而切丁组中的GABA-T活性呈现先增加再下降的趋势。与对照组相比,切丁组的GABA-T活性显著(P<0.05)低于对照组(图3B)。GAD是GABA支路的限速酶,两者对植物中GABA的积累起着至关重要的作用。Koike等[23]发现,用CO2处理番茄果实,其体内的GABA含量显著增加,这主要归因于CO2处理降低了GABA-T的活性,减缓了GABA的降解。本研究发现,切丁猕猴桃的GABA-T活性显著低于对照组(图3B),这表明鲜切处理后GABA含量的提高可能和较高的GAD活性和较低的GABA-T活性有关,这与Deewatthanawong等[24]的研究结果相一致。
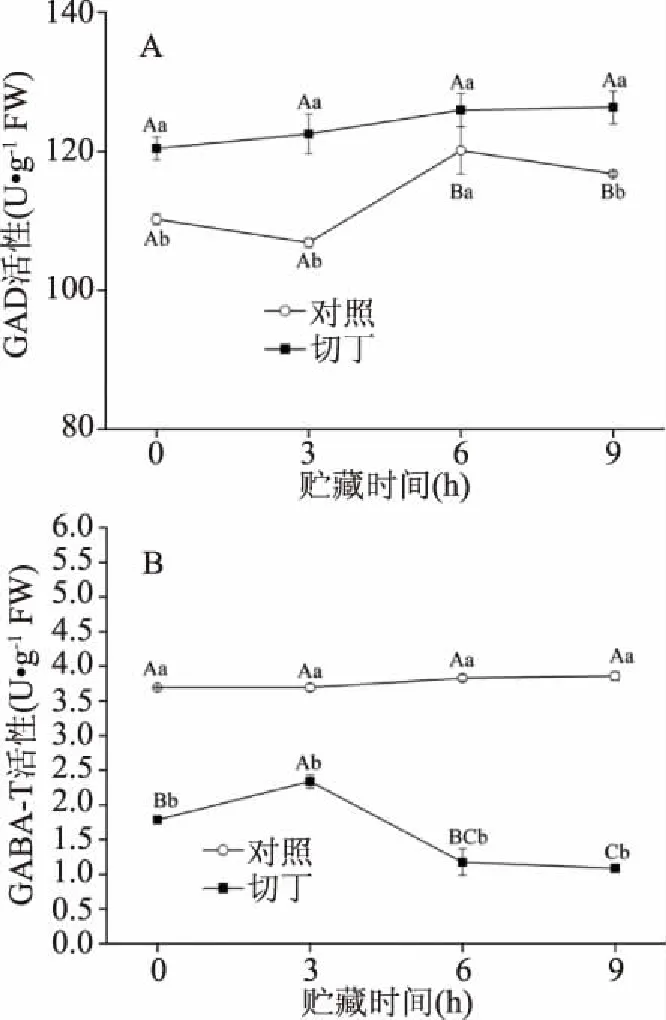
图3 鲜切处理对GAD和GABA-T活性的影响
2.3 鲜切处理对多胺含量的影响
鲜切处理对猕猴桃中多胺(腐胺、精胺、亚精胺)含量的影响见图4。切丁组中的腐胺含量在前6 h无显著变化,之后迅速减少;对照组在前6 h逐渐增加,然后开始下降,这可能是在贮藏前期,较低的DAO活性促进了腐胺的积累,在贮藏后期,随着DAO活性的提升,腐胺开始降解;与对照组相比,切丁处理显著的抑制了腐胺的产生(图4 A)。由图4B可知,对照组中的精胺含量在贮藏期间无显著变化,而切丁组的精胺含量呈下降趋势。对照组中的亚精胺含量呈先上升再下降的趋势,而切丁组的亚精胺含量随着贮藏时间逐步下降,并且显著低于对照组(图4C)。这些结果表明,经过鲜切处理显著降低了猕猴桃中腐胺、精胺和亚精胺的含量(P<0.05),从而激活猕猴桃中的多胺降解途径,促进GABA积累。

图4 鲜切处理对猕猴桃中多胺(腐胺、精胺、亚精胺)含量的影响
2.4 鲜切处理对胺氧化酶活性的影响
由图5A可知,对照组和切丁组的DAO活性均在前6 h逐步上升,在6 h时到达最大值,随后逐渐下降。与对照组相比,鲜切处理显著增加了DAO的活性。切丁组的PAO活性在前6 h迅速增加,并在6 h时达到最大值,之后缓慢下降。与对照组相比,切丁组的PAO活性显著增强(图5B)。由图5C可知,对照组猕猴桃中AMADH活性在贮藏期间缓慢增加,而切丁组中AMADH活性在前3 h显著增强,并在3 h达到最大值,之后逐渐下降。AMADH属于醛脱氢酶,它能够将植物中多胺经胺氧化酶(DAO和PAO)氧化产生的4-氨基丁醛直接进行脱氨反应生成GABA[15]。Wu等[25]研究发现,在厌氧胁迫下,福鼎白茶大约37%~47%的GABA产生于多胺降解途径。在本研究中,低温贮藏略微提升了对照组中DAO和PAO的活性,与对照组相比,切丁组的猕猴桃具有更高的DAO、PAO和AMADH活性(图5A、5B和5C)。这可能是切割处理激活了多胺氧化酶的活性,促进更多的多胺降解成GABA。然而,多胺代谢是由多种信号转导途径控制的一个非常复杂的过程,还需要进一步的研究[26]。
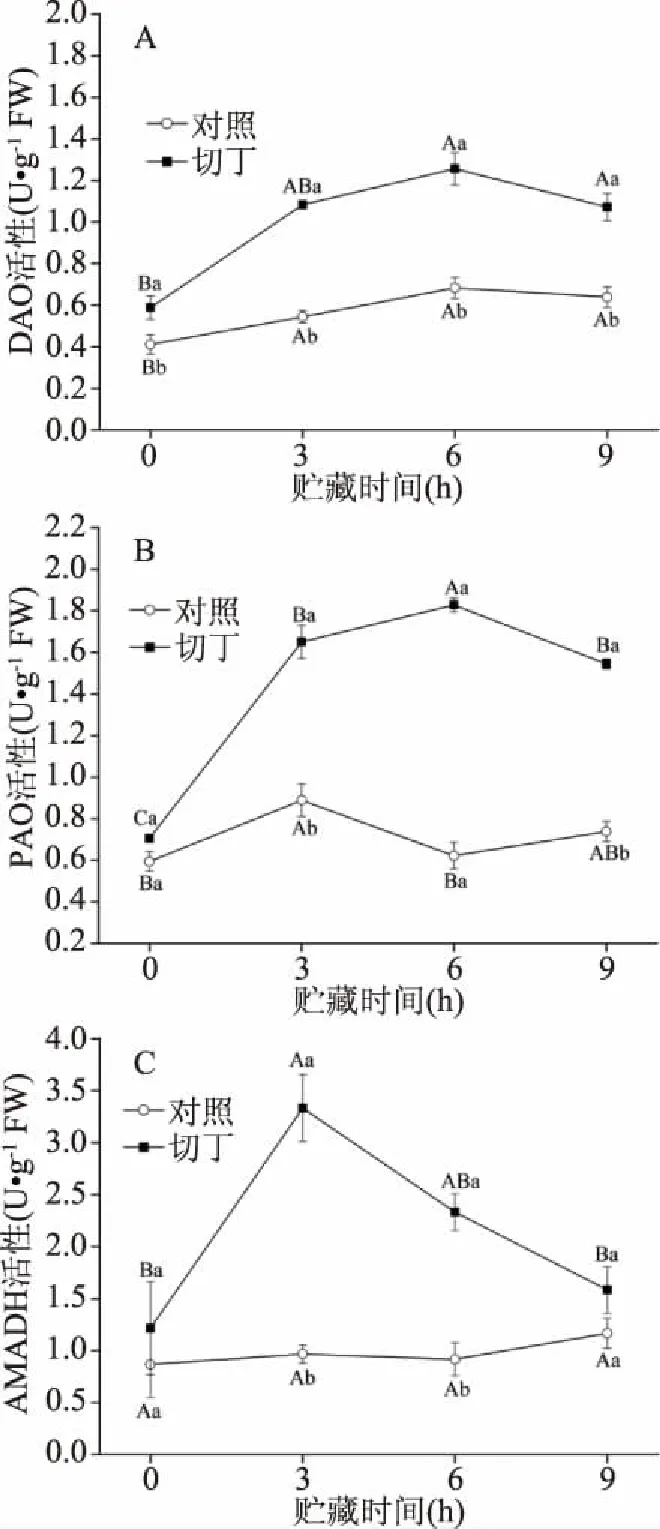
图5 鲜切处理对猕猴桃中胺氧化酶(二胺氧化酶、多胺氧化酶、4-胺基丁醛脱氢酶)活性的影响
2.5 鲜切处理对菌落总数、可滴定酸、维生素C、可溶性固形物含量的影响
菌落总数是用来评价鲜切果蔬安全性以及货架期的指标。据报道[27],鲜切果蔬的菌落总数通常不超过106CFU·g-1。图6A表明,鲜切猕猴桃菌落总数在4 ℃贮藏期间持续增长,但在贮藏时间分别为0、3、6、9 h时菌落总数未超过106CFU·g-1,仍然在可食用范围内。如图6B所示,在贮藏期间,切丁组的可滴定酸含量呈下降趋势,但与对照组相比没有显著性差异(P<0.05)。对照组和切丁组的可溶性固形物含量在贮藏期间都呈下降趋势,且在6 h后切丁组的可溶性固形物含量显著低于对照组(图6C)。猕猴桃以VC含量高而著称,有着“VC之王”的美誉,VC也是衡量猕猴桃果实贮藏品质的重要指标。由图6D可知,在贮藏期间,切丁组和对照组在较短的贮藏时间内(9 h)VC含量并无显著性差异。这些结果表明,在此切割处理(切丁)和贮藏条件下(4 ℃和9 h),较好地保持了鲜切猕猴桃的品质。

图6 鲜切处理对菌落总数、可滴定酸、维生素C、可溶性固形物含量的影响
3 结论
GABA是逆境条件下生物体缓解细胞酸化对自身毒害作用的产物[28]。大量证据表明,当植物受到缺氧胁迫、盐胁迫、低温胁迫和鲜切处理胁迫时,GABA会大量积累以缓解胁迫环境对植物造成的损伤[22,29]。在本研究中,低温贮藏略微提升了对照组猕猴桃的GAD、DAO和PAO活性,促进了对照组中谷氨酸的降解,同时鲜切处理可显著提高猕猴桃中GABA的积累,相对于对照组,切丁猕猴桃中GAD、DAO、PAO和AMADH活性提高显著,GABA-T活性被抑制。
果蔬经过鲜切处理后,结构和组织会遭到破坏,营养物质也会随之流失,变得容易腐烂。在本研究中,最大菌落总数、VC和可滴定酸含量在对照组和切丁组之间均无显著性差异,而切丁组的可溶性固形物含量略低于对照组,这可能与贮藏温度(低温)和短时间(9 h)有关。由此可知,鲜切处理诱导鲜切果蔬中GABA的富集可能具有普遍性,在确保产品感官品质和食用安全性基础上,应用鲜切加工诱导GABA的合成有望成为提高果蔬产品营养保健功效的重要手段,也是鲜切果蔬加工保鲜技术研究的发展方向。

