iTRAQ分析蜂胶乙醇提取物处理烟曲霉中差异蛋白的表达
徐晓兰,沈 菲,杨 博,李玉洁,吴珍红,缪晓青,杨文超,,*
(1.福建农林大学动物科学学院(蜂学学院),福建福州 350002;2.蜂产品加工与应用教育部工程中心,福建福州 350002;3.福建农林大学食品科学学院,福建福州 350002)
蜂胶是意大利工蜂采集胶源植物的芽孢或树脂,与上颚腺分泌物、蜂蜡等物质混合加工得到的具有特殊芳香性的胶状产物,具有解毒消肿、收敛生肌等功效[1]。蜂胶是一种比较复杂的化合物,可能含有的单体化合物有200多种,其中最主要的两大类成分为黄酮和酚酸[2]。现有研究表明蜂胶中的黄酮和酚酸类物质具有良好的抑菌活性。从阿根廷蜂胶中分离出来的木酚素、白杨素、松属素和高良姜素鉴定为当地蜂胶的主要抗真菌化合物[3];南非蜂胶中分离得到的咖啡酸苯乙酯(CAPE),与其他抗菌化合物如木犀草素、奎宁混合时,有更强的抗菌能力[4];泰国意蜂蜂胶中分离出的腰果酚,能抑制大肠杆菌的生长,并使其细胞受损和死亡[5]。此外,萜类物质也有很强的抑菌作用。例如,三萜烯是无刺蜂所采集的蜂胶的主要抗菌活性成分[6]。
烟曲霉广泛存在于自然界,能够感染免疫力低下人群而引起侵袭性曲霉病,致病性强,死亡率高[7]。目前治疗曲霉病的药物有卡泊芬净(caspofungin)、伊曲康唑(Itraconazole)和两性霉素B(Amphotericin B)等。前期研究发现蜂胶处理后的烟曲霉菌丝生长、呼吸作用和ATP的生成都受到抑制,但并未深入探讨其抑菌机制[8]。近年来,同位素标记相对和绝对定量技术(isobaric tags for relative and absolute quantitation,iTRAQ)采用同位素编码标签,通过特异性标记多肽氨基酸基团及MS/MS分析,比较不同样品中蛋白质水平,越来越多的被应用到药物抑制真菌机制的研究中[9-10]。Cagas等[9]用iTRAQ 技术比较了卡泊芬净对烟曲霉作用前后蛋白质表达的差异性,结果共鉴定到471个蛋白呈特异性表达,总计有122个蛋白的差异表达水平至少超过2倍,其中线粒体缺氧反应蛋白的差异表达水平达16倍以上。
本研究采用 iTRAQ技术筛选了烟曲霉在蜂胶处理前后的差异蛋白,并对差异蛋白(differentially expressed proteins,DEGs)功能进行基因注释及分析,以期从蛋白组学的水平上发现与蜂胶抑菌作用相关的靶标蛋白,为蜂胶抑制烟曲霉的分子机制研究提供数据并奠定理论基础。
1 材料与方法
1.1 材料与仪器
烟曲霉AS 3.3572 上海北诺生物科技有限公司;蜂胶 胶源植物杨树属,-20 ℃保存,福建省神蜂科技开发有限公司;蛋白浓度测定试剂盒、上样缓冲液、蛋白 Marker 碧云天生物科技有限公司;伊曲康唑 江西红星药业有限公司。
TripleTOF 5600质谱仪 美国AB-SCIEX公司;LC-20AB纳升液相色谱仪 日本岛津公司。
1.2 实验方法
1.2.1 蜂胶乙醇提取物(EEP)的制备及菌丝的培养 参照沈菲等[8]方法,用70%乙醇(V/V)提取蜂胶,冷冻干燥得到浸膏,最后用70%乙醇(V/V)溶解。菌丝采用PDB培养基液体培养,EEP终浓度为250 μg/mL,孢子悬浮液终浓度为106CFU/mL。35 ℃、180 r/min培养3 d后收集菌丝用于实验。伊曲康唑(0.08 μg/mL)为阳性对照。
1.2.2 扫描电镜观察 收集菌丝,称取0.5 g菌丝先使用5%的戊二醛固定4 h,然后每隔10~15 min用PBS缓冲液清洗样品,重复三次后,再用1%锇酸固定4 h,每隔10~15 min用蒸馏水清洗,重复三次每隔10~15 min分别使用50%、70%、80%、90%、100%的乙醇逐级稀释,其中100%乙醇置换三次;最后再用叔丁醇置换两次,冷冻干燥后上台、喷金、上机观察、拍照。
1.2.3 iTRAQ标记 采用丙酮沉淀法提取烟曲霉菌丝蛋白,用考马斯亮兰法测定蛋白浓度。经SDS-PAGE检测合格后,每个样品精确取出蛋白100 μg,用Trypsin进行酶解。酶解后的蛋白,进行iTRAQ标签标记。
1.2.4 基于TripleTOF5600的LC-ESI-MSMS分析
1.2.4.1 SCX分离 采用LC-20AB液相系统、分离柱为4.6×250 mm型号的Ultremex SCX柱对样品进行液相分离:将标记后抽干的混合肽段用4 mL buffer A(25 mmol/L NaH2PO4含 25% CAN,pH2.7)复溶,进柱后以1 mL/min 的速率进行梯度洗脱:在5% buffer B(25 mmol/L NaH2PO4,1 mol/L KCl 含 25% CAN,pH2.7)中洗脱7 min,一个20 min的直线梯度使buffer B由5%上升至60%,最后在2 min内使buffer B的比例上升至100%并保持1 min,然后恢复到5%平衡10 min。整个洗脱过程在214 nm吸光度下进行监测,经过筛选得到的12个组分分别用Strata X除盐柱除盐,冷冻抽干。
1.2.4.2 用Triple TOF 5600进行LC-ESI-MSMS分析 将冷冻抽干的样品分别用buffer A(5% CAN,0.1% FA)复溶至约0.5 μg/μL的浓度,20000×g离心10 min,除去不溶物质。每个组分上样5 μL,通过液相色谱仪进行分离。所用的柱子柱包括Trap柱和分析柱两部分。分离程序如下:以8 μL/min的流速在4 min内将样品加载到Trap柱上,总流速为300 nL/min的分析梯度将样品带入分析柱,分离并传输至质谱系统。先在5% buffer B(95% CAN,0.1% FA)下洗脱5 min,35 min内线性梯度使buffer B的比例由5%上升至35%,在接下来的5 min内提高到60%,然后在2 min内buffer B增加到80%并保持2 min,最后在1 min内恢复至5%并在此条件下平衡10 min。质谱采用结合纳升喷雾Ⅲ离子源,扫描模式为反射模式,一级TOF-MS单张图谱扫描时间为250 ms,3.3 s为一个循环,离子碎裂的能量设置为(35±5) eV。
1.2.5 qRT-PCR 随机选取6个差异蛋白,进行qRT-PCR验证。根据数据库中的序列,利用Primer Premier 6.0软件设计引物,引物序列见表1。采用Trizol法提取烟曲霉菌丝蛋白,用PrimeScriptTMRT reagent Kit with gDNA Eraser试剂盒(TAKARA)去除基因组DNA,并进行反转录得到cDNA,使用TB GreenTMPremix Ex TaqTMⅡ(Tll RNaseH Plus)试剂盒进行qPCR反应,反应体系20 μL。扩增条件:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,40个循环。各反应进行三次平行,三次重复。

表1 qRT-PCR引物
1.3 数据处理
对差异蛋白进行生物信息学分析,采用的是Mascot 2.3.02软件从LC-ESI-MSMS得到的蛋白组数据,选用的数据库为NCBI_Aspergillusfumigatus(28160 sequences)。定量的蛋白质比例经过加权,并通过Mascot中的中值比例进行归一化,P<0.05且差异倍数达到1.5倍以上,视该蛋白为不同样品间的差异蛋白[11]。对鉴定出的所有蛋白进行GO功能注释分析,并和COG数据库进行比对,预测这些蛋白质可能的功能并对其做功能分类统计。最后进行差异蛋白的GO功能和KEGG显著性富集分析,GO功能显著性富集分析采用Gene Ontology数据库,pathway代谢通路采Kyoto Encyclopedia of Genes and Genomes(KEGG)数据库进行分析。
2 结果与分析
2.1 EEP对菌丝体超微结构的影响
采用电子扫描电镜观察蜂胶处理过的烟曲霉菌丝形态,结果见图1。对照组菌丝体结构完成、表面比较光滑,菌丝粗细均匀、排列整齐且相互之间界限清晰(图1A);蜂胶处理后的菌丝体发生变形扭曲,表面出现褶皱、皱缩、凹陷、粗糙且粗细不均匀,出现膨大或卷曲,菌丝体之间相互缠绕,界限模糊(图1B);阳性药物组与蜂胶组类似,菌丝体发生变形扭曲,菌丝形态被破坏,不再完整(图1C)。结果表明,1/2 MIC浓度的蜂胶提取物能够有效的破坏菌丝结构和形态,从而抑制烟曲霉的生长。

图1 蜂胶乙醇提取物对烟曲霉菌丝超微结构的影响
2.2 差异蛋白鉴定结果
在本次质谱实验中共得到谱图285207张,通过Mascot软件进行分析后,匹配到的谱图数量是26350张,其中Unique 谱图数量为25617张,共鉴定到2730个蛋白,9766个肽段,其中含9573个Unique 肽段。如图2,根据蛋白丰度差异倍数达到1.5倍以上且P-value小于0.05原则,蜂胶组与对照组蛋白相比,共有284个差异蛋白,其中123(43.5%)个上调,161(56.5%)个下调;药物组与对照组相比,共有239个差异蛋白,其中90个上调,149个下调。
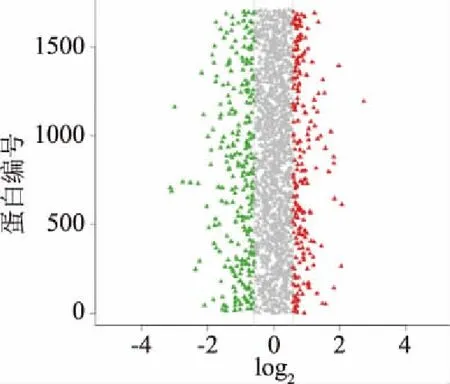
图2 蜂胶处理前后烟曲霉差异蛋白分布图
2.3 差异蛋白GO功能分析
对本次实验鉴定到的蛋白进行GO分析,得到了差异蛋白的基因参与的生物过程(Biological process)、所处的细胞位置(Cellular component)及其分子功能(Molecular function),GO功能分析如表2所示。蜂胶处理后的烟曲霉中鉴定的蛋白参与的生物过程有19类,其中代谢过程(Metabolism process,30.51%)、细胞过程(Cellular process,26.4%)和生物调节(Biological regulation,4.58%)所占比率最大。差异蛋白所处的位置分为11类,主要的分布有细胞(Cell,24.23%)、细胞部分(Cell part,24.23%),细胞器(Organelle,16.07%)、膜(Membrane,8.57%)和细胞器部分(Organelle part,7.89%);对分子功能部分,鉴定的差异蛋白涉及12种分子功能,如转运蛋白活性(transporter activity)、抗氧化活性(antioxidant activity)、核酸结合转录因子活性(nucleic acid binding transcription factor activity)等,其中主要包括的催化活性(Catalytic activity,48.15%)和结合类(Binding,39.14%)两大类,其他都相对较少。

表2 差异蛋白GO功能分析
2.4 差异蛋白Pathway分析
对差异蛋白进一步进行KEGG和COG分析。差异蛋白富集较多的途径如表3所示。药物组和蜂胶组主要富集的10个途径中,有5个共同的途径包括代谢路径、核糖体路径、酪氨酸代谢、丙酮酸盐代谢和糖酵解/糖异生。结果表明,差异蛋白富集较多的主要集中在代谢途径和氨基酸代谢过程中。

表3 差异蛋白Pathway分析
2.5 差异蛋白COG分析
根据COG功能分类,差异表达蛋白质分为21个功能类别,由图3可知,除分类未知的差异蛋白外,其他主要集中在氨基酸运输和代谢(amino acid transport and metabolism)、能量生产和转换(energy production and conversion)、蛋白质翻译后修饰(Posttranslational modification)、翻译和核糖体结构(Translation,ribosomal structure and biogenesis)和碳水化合物的运输和代谢(carbohydrate transport and metabolism)等。蜂胶处理过的烟曲霉菌丝中的参与呼吸电子传递链、ATP生成及细胞壁/细胞膜等过程的部分差异蛋白结果见表4。

图3 差异蛋白COG注释分析

表4 蜂胶处理组的部分差异蛋白
2.6 差异表达蛋白的qRT-PCR验证
为了验证蜂胶组的差异表达蛋白在 mRNA水平的变化,随机选择6个差异蛋白对应的基因进行mRNA 表达水平的分析。图4表明在蜂胶作用下,除了核糖体蛋白60S(ribosomal protein 60S)的蛋白表达趋势与mRNA水平上的表达趋势不一致外,其他5个蛋白和mRNA水平的表达趋势都一致。
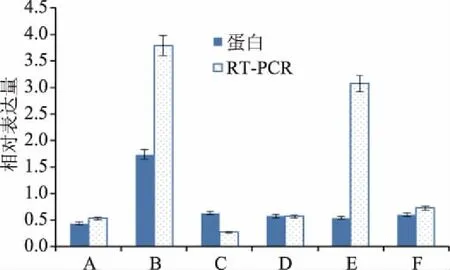
图4 差异蛋白RT-PCR验证
3 讨论与结论
关于蜂胶抑菌机制的研究报道表明,蜂胶能够改变菌体超微结构、影响真菌ATP的生成并影响菌体核酸形成。Peng等[12]研究了从蜂胶中分离出松鼠素对特异青霉具有很强的抗菌活性,通过深入研究发现松鼠素能够抑制特异青霉孢子萌发时期和菌丝生长时期的线粒体的呼吸,同时松鼠素处理后的菌丝,细胞膜不是很明显,细胞器消失。说明松鼠素可以干扰体内能量平衡,破坏病菌细胞的质膜,从而抑制特异青霉菌丝的生长。此外,槲皮素能够抑制DNA促旋酶,槐属蜂胶能够抑制胞质膜功能,而且蜂胶中的干草查尔酮 A和C能够抑制能量代谢[13]。Plaper等[14]研究表明槲皮素能够和大肠杆菌DNA促旋酶Gyr B亚基结合,抑制ATP酶活性。Haraguchi等[15]研究了甘草查尔酮A和C抗菌作用方式,这些黄酮类化合物能抑制菌体呼吸,降低菌体主动运输各种代谢产物和合成的大分子的速度,干扰菌体的能量代谢过程。
前期研究表明,蜂胶能够抑制烟曲霉菌丝的生长和呼吸速率,且蜂胶处理后的菌丝孢子的超微结构严重受损。本研究利用iTRAQ技术对伊曲康唑和蜂胶乙醇提取物处理的烟曲霉进行了蛋白质组学研究,分别鉴定到了239和284个差异蛋白。
蜂胶乙醇提取物处理后,参与呼吸电子传递链的部分蛋白,如FAD结合域蛋白亚基、NAD-依赖性甲酸脱氢酶、NADH 泛醌氧化还原酶、细胞色素c亚基Vb、细胞色素c氧化酶家族蛋白、电子转移黄素蛋白均下调,而黄素血红蛋白、细胞色素氧化酶亚基2、NADH脱氢酶亚基上调。同时,蜂胶处理组耗氧量明显低于对照组,说明蜂胶乙醇提取物能明显抑制烟曲霉菌丝生长过程中的生长和呼吸。由于线粒体呼吸链与能量代谢有关,因此呼吸作用的抑制会干扰许多生理过程。目前,病原菌的呼吸链被认为是潜在的抗菌靶点。呼吸链抑制剂通过抑制蛋白合成,能够有效地阻断病原菌的萌发[16]。两性霉素B能够有效抑制烟曲霉,用两性霉素B处理烟曲霉菌后,参与呼吸电子传递链的蛋白表达也发生了变化[10]。
在蜂胶乙醇提取物存在的情况下,许多参与ATP产生的蛋白,包括ATP合酶亚基H和线粒体F1F0 ATP合酶亚基都被下调。此外,腺苷酸激酶(adenylate kinase,AK)并在蜂胶的作用下表达上调。该酶通过将一个磷酸基从ATP转移到AMP来催化ADP的合成,在维持细胞能量稳态中发挥重要作用。当机体处于低能量水平时,AK可以催化AMP产生ADP和ATP,因此AK可能会影响ADP和ATP的水平,介导细胞凋亡[17-18]。此外,与碳水化合物转运和代谢相关的14种差异表达蛋白中有12种表达下调。这些下调的蛋白主要参与糖酵解(triose异构酶)[19]、戊糖磷酸途径(ribose 5-磷酸异构酶A、6-磷酸葡萄糖苷actonase、transaldolase)等过程[20-21]。因为呼吸作用与ATP的产生有关,而ATP为烟曲霉的萌发和生长提供能量。蜂胶乙醇提取物处理烟曲霉后,菌丝ATP水平降低。结果表明,蜂胶乙醇提取物可干扰烟曲霉的呼吸电子传递链,并降低ATP的产生。
微管蛋白是细胞骨架的主要组成部分,在维持细胞形态、细胞分裂、信号转导等过程中起着重要作用。微管蛋白聚集或微管解聚的抑制将导致细胞有丝分裂中止[22]。很多天然产物通过结合在微管蛋白的 CLC部位或 V LB部位而抑制其聚集,因此微管靶向剂结合微管蛋白的特殊部位,已在癌症患者的治疗中发挥重要作用。由此,许多研究提出微管可能是唯一的最佳癌症靶点[23-25]。本文中,蜂胶乙醇提取物处理烟曲霉后,微管蛋白的差异性最显著,上调6倍。此外,参与染色质结构和动力学的核小体结合蛋白和组蛋白H4均下调。因此,蜂胶乙醇提取物可能会影响烟曲霉细胞中纺锤丝的形成,从而抑制细胞的分裂。
核糖体蛋白是组成核糖体的主要成分,与核糖体RNA共同组成了核糖体,其不仅在核糖体组装和蛋白质合成中起重要作用,还具有广泛的核糖体外功能。如DNA 损伤修复、基因表达调控、mRNA翻译、细胞的增殖、分化和凋亡等。有证据表明核糖体蛋白缺失会引起细胞周期阻滞和细胞凋亡等[26]。本实验鉴定出8个核糖体蛋白,其中有7个显著(P<0.05)下调,因此蜂胶乙醇提取物能够影响烟曲霉菌丝核糖体的合成,从而抑制菌丝生长。
蜂胶组和阳性药物组,有101个相同的差异蛋白,其中9个表达差异趋势相反,其他蛋白表达趋势都一致。表达趋势一致的92个蛋白中,有69个表达下调,说明蜂胶乙醇提取物和伊曲康唑对烟曲霉有部分类似的抑制作用。此外,一些差异表达蛋白也在卡泊芬净,两性霉素B处理烟曲霉的研究中被报道[9-10]。例如几丁质酶,这是一种完整的膜蛋白,参与真菌细胞壁的降解,经过两性霉素B和蜂胶处理后表达上调。目前,由于几丁质酶抑制微生物病原菌生长的能力,已被用在抗真菌药物的研制中[27]。此外,翻译延伸因子和β-葡萄糖苷酶经两性霉素B和蜂胶乙醇提取物处理后也上调。蜂胶乙醇提取物处理中所有核糖体蛋白的反应均下调,而卡泊芬净处理组中所有核糖体蛋白的反应均上调[9]。蛋白组数据说明蜂胶和抗生素抑菌机制并不完全相同。
此外,越来越多的研究报道基因转录水平和相应蛋白质表达水平之间并不完全一致[28-32]。烟曲霉在培养温度从30 ℃换到48 ℃时,超过一半的蛋白表达水平和转录表达水平并不正相关。Albrecht等[28]阐述了“时间延迟模式”,表明由于翻译过程在转录过程之后,因此两者并不在一个时间点上,所以表达水平并不会完全一致。而且,mRNA 到蛋白质的过程中有许多环节,比如:复杂的剪切过程、翻译过程及其环境影响如核糖体、tRNA以及氨基酸原料的状态、翻译后蛋白成熟剪接和修饰、成熟蛋白的稳定期等[33],这些因素也会影响两者表达水平的变化。
综上所述,蜂胶乙醇提取物对烟曲霉具有较强的抑制作用。蛋白组学研究表明,蜂胶乙醇提取物处理可以抑制烟曲霉菌丝生长、呼吸作用、ATP水平相关蛋白的表达,从而抑制烟曲霉的生长。
——曲霉菌

